流式细胞仪在检测系膜细胞衰老特征中的应用
田 晓 史国辉 孙淑丰 孟晓华 冯晓明 徐湜潺 孙 原 董 科 王玉浔
(河北联合大学附属医院肾内科,河北 唐山 063000)
流式细胞仪是采用流式细胞技术对细胞或颗粒悬液进行快速分析的自动化分析仪器。流式细胞术(FCM)通过对流动液体中排成单列的细胞或颗粒进行逐个分析、测定细胞或颗粒的光散射和荧光情况,以获得其大小、内部结构、DNA、RNA、蛋白质、抗原等物理及化学特征。这种分析仪器综合了光学、电子学、流体力学、细胞化学以及激光和计算机等多门学科和技术,具有检测速度快、测量指标多、采集数据量大、对所需的细胞或颗粒可以进行分选等特点,在细胞生物学、分子生物学、肿瘤学、血液学、免疫学、遗传学等方面得到了广泛的应用。本文正是根据FCM的特点,将其应用到检测系膜细胞衰老的特征中,验证其可行性。
1 材料与方法
1.1 材料 3月龄健康雄性Wistar大鼠〔河北联合大学实验动物中心提供,SCXK(京)2010-0013〕10只。RPMI 1640细胞培养粉剂及Trypsin(h1∶250)购于美国GIBCO公司。胎牛血清购于美国 Hyclone公司。5-溴 4-氯-3-吲哚-β-D-半乳糖苷(X-gal)购于美国Program公司。碘化吡啶(PI)及RNA酶购于美国Sigma公司。
1.2 方法
1.2.1 原代大鼠系膜细胞培养 无菌条件下取双侧肾脏,剥离肾包膜,用剪刀把肾皮质剪成碎块,放于重叠的3层不锈钢筛网上研磨,镜下观察,若见98%以上的肾小球脱去包曼囊,视野中基本上无肾小管存在,即可停止冲洗,收集第2层筛网上的组织移入离心管,V型胶原酶消化后,应用15%胎牛血清的RPMI1640培养液,37℃、5%CO2条件下培养原代的系膜细胞,约7 d后第1次传代,传代的细胞24 h全部贴壁,生长迅速,形态为梭形或不规则星形,3~4 d已汇合成片,纯度极高,经鉴定结蛋白(Desmin)阳性、抗Ⅷ因子抗体阴性,传代,用于实验的为第3、5、10 代。
1.2.2 衰老相关β-半乳糖苷酶活性(SA-β-gal)染色 种于六孔板中的各组细胞,待细胞生长至80%汇合,用PBS液清洗3次,于室温固定细胞5 min,PBS液清洗3次后,加上新配制的含1 mg/ml X-gal的 SA-β-gal染液,置 37℃(无 CO2)温育12~16 h,PBS液清洗3次后,观察细胞胞质中蓝色沉淀,用数码相机照相。
1.2.3 流式细胞仪检测细胞自发荧光、细胞周期及细胞大小细胞培养至70% ~80%融合时,PBS洗2次,0.25%胰酶消化,收集离心管中。取1×106个细胞,75%乙醇4℃固定过夜(可于4℃存放1 w备用)。测定前离心除去75%乙醇,用PBS洗2次,重悬于0.5 ml PBS中。应用Becton-Dickinson流式细胞仪(激发光波长488 nm,发射光波长570 nm)检测自发荧光。然后样品经50 μg/ml RNA酶处理后,用PI 50 μg/ml于暗处染色30 min后上机。应用流式细胞分析仪的FACScan测量DNA含量,以前向角散射光(FSC)的平均强度来反映细胞的大小,细胞周期变化数据用Cell FIT Cell Cycle Analysis Version 2.18.2软件分析;以细胞周期各时相细胞百分率记录数据并分析;细胞增殖指数(PI)=(S+G2/M)/(G0/G1+S+G2/M)×100%。
1.3 统计学方法 使用SPSS11.0软件,计量资料使用±s表示,组间差异比较采用单因素方差。
2 结果
2.1 大鼠原代系膜细胞增殖能力 3月龄大鼠的原代系膜细胞为长梭形或不规则星形,贴壁后生长迅速,约3~4 d后可传第1代,可传10代以上。但在传代过程中,系膜细胞逐渐衰老,细胞肥大,形态变扁平、伸展,排列稀疏,代谢减慢、生长停滞,失去增殖和传代能力。实验用细胞为第3、5、10代。
2.2 细胞SA-β-gal染色结果 细胞衰老时均伴随着β-半乳糖苷酶活性增高,因此SA-β-gal染色是目前国际公认的细胞复制性衰老的特征性指标〔1〕。本研究结果显示:第3代系膜细胞染色阳性率很低,仅为(8.6±2.5)%,而随增龄,系膜细胞βgal染色阳性率也逐渐增高,第5代为(27.0±3.9)%,而第10代细胞阳性率高达(76.9±9.6)%,3组间两两相比,差异有统计学意义(均为P<0.05),表明大鼠原代系膜细胞随传代次数的增长而发生衰老。
2.3 自发荧光的检测 第3、5、10代自发荧光强度分别系膜细胞传代过程中,自发荧光逐渐增强(P<0.05)。见图1。
2.4 不同代次系膜细胞的细胞大小 流式细胞仪检测的结果显示,第3代系膜细胞FSC荧光强度最弱,随着传代次数的增加,FSC荧光强度显著增加,即细胞体积明显增大。见图2。
2.5 不同代次系膜细胞的周期分析 原代细胞生长旺盛,细胞增殖加速,处于S期的细胞明显多于传代中的各代细胞。系膜细胞在传代过程中生长逐渐减慢,细胞从G1期进入S期的比例逐渐降低。传代末期,细胞生长趋于停滞,死亡细胞增加(表1)。
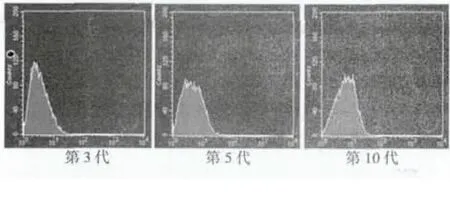
图1 流式细胞术检测各代细胞自发荧光
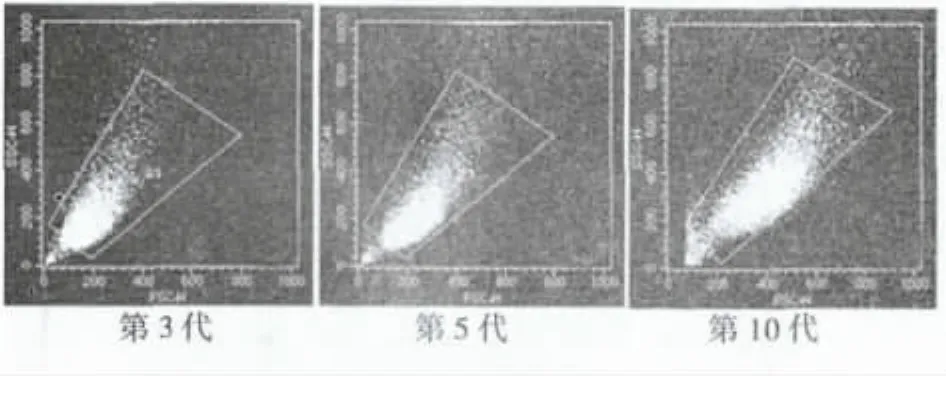
图2 流式细胞术检测FSC荧光强度
表1 不同代次系膜细胞的周期分析(%,n=3,±s)
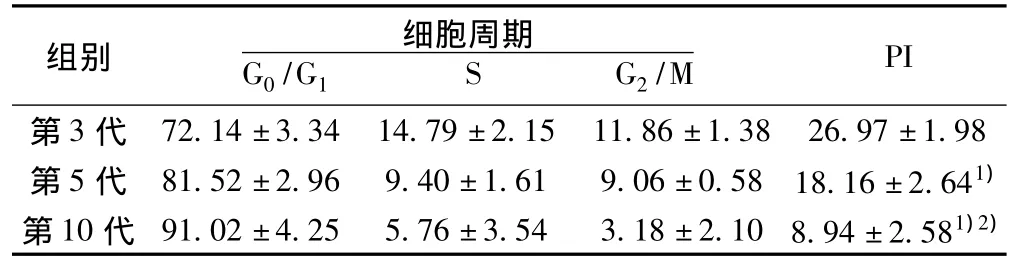
表1 不同代次系膜细胞的周期分析(%,n=3,±s)
与第3代比较:1)P<0.05;与第5代比较:2)P<0.05
PI第3代 72.14±3.34 14.79±2.15 11.86±1.38 26.97±1.98组别 细胞周期G0/G1 S G2/M第5代 81.52±2.96 9.40±1.61 9.06±0.58 18.16±2.641)第10代 91.02±4.25 5.76±3.54 3.18±2.10 8.94±2.581)2)
3 讨论
随着年龄的增长和细胞的老化,系膜细胞功能的下降与异常,与许多衰老相关肾脏疾病的发生、发展有着极为密切的关系〔2〕。本实验证实系膜细胞在传代过程中,细胞形态发生着明显的变化。SA-β-gal是公认的细胞老化的生物标志。在各种类型体内或体外的老化细胞,该酶的活性增强。本实验结果显示,在传代过程中,细胞形态与功能发生着明显的变化,细胞逐渐走向衰老。系膜细胞的自发荧光逐步增强。细胞传代末期,细胞的自发荧光现象达到顶点。目前认为,细胞自发荧光现象与细胞内脂褐素的形成与积聚有关〔3〕。脂褐素的堆积促进老年色素斑的出现,导致细胞分化能力降低,是细胞衰老的表现之一。研究人员发现脂褐素含量高的细胞在外界有害因素的作用下,较正常细胞更易出现损伤〔4〕。脂褐素与体内氧自由基生成,导致溶酶体、线粒体等细胞器中的铜发生脂质过氧化有关。过度加剧的脂质过氧化反应产生过量的脂褐素,从而出现脂褐素沉着。脂褐素沉积在细胞中,导致细胞代谢减缓、活性下降、细胞损伤等细胞老化的表现。在高传代细胞,细胞的自发荧光产物显著增加,自发荧光强度增强,说明脂褐素的积累达顶峰。可见,在衰老的过程中,细胞内脂质过氧化增强,并可能与氧自由基合成增加有关。
细胞肥大是衰老细胞的最基本标志及形态特征〔5~8〕。本实验结果显示,随着传代次数的增加,FSC荧光强度显著增加,即细胞体积明显增大,细胞逐渐衰老。
细胞周期状态反映了细胞的增殖能力。增殖旺盛的细胞处于S期的比例较高〔9〕。细胞衰老时,细胞增殖能力降低,细胞生长停滞。本结果说明在不断传代时,由于细胞衰老,功能下降,DNA错配率增加,摄取各种物质的能力降低,随之而来的是增殖减缓。
综上所述,随着系膜细胞不断的传代,细胞形态退化,SA-β-gal活性增强,体积增大,细胞增殖能力降低,显示细胞有明显的复制性衰老特征〔10~12〕。在系膜细胞衰老的过程中,细胞内脂质过氧化作用增强,导致自发荧光产物增加。而流式细胞仪能很好的检测到这些改变,因此它是一种检测细胞衰老指标的良好方法,可以广泛应用到细胞衰老的研究中。
1 Dimri GP,Lee X,Basile G,et al.A biomarker that identifies senescent human cells in culture and in aging skin in vivo〔J〕.Proc Natl Acad Sci USA,1995;92(20):9363-7.
2 Marshall CB,Shankland SJ.Cell cycle and glomerular disease:a minireview〔J〕.Nephron Exp Nephrol,2006;102(2):e39-48.
3 Katz ML,Wendt KD,Sander DN,et al.RPE65 gene mutation prevents development of autofluorescence in retinal pigment epithelial phagosomes〔J〕.Mech Ageing Dev,2005;126(4):513-21.
4 Godley BF,Shamsi FA,Liang FQ,et al.Blue light induces mitochondrial DNA damage and free radical production in epithelial cells〔J〕.J Biol Chem,2005;280(22):21061-6.
5 Blagosklonny MV.Cell senescence:hypertrophic arrest beyond the restriction point〔J〕.J Cell Physiol,2006;209(45):592-7.
6 Yamauchi T,Kamon J,Minokoshi Y,et al.Adiponectin stimulates glucose utilization and fatty-acid utilization by activating AMP-activated protein kinase〔J〕.Nat Med,2002;8(4):1288-95.
7 Combs TP,Pajvani UB,Berg AH,et al.A transgenic mouse with a deletion in the collagenous domain of adiponectin displays elevated circulating adiponectin and improved insulin sensitivity〔J〕.Endocrinology,2004;8(145):367-83.
8 Sharma K,Ramachandrarao S,Qiu G,et al.Adiponectin regulates albuminuria and podocyte function in mice〔J〕.J Clin Invest,2008;3(118):1645-56.
9 Cammisotto PG,Bendayan M.Adiponectin stimulates phosphorylation ofAMP-activated protein kinase in renal glomeruli〔J〕.J Mol Histol,2008;39(6):579-84.
10 Shen YY,Hughes J,Charlesworth JA,et al.Adiponectin is present in the urine in its native conformation,and specifically reduces the secretion of MCP-1 by proximal tubular cells〔J〕.Nephrology,2008;13(1):405-10.
11 Rakatzi I,Mueller H,Ritzeler O,et al.Adiponectin counteracts cytokineand fatty acid-induced apoptosis in the pancreatic beta-cell line INS-1〔J〕.Diabetologia,2006;47(48):249-58.
12 King TD,Song L,Jope RS,et al.AMP-activated protein kinase(AMPK)activating agents cause dephosphorylation of Akt and glycogen synthase kinase-3〔J〕.Biochem Pharmacol,2006;71(32):1637-47.

