培美曲塞加顺铂诱导化疗联合同期放化疗对局部晚期非小细胞肺癌的疗效
伍楚蓉 杨 文 黄红东 罗 宁 (南方医科大学附属南海医院肿瘤科,广东 佛山 5800)
局部晚期非小细胞肺癌占就诊肺癌的1/3以上,以往以手术或放疗为主,国内外大宗病例报道ⅢA、ⅢB期手术的5年生存率分别为23.0% ~26.3%、6% ~7%〔1〕;常规放疗60 Gy和三维适形放疗的5年生存率分别为4% ~6%和19%〔2〕。因此,如何提高Ⅲ期NSCLC患者生存期、降低死亡率一直都是肺癌研究的重点。同期放化疗是不能手术局部晚期NSCLC患者的标准治疗手段。多个随即研究证明放化疗优于单独放疗或单纯化疗,而同期放化疗则优于序贯放化疗〔3~5〕。局部NSCLC容易发生远处转移,诱导化疗则可降低这一危险因素。因此,诱导化疗联合同期放化疗是治疗晚期NSCLC的有效方法〔6〕。三维适形放疗(3DCRT)已广泛应用于晚期NSCLC的治疗。与标准3DCRT相比,调强放疗(IMRT)所产生的大剂量区更接近肿瘤的立体状态,对正常组织的照射更小。从2008年2月起本院采用培美曲塞加顺铂方案诱导化疗及同期调强放疗进行了90例Ⅲ期NSCLC的随机对照临床研究。
1 材料与方法
1.1 入组标准 符合国际抗癌联盟2002分期标准的Ⅲ期病例;病理学证实不能接受手术或手术不能切除的Ⅲ期NSCLC患者;卡氏评分≥70分;心肺肝肾功能基本正常,年龄18~70岁;血常规基本正常,血红蛋白≥100 g/L;体质指数(BMI)≥18.5 kg/m2;既往无其他肿瘤病史。
1.2 排除妊娠 妊娠,哺乳期;有严重感染患者;有较严重慢性支气管炎病史;主要器官衰竭;神经内分泌功能异常;BMI≤18.5 kg/m2。
1.3 一般临床资料 选取2008年2月至今采用调强放疗的90例局部晚期NSCLC初治患者,签署知情同意书后采用随机数字表法分为同期放化疗(CCRT)组和诱导化疗加同期放化疗(ICCRT)组。两组患者临床资料分布和可比性见表1。
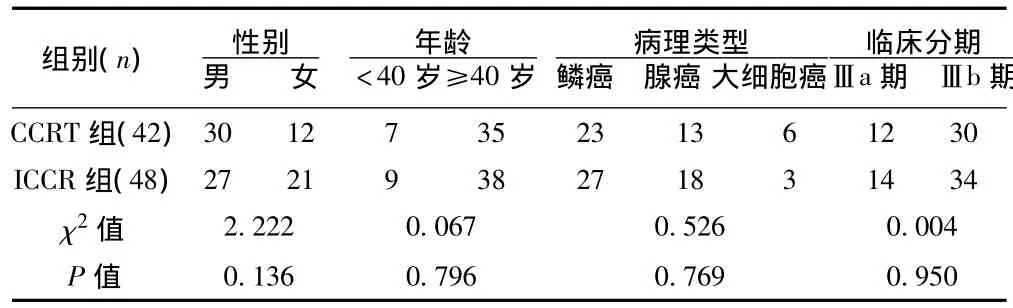
表1 90例Ⅲ期NSCLC患者CCRT和ICCRT的临床资料分布与比较(n)
1.4 治疗方法 (1)化疗:ICCRT组现行培美曲塞+顺铂方案诱导化疗2个周期然后同期放化疗;诱导化疗方案2个周期,其中:培美曲塞500 mg/m2静脉滴注第l天,顺铂80 mg/m2静脉滴入第1天,21 d为1个周期。CCRT组只行2个周期培美曲塞 +顺铂方案化疗,但剂量强度不同,其中培美曲塞500 mg/m2静脉滴入第1天,顺铂25mg/m2静脉滴入第1~2天。用首次培美曲塞给药前7 d肌注维生素B 1 000 mg/次,口服叶酸400 mg/d。培美曲塞用药前日、当日和次日口服地塞米松8 mg/d。化疗同时进行保肝、止吐和营养支持等处理。所有病例每周期化疗前进行体检、血液学和血生化检测和药物相关不良反应评估。ICCRT组第2 w期化疗开始后14 d利用1 w时间做同期放疗准备工作,包括强化胸部CT定位、靶区规划和放疗计划设计等。CCRT组直接进行上述准备工作。(2)调强放疗实施:①CT扫描:用双螺旋CT扫描机(西门子公司)做CT扫描。扫描图像的范围从胸廓人口至肋膈角水平,扫描层厚为0.5 cm,全部病例均做增强扫描,完成扫描后,图像数据以局域网传递到计划系统。②计划设计:包括患者信息资料、图像资料注册、影像图像融合、解剖结构的确定、处方剂量的授予、优化与剂量计算、结果的显示等步骤。勾画靶区,按照STAR 2000三维逆向治疗计划系统提供的ICRU 50号文件标准,根据影像的解剖结构逐层勾画出大体肿瘤体积(GTV)和(或)临床靶体积(CTV),计划靶体积(frrV)为在模拟机下观测患者各方向的呼吸动度,并综合考虑病变部位、摆位误差等因素后在CTV基础上各方向外放1.0~1.5 cm而得,然后勾画出危及器官结构。正常肺组织用接受20 Gy照射体积占全肺体积百分比(V加)作评估。处方剂量和计划的确认,对GTV和(或)CTV及对应的V靶体积分别给出目标剂量,然后对邻近危及器官给出限度的最小剂量、最大剂量和照射百分体积,系统自动进行逆向运算。③计划确认:用剂量体积直方图,逐层观察各截面图的靶区剂量分布和危及器官受量及相应的体积百分比,综合评价确定治疗计划,选出最优计划,待医师作剂量验证(±3%)及体位验证(摄片)后实施治疗。④治疗方法:所有患者都采用全程调强放疗,靶区剂量为2 Gy/次、5次/w,总剂量为66 Gy。放疗期间CT复位校正靶区1次。治疗过程中除配合化疗输液支持外,有需要者适当补充能量。化疗结束后48 h给予重组人粒细胞集落刺激因子升白细胞治疗,血象符合要求停药。
1.5 近期疗效和不良反应评估 近期疗效采用实体瘤疗效评价标准(RECIST)1.1版判定,其中CR为完全缓解、PR为部分缓解、NC为稳定、PD为进展,CR+PR为有效,ND+PD为无效。放疗结束后4 w CT或CT检查,以及其他必要检查。治疗期间或治疗结束时进行近期不良反应评估,其中血液学不良反应参考不良反应常见术语标准3.0版进行,食管和肺急性不良反应参照美国放疗肿瘤组织或欧洲癌症研究与治疗组织标准评价〔7〕。
1.6 统计学方法 生存期自治疗开始至死亡或末次随诊时间,疾病进展时间(TTP)为治疗开始至疾病进展时间。采用SPSS18.0软件进行Kaplan-Meier法计算生存率并Logrank法检验,两组临床资料和近期疗效以及不良反应比较用χ2检验。
2 结果
2.1 近期疗效 全组患者均按计划完成治疗,可评价疗效。CCRT 组有效率为 70%,CR、PR、SD、PD 分别为 4、25、9、4 例;ICCRT 组分别为80%,6、32、7、3 例(χ2=1.206,P=0.272)。
2.2 生存时间和疾病进展时间 随访时间4~42个月,全部两组的随访率为 100%。CCRT组1、2、3年生存率分别为65%、40%、33%,ICCRT 组为 85%、50%、44%(χ2=3.90,P=0.048)。CCRT组生存和疾病进展时间中位数分别为17.5个月和14.0个月,ICCRT组为22.0个月和19.0个月。
2.3 复发转移情况 CCRT组中2例确诊24个月后出现骨转移,1例确诊21个月后出现肺内转移,2例确诊19个月出现脑转移。ICCRT组中1例确诊26个月后发生骨转移,3例确诊20~30个月后出现脑转移。
2.4 不良反应 两组最常见不良反应依次为白细胞减少、放射性食管炎、血红蛋白减少和放射性肺炎,见表2。
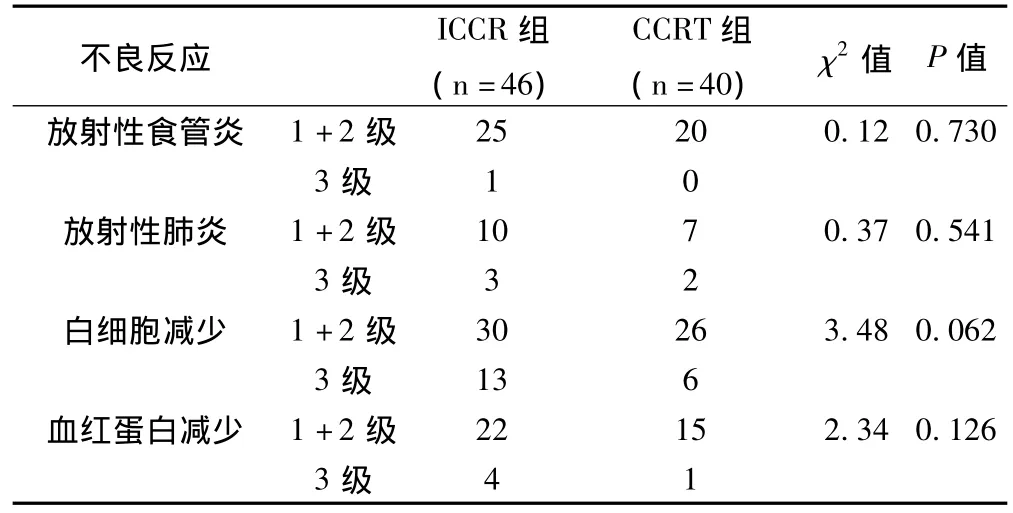
表2 90例Ⅲ期NSCLC患者同期放化疗和诱导化疗加同期放化疗的不良反应分布与比较
3 讨论
放化疗联合是晚期NSCLC当前最常见治疗模式。同期放化疗加辅助或新辅助化疗可能降低癌症患者远处转移发生,延长生存期。大量数据表明新辅助化疗是有效的,它能增加患者完成整个化疗周期的可能性。铂类药物化疗除治疗可能存在的亚临床微小转移病灶外,还可通过乏氧细胞再氧合、阻止亚致死性和潜在致死性损伤修复来提高细胞放射敏感性。
3DCRT是治疗NSCLC的标准放疗技术〔8〕,IMRT是建立在3DCCRT基础上的更为先进的技术。肺是放疗敏感器官,放射性肺炎会导致患者生活治疗下降甚至死亡。因此,放射性肺炎常是胸部肿瘤放疗中所首要考虑的问题,肿瘤周围正常肺也往往是导致放疗剂量不能提高的剂量限制性器官。与3DCRT相比,IMRT技术的肿瘤物理剂量分布适形度更高,有利于提高靶区剂量,提高肿瘤局部控制率,并有对正常组损伤较轻,产生不良反应概率小的优点〔9,10〕,在局部晚期NSCLC患者中发挥了非常重要的作用。本组患者经IMRT后放射性肺炎发病率较低,两组均无4级放射性肺炎。
培美曲塞为抗代谢类抗癌药,其作用机制通过阻断嘌呤和嘧啶合成所需要的酶使细胞分裂停止于S期,从而抑制肿瘤细胞的生长〔11〕。因其较好的治疗效果和较小的副反应逐渐运用于非小细胞肺癌的二线治疗。近期进行的两项有关局部晚期或转移性非小细胞肺癌的Ⅱ期临床研究(一项在欧洲,另一项在美国)表明:培美曲赛(500 mg/m2)联合卡铂(AUC=6)每3周方案治疗非小细胞肺癌,其总有效率分别为32%、24%,中位生存期为 10.5、13.5 个月,1 年生存率分别为 44%、56%〔12,13〕。另外,有研究表明培美曲赛联合同期放疗具有协同增敏作用。2007年Seiwert等〔14〕报道了培美曲赛、卡铂联合同期放疗局部晚期或转移性非小细胞肺癌和食管癌的I期临床研究,其中方案1为培美曲赛200~600 mg//m2,方案 2为培美曲赛(500 mg/m2)+剂量递增的卡铂(AUC=4~6),两个方案均联合同期放疗44~66 Gy;共30例患者入组,18例用方案1治疗,12例采用方案2治疗,观察到4例完全缓解和8例部分缓解,取得了令人鼓舞的疗效。标准的非小细胞肺癌治疗方案以顺铂联合诺维本或吉西他滨为主取得了一定的疗效,但尚不理想,既往文献表明疗效相似,有效率多在40% ~50%之问。如何选择疗效好、副反应轻的化疗方案一直是各位学者努力的方向。培美曲塞是基于经典的抗代谢类药物甲氨蝶呤和氟尿嘧啶基础上研制的新一代抗代谢药,研究显示培美曲塞能够明显抑制胸苷酸合成酶、二氢叶酸还原酶和甘氨酰胺核苷甲酰基转移酶的活性,通过对这些关键酶活性进行多靶点抑制,使得嘌呤和胸腺嘧啶核苷生物合成减少,从而影响肿瘤细胞DNA合成,抑制细胞增殖〔11〕。
本研究结果表明培美曲塞加顺铂方案诱导化疗联合同期IMRT放化疗对晚期NSCLC有较好疗效和安全性,与单独应用同期3DCRT放化疗相比,能提高NSCLC的有效率,延长生存期和疾病发展进展时间,且并未增加不良反应。国内外也有研究结果显示诱导化疗同期放化疗并不能延长晚期NSCLC患者生存时间,可能与诱导化疗方案及剂量有关。Vokes等〔15〕采用的诱导化疗方案为紫杉醇和卡铂的结果并不理想,而Waters等〔16〕采用长春碱和顺铂联合放疗对294例晚期NSCLC患者进行了为期10年的回顾研究,结果表明该方案可显著延长总生存时间,提示恰当方案和剂量的诱导化疗联合同期化疗是晚期NSCLC一个较好的综合治疗方案。Hui等〔17〕的多西他赛加顺铂诱导化疗加同期放化疗晚期鼻咽癌的Ⅱ期临床研究结果表明,与单纯同期放化疗相比加用诱导化疗能显著延长患者生存期。同期放化疗可增加肿瘤对放疗的疗效,同时可控制远处转移;但会在一定程度上增加副反应,主要表现为食管急性副反应的增加。国际上同类研究中3~4级放射性食管炎的发生率约为14% ~37%〔18~20〕。本研究结果显示严重放射性食管炎发生率为1%,低于国际上同类报道;这可能与我们采用调强放疗从而对正常肺组织受量进行严格限制,更好保护了正常肺组织有关,同时对于疗中出现粒细胞减少性发热患者积极进行抗生素的预防性应用,从而避免了合并严重感染。结合本研究结果来讲,培美曲塞加顺铂方案诱导化疗联合同期IMRT放化疗对晚期非NSCLC有较好的疗效,值得进行多中心随机对照研究来进一步评价该方案的疗效。
1 张志庸,郭 峰,崔玉尚,等.北京协和医院治疗肺癌生存率变化分析〔J〕.中国肺癌杂志,2005;8(2):24.
2 Chen M,Jiang G,Fu X.Prognostic factors for local control innon small cell lung cancer treated with definitive radiation therapy〔J〕.Am J Clin Oncol,2002;25(1):76-80.
3 吕纪马,王绿化,周宗玫,等.放射治疗同步紫杉醇化疗局部晚期非小细胞肺癌的Ⅱ期临床研究〔J〕.中华放射肿瘤学杂志,2004;13(2):89-92.
4 Curran W,Scott C,Langer C,et al.PhaseⅢ comparison of sequential vs.concurrent chemoradiation of patients with unresected stageⅢnonsmall cell lung cancer(NSCLC):initial report of radiation therapy oncology group(RTOG)9410〔J〕.Proc Am Soc Clin Oncol,2000;19(3):484a.
5 Belani CP,Choy H,Bonomi P,et al.Combined chemoradiotherapy regimens of paclitaxel and carboplatin for locally advanced non-small-cell lung cancer:a randomized phaseⅡlocally advanced multi-modality protocol〔J〕.J Clin Oncol,2005;23(2):5883-91.
6 PORT meta-analysis trialists group.Postoperative radiotherapy for nonsmall cell lung cancer〔J〕.Cochrane Database Sys Res,2005;18(1):CD002142.
7 附录Ⅲ.RTOG/EORTCj急性和慢性放射损伤分级标准//殷蔚伯,余子豪,徐国镇.肿瘤放射治疗学〔J〕.第4版.北京:中国协和医科大学出版社,2008:1350-2.
8 Pater RR,Mehta M.Three-dimensional conformal radiotherapy for lung cancer:promises and pitfalls〔J〕.Curr Oncol Rep,2002;4(3):347-53.
9 Murshed H,Liu H,Liao Z,et al.Dose and volume reduction for normal lung using intensity-modulated radiotherapy for advanced-stage nonsmall-cell lung cancer receiving concomitant chemoradiotherapy〔J〕.Int J Radiat Oncol Biol Phys,2004;58(1):1258-67.
10 Liao ZX,Komaki RR,Thames HD,et al.Influence of technologic advanced on outcomes in patiens with unresectable locally advanced nonsmall-cell lung cancer receiving concomitant chemoradiotherapy〔J〕.Int J Radiat Oncol Biol Phys,2010;76(2):775-81.
11 李树婷,马 飞,孙 燕.抗肿瘤代谢新药——培美曲塞〔J〕.癌症进展杂志,2005;3(1):471-6.
12 Seagliotti GV,Kortsik C,Dark GG,et al.Pemetrexed combined with oxaliplatin or carboplatin as first-line treatment in advanced non-small cell lung cancer:a multicenter,randomized,phase Ⅱ trial〔J〕.Clin Cancer Res,2005;11(2 Pt 1):690-6.
13 Zinner RG,Fossella FV,Gladish GW,et al.PhaseⅡ study of pemetrexed in combination with arboplatin in the first-line treatment of advanced nonsmall cell lung cancer〔J〕.Cancer,2005;104(2):2449-56.
14 Seiwert TY,Connell PP,Mauer AM,et al.A phase I study of pemetrexed,carboplatin,and concurrent radiotherapy in patients with locally advanced or metastatic non-small cell lung or esophageal cancer〔J〕.Clin Cancer Res,2007;13(2 Pt 1):515-22.
15 Vokes EE,Herndon JEⅡ,Kelley MJ,et al.Induction chemotherapy followed by chemoradiotherapy compared with chemoradiotherapy alone for regionally advanced unresectable stageⅢnon-small-cell lung cancer:cancer and leukemia group B〔J〕.J Clin Oncol,2007;25(2):1698-704.
16 Water SE,Dingle B,Rodriguez G,et al.Analysis of a novel protocol of combined induction chemotherapy and concurrent chemoradiation with vinblastine,cisplatin,and radiation therapy〔J〕.Clin Lung Cancer,2010;11(3):243-50.
17 Hui EP,Ma BB,Leung SF,et al.Randomized phase Ⅱtrial of concurrent cisplatin-radiotherapy with or without neoadjuvant docetaxel and cisplatin in advanced nasopharyngeal carcinoma〔J〕.J Clin Oncol,2009;27(1):242-9.
18 Foumel P,Robinet G,Thomas P,et al.Randomized phase Ⅲ trial of sequential chemoradiotherapy compared with concurrent chemoradiotherapy in locally advanced nonsmall cell lung cancer:group elyonsaintetienned`oncology thoracique group fraeénais depneumo-cancérologie NPC 95-01 Study〔J〕.J Clin Oncol,2005;23(2):5910-7.
19 Zatloukal P,Petruzelka L,Zemanova M,et al.Concurrent venus sequential chemoradiotherapy with cisplatin and vinorelbine in locally advanced nonsmall cell lung cancer:a randomized study〔J〕.Lung Cancer,2004;46(5):87-98.
20 Wemer-Wasik M,Axelrod RS,Friedland DP,et al.Preliminary report on reduction of esophagitis by amifostine in patients with no small cell lung cancer treated with chemoradiotherapy〔J〕.Clin Lung Cancer,2001;2(3):284-9.

