EGF联合HGF诱导BMSCs向神经元样细胞分化
陈 洁,沈如娣,王璐楠,颜烯烯,罗 振,王晓明 (台州学院医学院,浙江 台州 318000)
骨髓是造血组织,其内存大量的造血干细胞,可以分化成多种血细胞。1976年,Friedenstein在其研究中发现,骨髓中除造血干细胞外还存在着一类易于贴附于塑料培养板表面的细胞,此细胞具有多分化潜能,是一种干细胞,称为骨髓间充质干细胞(Bone marrow-derived mesenchymal stem cells,BMSCs)[2]。有研究报道BMSCs在体外培养的情况下,可被诱导分化成神经元样细胞、骨细胞等多种成体细胞[3-5]。由于BMSCs的多分化干细胞特性及易获得性,尤其是可诱导分化成神经元样细胞的特性,BMSCs在脑与神经损伤的临床细胞学治疗中极具潜力,也是目前的研究热点之一。目前关于诱导 BMSCs向神经元分化方法较多[2,4,5-7],多为在体外培养体系加入不同的生长因子加入诱导,但诱导效率不一,更为高效率的诱导方法仍在探索中。有研究报道[6],表皮生长因子(Epidermal growth factor,EGF),在体外培养时,可诱导神经干细胞在体外增殖,是一种必不可少的生长因子之一。同时亦有报道称肝细胞生长因子(Hepatocyte growth factor,HGF),在体外培养时,可以与酪氨酸激酶受体c-Met结合从而诱导神经干细胞(Neuron stem cells,NSCs)存活和分化[8-9]。BMSCs具有神经干细胞的特性,HGF是否可高效的诱导BMSCs向神经元样细胞分化及高效的诱导途径还未见报道。本实验拟通过HGF可诱导神经干细胞向神经元样细胞分化的特性,尝试诱导BMSCs向神经元样细胞分化,拟寻找一种更为高效的BMSCs向神经元样细胞分化的途径。
1 材料与方法
1.1 材料:成年Wistar大鼠,购自杭州师范学院动物中心。
1.2 方法
1.2.1 BMSCs的获得及鉴定:将大鼠无痛处死,去皮、肌肉,分离出股骨,去骺端后,PBS缓冲液冲洗骨髓腔,收集冲洗液,即骨髓溶液,约30 ml,并存储在含肝素的试管中。吸管反复吹打,制备成单细胞悬液,然后缓慢加入淋巴细胞分离液(大鼠淋巴细胞分离液,Histopaque-1083,Sigma),密度梯度离心,2000 rpm离心20 min。收集细胞分离液界面处的最上层和单个核细胞层,并用20 ml的 PBS再次混合。再次离心,1800 rpm离心5 min,此次只收集单个核细胞层。收集得到的细胞用PBS洗涤2次,1000 rpm/min离心5 min,弃上清,加入L-DMEM完全培养液(DMEM,10%FBS,1×青霉素 -链霉素)重悬细胞。然后,调细胞浓度2×105,并接种到培养瓶中(T-75),37℃,5%CO2培养箱中培养,48 h后首次换液,以后每2天换液1次。由于骨髓间充质干细胞是贴壁增殖的细胞,24 h即可贴壁,贴壁细胞多为 BMSCs。7~10 d,BMSCs增殖至80% ~90%融合时,用2.5 g/L胰蛋白酶消化,流式细胞术鉴定。胰蛋白酶消化3 min左右,培养液终止消化,无菌吸管冲洗贴壁的骨髓间充质干细胞,获得的细胞悬液按1∶2传代,培养7~8 d可传代1次。传代细胞用于诱导分化。
1.2.2 流式细胞仪鉴定获得细胞为BMSCs:取传代4代骨髓间充质干细胞,待细胞长到近90%融合时,用2.5 g/L胰蛋白酶消化3~5 min,制成单细胞悬液并计数,取1×106个细胞,用流式细胞仪检测骨髓间充质干细胞表面抗原(abcam公司)CD105-PE(Serotec公司),CD45-FITC(BD 公司),CD34-FITC(BD公司),CD14-FITC(BD公司)的表达情况。具体操作按操作说明进行。
1.2.3 实验分组:鉴定后的传代细胞分为三组:A组,培养体系内加入生长因子HGF;B组,加入EGF和HGF;C组,对照组,维持传代培养时的培养体系(DMEM培养基),不加其他诱导因子。当BMSCs增殖至80% ~90%融合时,用2.5 g/L胰蛋白酶消化、分离,获得的BMSCs细胞,继续培养至形成1~2簇/cm2。24 h后,当BMSCs再次贴壁,并开始在培养基中生长时,分别在不同组中加入适量的生长因子,培养基为DMEM,加入EGF 10 ng/ml(Gibco BRL,Rock ville,MD,USA),HGF 20 ng/ml(R&D Systems,Minneapolis,MN,USA)。换液频次1 次/3 d,继续培养14 d。倒置显微镜观察细胞形态,免疫荧光染色、WB检测BMSCs向神经元或神经元样细胞分化情况。
1.2.4 免疫荧光染色技术鉴定分化细胞为神经元或神经元样细胞:单孔细胞培养皿用于此鉴定,诱导分化在此培养皿内时行。取此皿,分化的细胞已贴附于皿底,PBS洗涤3次,5 min/次,并用4%多聚甲醛PBS溶液固定15 min。然后将其用PBS洗涤2次,5 min/次。然后,样品用含有1%BSA和0.2%Tri-ton X-100的PBS作用5 min。一抗4℃孵育过夜。抗体为:Neuronal Nuclei(NeuN,1∶100,Chemicon Inc.);GFAP(1∶1000,Chemicon Inc.)。在荧光显微镜下观察细胞。1.2.5 Western Blotting技术检测分化细胞内神经元标志性蛋白表达情况:各组细胞经胰酶消化,经冷的0.01 mol/LPBS缓冲液洗3次,离心收集,加细胞裂解液(50 mM Tris-Cl,pH值 7.4,150 mM NaCl,5%NP-40,1 mM sodium pyrophosphate,2 mM EDTA等)裂解细胞(1ml细胞压积加入6~10 ml裂解液),轻轻吹打混匀,离心15 min,12000 r,取上清用BCA蛋白浓度测定试剂盒测定蛋白质总量,操作步骤按说明书进行。各组均取等量的蛋白质进行SDS-PAGE凝胶电泳,凝胶转膜,转移至硝酸纤维素膜。取该膜行免疫印迹染色,检测相关蛋白表达。抗体为:GFAP,Nestin,Gal C(Galactocerebroside),and NeuN。
2 结果
2.1 BMSCs的获得及鉴定:从骨髓中分离获得的单个核细胞,在L-DMEM培养液(DMEM,10%FBS,1×青霉素-链霉素)中培养,并在倒置显微镜下观察细胞形态及生长状态。24 h时,大部分细胞均已贴壁,细胞呈圆形,颗粒状。7 d时,部分细胞形态由颗粒状开始变成梭形;14 d时呈典型的骨髓间充质干细胞形态,细胞呈长梭形,并渐呈漩涡状聚集,呈簇状生长(图1)。当细胞增殖至80% ~90%融合时,用2.5 g/L胰蛋白酶消化,培养液终止消化,无菌吸管冲洗贴壁的骨髓间充质干细胞,获得的细胞悬液按1∶2传代,传代细胞用于诱导分化。
2.2 流式细胞术鉴定获得细胞为BMSCs:传代4代骨髓间充质干细胞,待细胞长到近90%融合时,用2.5 g/L胰蛋白酶消化3~5 min,制成单细胞悬液并计数,取1×106个细胞,用流式细胞仪检测骨髓间充质干细胞表面抗原(abcam公司)CD105-PE(Serotec公司),及造血干细胞的特异性标记物CD45-FITC(BD公司)、CD34-FITC(BD公司)的表达情况。结果显示99.8%的细胞呈CD105阳性。CD45,CD34,和CD14等抗体呈阴性,提示从骨髓中分离获得的细胞中几乎全部为骨髓间充质细胞。
2.3 免疫荧光染色技术鉴定分化细胞为神经元或神经元样细胞:传代后的BMSCs,经EGF和HGF诱导2周后,取单孔培养皿,行免疫荧光染色并在荧光显微镜观察。染色结果显示:分化细胞中,A组和B组GFAP(神经胶质原纤维酸性蛋白)呈弱阳性或阳性表达,但C组(对照组)呈阴性表达;A组和B组均有NeuN阳性表达,C组仍呈阴性表达(见图2)。提示诱导分化的BMSCs已向神经元样细胞分化。
2.4 Western Blotting技术检测分化细胞内神经元标志性蛋白表达情况:各组分化细胞经胰酶消化后,Western Blotting检测结果显示,各组均有Nestin表达;A组及B组均有GFAP、Gal C及NeuN表达,但C组未见相关蛋白表达,且B组NeuN表达量明显高于A组(图3)。

图1 骨髓基质干细胞培养
3 讨论
神经元是神经组织中的主要细胞,是一种高度分化的成体细胞,不可再分裂,损伤后较难恢复,故此神经系统损伤是临床疾病中较难治疗的病症之一。由于成体神经元的不可再生性,目前临床针对此类疾病的治疗多以功能锻炼以促进患者的恢复。亦有学者尝试向患者的损伤部位内移植神经干细胞或胚胎干细胞,及改善受损部位神经元周围微环境,以诱导神经干细胞或胚胎干细胞分化,进行替代性治疗[10-12]。但由于胚胎干细胞、神经干细胞需从胚胎或者成年脑组织中获得的干细胞,受法律及伦理限制,相对较难获得。BMSCs作为一种骨髓来源的多能干细胞,即可以诱导向神经元样细胞分化,又较易获得,且可以直接从患者自身获得,体外诱导后回输患者,避免了不必要的机体排斥,是一种较为理想的治疗性细胞。
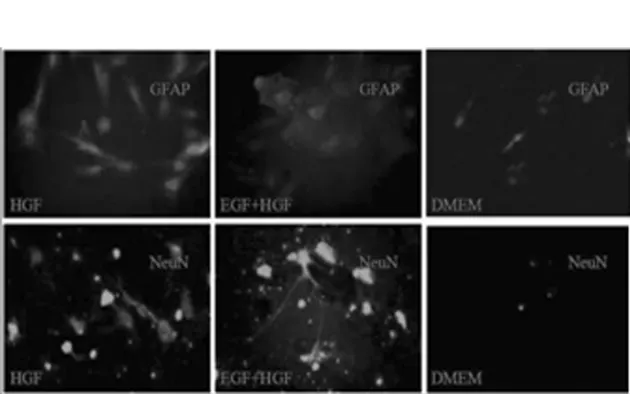
图2 免疫荧光染色结果(×400)
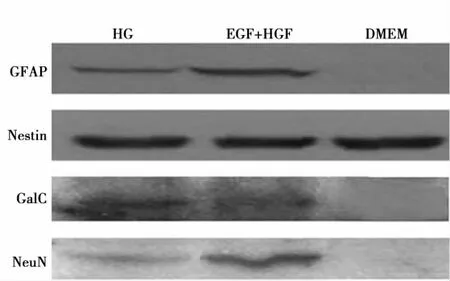
图3 Western Blotting技术检测结果
目前关于体外诱导BMSCs向神经元分化的报道较多,多为加入不同的可诱导神经干细胞向神经元样分化的生长因子,尝试诱导BMSCs向神经元样细胞分化。常见的诱导用生长因子有VEGF,EGF和BDNF等。本实验拟尝试验证其中一种可诱导神经干细胞向神经元分化的生长因子,HGF,是否可以诱导BMSCs向神经元样细胞分化。实验结果显示:我们从骨髓中获得的大量细胞基本上均为BMSCs(图1);当加入诱导因子后(HGF或HGF联合EGF),分化细胞有突起生出,且表达相关的神经元标志物 NeuN(图2,图3),提示 HGF或HGF联合EGF均可诱导BMSCs向神经元样细胞分化,尤其是HGF联合EGF诱导效果较为显著。其机制为:①可能与EGF可促进干细胞类细胞增殖有关,因为以往的研究已发现BMSCs可表达 EGF 受体[6,13];②HGF(肝细胞生长因子)具有多种功能,并在不同上皮细胞的器官发生中扮演着重要的角色,包括肾、肺、胃、肠黏膜、角膜以及皮肤表皮和皮下组织的再生[14-15]。同时在基质细胞,如成骨细胞和成肌细胞的生长与分化中也扮演着重要的角色[14]。且HGF是一种脑组均表达的稀少神经营养因子,可促进海马和中脑内神经元的存活能力,并且可诱导新皮层中移植体突起的生长[16]。具体机制还有待于进一步研究。
[1] Friedenstein AJ.Precuursor cells of mechanocytes[J].Int Rev Cytol,1976,47:327.
[2] 周 华,王 默,金 星,等.骨髓间质干细胞联合肝细胞生长因子基因治疗兔肢体缺血[J].中国普通外科杂志,2011,20(12):1342.
[3] Pittenger F,Mackay A,Beek S,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999;284(5411):143.
[4] Bianco P,Robey PG.Marrow Stromal cells[J].J Clin Invest,2000,105(12):1663.
[5] Woodburg D,Schwarz E J,Prockp D J,et al.Adult rat human bone marrow stromal cells differentiate into neurons[J].J Neurosci Res,2000,61(4):364.
[6] 杨宇辉,吴继雄.大鼠骨髓间充质干细胞和内皮祖细胞的分离培养及鉴定[J].中国组织工程研究与临床康复,2009,13(40):7886.
[7] 胡 亮,董雅娟,柏学进,等.骨髓间充质干细胞的研究进展[J].莱阳农学院学报,2005,22(1):56.
[8] Nakamura T,Nishizawa T,Hagiya M,Seki T,Shimonishi M,Sugimura A,et al.Molecular cloning and expression of human hepatocyte growth factor[J].Nature,1989,342(6248):440.
[9] Katz AJ,Tholpady A,Tholpady SS,Shang H,Ogle RC.Cell surface and transcriptional characterization of human adipose-derived adherent stromal(hADAS)cells[J].Stem Cells,2005,23(3):412.
[10] 王志伟,马秀现,李天晓,等.bFGF联合骨髓干细胞动员剂促进兔缺血后肢血管新生的研究[J].中国普通外科杂志,2007,16(2):136.
[11] 杨继武,刘伟平,周业庭,等.rhG-HGF联合成纤维细胞生长因子促进下肢血管新生的实验研究[J].中国普通外科杂志,2009,18(6):584.
[12] Cai L,Johnstone BH,Cook TG,et al.Suppression of hepatocyte growth factor production impairs the ability of adipose-derived stem cells to promote ischemic tissue revascularization[J].Stem Cells,2007,25(12):3234.
[13] 吕晓霞,尹 至,金 星,等.自体骨髓干细胞移植治疗下肢缺血性疾病60例[J].中国组织工程研究与临床康复,2008,12(29):5653.
[14] Wang PP,Xie DY,Liang XJ,et al.HGF and direct mesenchymal stem cells contact synergize to inhibit hepatic stellate cells activation through TLR4/NF-kB pathway[J].PLoS One,2012,7(8):e43408.
[15] Ikegame Y,Yamashita K,Hayashi S,et al.Comparison of mesenchymal stem cells from adipose tissue and bone marrow for ischemic stroke therapy[J].Cytotherapy.2011,13(6):675.
[16] Kachgal S,Putnam AJ.Mesenchymal stem cells from adipose and bone marrow promote angiogenesis via distinct cytokine and protease expression mechanisms[J].Angiogenesis,2011,14(1):47.

