大肠杆菌细胞抽提物制备方案的简化与优化
郭新娟,权春善,赵朋超,王丽娜,范圣第
1 中国科学院大连化学物理研究所,辽宁 大连 1160232 中国科学院大学,北京 1000493 大连民族学院生物技术与资源利用国家民委-教育部重点实验室,辽宁 大连 116600
大肠杆菌细胞抽提物制备方案的简化与优化
郭新娟1,2,权春善3,赵朋超1,2,王丽娜1,2,范圣第3
1 中国科学院大连化学物理研究所,辽宁 大连 116023
2 中国科学院大学,北京 100049
3 大连民族学院生物技术与资源利用国家民委-教育部重点实验室,辽宁 大连 116600
郭新娟, 权春善, 赵朋超, 等. 大肠杆菌细胞抽提物制备方案的简化与优化. 生物工程学报, 2013, 29(4): 532−535.
XJ Guo, Quan CS, Zhao PC, et al. Simplification and optimization of the preparation ofEscherichia coliextract for cell-free protein expression. Chin J Biotech, 2013, 29(4): 532−535.
无细胞蛋白表达系统是一种将目的蛋白在体外进行表达的新技术和新方法,已广泛应用到蛋白质组学、蛋白质结构和功能等领域的研究中。在无细胞蛋白表达系统中,细胞抽提物的制备是关键因素之一。通过对大肠杆菌细胞抽提物制备过程中离心速度、预孵化和透析等参数的考察,利用绿色荧光蛋白作为报告蛋白,可以得到一个细胞抽提物制备的简化方案。采用相对低的转速 (12 000×g,10 min),简易空孵化即可制备出活性高的细胞抽提物,用于无细胞体系蛋白表达,其表达的绿色荧光蛋白产量为209 μg/mL。与传统的大肠杆菌细胞抽提物S30相比较,新方案将使时间与成本节省62%,产量是传统方法的2.6倍,使无细胞蛋白表达技术的操作快速、高通量的优势更加明显。
蛋白质表达,无细胞表达系统,细胞抽提物,大肠杆菌,体外表达
表达蛋白的传统方法是采用重组载体,在宿主菌体内表达,这种方式有诸多缺点:表达量低、细胞毒性大、易形成包涵体等[1]。利用无细胞系统体外表达蛋白,克服了上述缺点,具有操作快速、高通量、表达量高和不形成包涵体等优点[2-4]。无细胞系统体外表达蛋白[5],可根据具体需要,介入对表达条件的调控和修饰,如加入脂质、表面活性剂等物质[6]。细胞抽提物是无细胞蛋白表达系统中的一个重要组分,其活性高低直接影响目的蛋白的产量。细胞抽提物的制备成本高、步骤繁琐,传统的制备方法费时费力。尽管如此,对于无细胞体系,大部分研究主要集中在提高蛋白产率[7-10],延长反应时间[11-12]等方面,对于细胞抽提物制备方法的研究较少。
大肠杆菌细胞抽提物的传统制备方法是 1984年由Pratt[13]建立的,称之为S30抽提物,是目前绝大多数研究者所采用的方法。Swartz等[14]研究简化了S30制备的步骤,但依旧较繁琐。Kim等[15]采用无细胞体系表达氯霉素氨酰转移酶,简化了抽提物的制备。本文在前人[5,14-15]的研究基础上,致力于研究简单高效的抽提物制备方法,即采用大肠杆菌BL21 (DE3) Codon-Plus RIL菌株,考察不同制备方法对绿色荧光蛋白 (Green fluorescent protein,GFP)表达的影响,得到一个简化方案:采用相对低的离心速度 (12 000×g,10 min) 和简易空孵化即可制备出活性高的细胞抽提物,其表达的 GFP产量为209 μg/mL。与传统S30相比,新方案节省了62%的时间与成本,并使GFP产量提高至2.6倍。
1 材料与方法
1.1 材料
质粒pET28a (+)-GFP用作无细胞体系的模板。E. coliBL21 (DE3) Codon-Plus RIL菌株用于细胞抽提物的制备。透析管 (MWCO=15K) 购自Spectrum公司;培养基、三羟甲基氨基甲烷 (Tris(hydroxymethyl) aminomethane,Tris),乙酸和乙酸钾购自生工生物工程 (上海) 股份有限公司;磷酸烯醇式丙酮酸和磷酸激酶购自罗氏公司;质粒抽提试剂盒购自 Qiagen公司;其他试剂购自 SIGMAALDRICH公司。
S30缓冲液 A/B:10 mmol/L Tris-乙酸(pH 8.2),14 mmol/L乙酸镁,60 mmol/L乙酸钾,1 mmol/L二硫苏糖醇,0.5 mL/L 2-巯基乙醇 (仅缓冲液A中含有)。
预孵化缓冲液:293 mmol/L Tris-乙酸(pH 8.2),9.2 mmol/L乙酸镁,13.2 mmol/L腺嘌呤核苷三磷酸 (pH 7.0),84 mmol/L磷酸烯醇式丙酮酸 (pH 7.0),4.4 mmol/L二硫苏糖醇,20种氨基酸均40 mmol/L,6.7 U/mL磷酸激酶。
1.2 方法
1.2.1 大肠杆菌细胞抽提物的制备
本实验采用 5种流程制备大肠杆菌细胞抽提物,分别是:标准S30、较简S30、S12、较简S12和最简S12抽提物。
标准S30抽提物的制备参照Pratt[13]的方法。将种子液接到2×YT培养基,30 ℃培养。待OD600达到 0.6,加入异丙基硫代半乳糖苷 (Isopropyl β-D-1-thiogalactopyranoside,IPTG)。OD600≈3 时,离心收菌。将每克湿菌体用20 mL S30缓冲液A在4 ℃下冲洗3次,在液氮中浸2 min后保存于−70 ℃,1~3 d。将细胞用S30缓冲液A解冻重悬,4 ℃下离心收集,每克菌体重悬于1.27 mL的S30缓冲液B中。130 MPa的压强下,高压破碎菌体3次。立即离心2次 (4 ℃,30 000×g,30 min),取上清。加入0.3倍体积的预孵化缓冲液,37 ℃孵育80 min。之后将粗提物装入透析管中,每7 g湿菌在750 mL S30缓冲液B中4 ℃下透析4次,每次45 min。4 ℃、4 000×g离心10 min,吸取上清,分装至离心管中,在液氮中浸2 min,贮存于−70 ℃。较简S30抽提物的制备参照 Swartz等[14]的方法,与标准 S30相比不同之处是:空孵化并缩短透析时间 (上清37 ℃下孵育80 min,粗提物透析40 min)。S12抽提物的制备与标准 S30相比不同之处是:收集的菌体用S30缓冲液A重悬1次,浸液氮后保存,之后将细胞在S30缓冲液B中解冻重悬便破碎,离心1次(4 ℃,12 000×g,10 min)。较简 S12抽提物的制备与S12相比不同之处是:空孵化并简易透析 (37 ℃孵育80 min,粗提物透析40 min)。最简S12抽提物的制备与较简S12相比不同之处是:简易空孵化,即上清孵育30 min便分装贮存。
1.2.2 无细胞体系蛋白表达
无细胞体系采用批量式,在1.5 mL离心管中,30 ℃、180 r/min反应4 h。60 μL的反应体系在Kigawa等[16]的基础上作了修改:10.7 mmol/L乙酸镁,2.5 μg/mL肌酸激酶,20 μg/mL模板pET28a(+)-GFP,1 mmol/L IPTG,24% (V/V) 细胞抽提物。采用5种细胞抽提物分别进行无细胞蛋白表达,同种抽提物的体系分2组:加入和未加模板,共10组反应体系。
1.2.3 无细胞体系反应产物的分析
无细胞体系的反应物经丙酮沉淀后用聚丙烯酰胺凝胶电泳 (Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE) 上样缓冲液溶解,37 ℃水浴5 min。上样,进行SDS-PAGE电泳。电泳结束后将凝胶置于紫外下观测荧光,随后采用考马斯亮蓝染色。
GFP蛋白带有His标签,因此可进行Western blotting检测:将电泳后的凝胶转到膜上,经过封闭和抗体孵育,最后显色。
采用荧光分析仪测量反应后体系的荧光强度来得到GFP蛋白的表达水平。
2 结果与分析
2.1 不同细胞抽提物对GFP表达量的影响
由 SDS-PAGE电泳 (图未显示)和 Western blotting检测 (图1) 可知,10组抽提物的无细胞体系中,加入模板的体系均有 GFP蛋白表达,未加模板的体系均无表达。采用蛋白凝胶电泳分析软件,结合蛋白标准的上样量,得到“最简S12抽提物”的表达水平为209 μg/mL。
将电泳凝胶在染色前置于紫外下观测荧光(图未显示):只有9号体系能明显观察到荧光。这表明“最简S12抽提物”活性最好,其反应体系的GFP表达量最高。2、4、6、8、10体系未加模板,无GFP表达,故未见荧光。1、3、5、7号体系由于GFP表达量较少,故不能明显观察到荧光。

图1 GFP蛋白的Western blotting检测图Fig. 1 Western blotting analysis of GFP expressed in cell-free systems with different cell extracts. Cell-free systems containing different cell extracts with (+), or without (−) DNA template. 1, 2: standard S30 extract; 3,4: the simpler S30 extract; 5, 6: S12 extract; 7, 8: the simpler S12 extract; 9, 10: the simplest S12 extract.
利用荧光分析仪测量反应后体系的荧光强度得到无细胞体系的相对荧光强度 (图2)。由结果可见抽提物的产量由大到小顺序是:最简S12>较简S30>较简S12>标准S30>S12。
2.2 细胞抽提物的不同制备方法对工作量的影响
我们分析了不同制备方法消耗时间的差别:标准S30耗时最多,约11 h;最简S12流程最简单快速,耗时约4 h,相比标准S30,节省了62%的时间和成本,产量也提高到2.6倍,尤其适合于自动化和高通量的蛋白质组学等领域。
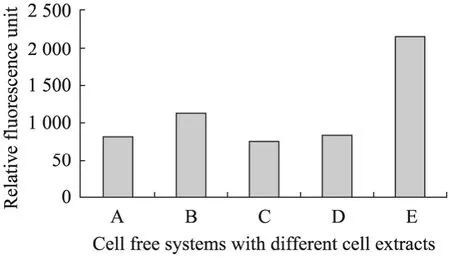
图2 不同无细胞体系中GFP的表达量柱状图Fig. 2 Production yield of GFP synthesized in different cell-free systems. A: the standard S30 extract; B: the simpler S30 extract; C: S12 extract; D: the simpler S12 extract; E: the simplest S12 extract.
强化细胞抽提物效率是提高无细胞蛋白表达体系产量的一个关键和重要因素。本研究将为无细胞技术的发展提供理论基础。S12比S30的表达量高,可能是因为相对低的离心速度保留了较多的功能蛋白,有利于无细胞体系蛋白的表达。至于不同离心转速、预孵化和透析改变了什么,不同细胞抽提物的活性物质含量的差别等,还有待进一步深入研究。
[1]Kefala G, Kwiatkowski W, Esquivies L, et al. Application of Mistic to improving the expression and membrane integration of histidine kinase receptors fromEscherichia coli. J Struct Funct Genomics, 2007, 8(4):167−172.
[2]Katzen F, Peterson TC, Kudlicki W. Membrane protein expression: no cells required. Trends Biotechnol, 2009,27(8): 455−460.
[3]Katzen F, Chang G, Kudlicki W. The past, present and future of cell-free protein synthesis. Trends Biotechnol, 2005,23(3): 150−156.
[4]Nakano H, Yamane T. Cell-free protein synthesis systems.Biotechnol Adv, 1998, 16(2): 367−384.
[5]Kigawa T, Yabuki T, Matsuda N, et al. Preparation ofE. colicell extract for highly productive cell-free protein expression. J Struct Funct Genomics, 2004, 5(1−2): 63−68.
[6]Klammt C, Schwarz D, Lohr F, et al. Cell-free expression as an emerging technique for the large scale production of integral membrane protein. FEBS J, 2006, 273(18):4141−4153.
[7]Seki E, Matsuda N, Yokoyama S, et al. Cell-free protein synthesis system fromEscherichia colicells cultured at decreased temperatures improves productivity by decreasing DNA template degradation. Anal Biochem, 2008, 377(2):156−161.
[8]Shimono K, Goto M, Kikukawa T, et al. Production of functional bacteriorhodopsin by anEscherichia colicell-free protein synthesis system supplemented with steroid detergent and lipid. Protein Sci, 2009, 18(10): 2160−2171.
[9]Seki E, Matsuda N, Kigawa T. Multiple inhibitory factor removal from anEscherichia colicell extract improves cell-free protein synthesis. J Biosci Bioeng, 2009, 108(1):30−35.
[10]Park N, Um SH, Funabashi H, et al. A cell-free protein-producing gel. Nat Mater, 2009, 8(5): 432−437.
[11]Kim DM, Swartz JR. Prolonging cell-free protein synthesis by selective reagent additions. Biotechnol Prog, 2000, 16(3):385−390.
[12]Kim D-M, Swartz JR. Prolonging cell-free protein synthesis with a novel ATP regeneration system. Biotechnol Bioeng,1999, 66(3): 180−188.
[13]Pratt J. Transcription and Translation: A Practical Approach.New York: IRL Press, 1984: 179−209.
[14]Liu DV, Zawada JF, Swartz JR. StreamliningEscherichia coliS30 extract preparation for economical cell-free protein synthesis. Biotechnol Prog, 2005, 21(2): 460−465.
[15]Kim TW, Keum JW, Oh IS, et al. Simple procedures for the construction of a robust and cost-effective cell-free protein synthesis system. J Biotechnol, 2006, 126(4): 554−561.
[16]Endo Y, Takai K, Ueda T. Cell-Free Protein Production:Methods and Protocols. New York: Humana Press, 2010:2−6.
November 16, 2012; Accepted: January 14, 2013
Chunshan Quan. Tel: +86-411-87656219; Fax: +86-411-87644496; E-mail: mikyeken@dlnu.edu.cn
Simplification and optimization of the preparation ofEscherichia coliextract for cell-free protein expression
Xinjuan Guo1,2, Chunshan Quan3, Pengchao Zhao1,2, Lina Wang1,2, and Shengdi Fan3
1Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian116023,Liaoning,China
2University of Chinese Academy of Sciences,Beijing100049,China
3Key Laboratory of Biotechnology and Resource Utilization,State Ethnic Affairs Commission and Ministry of Education,Dalian Nationalities University,Dalian116600,Liaoning,China
Cell-free protein expression system is a new method to express target proteinin vitroand has been widely applied to the study of protein structure, protein function and other related fields. Preparation of cell extract is one of the key factors that affect the efficiency of the cell-free system. To improve the efficiency and economical feasibility of cell-free protein synthesis, we discussed the parameters during the preparation of the cell extract. These parameters include centrifugation speed, pre-incubation, and dialysis. We used the green fluorescent protein as the reporter protein, and obtained a simple procedure for the preparation ofEscherichia colicell extract. A simple centrifugation step (12 000×g,10 min) followed by a brief incubation was sufficient for the preparation of an active cell extract to support protein expression with higher productivity (209 μg/mL). Compared to the traditionalE. coliS30 procedure, the processing time was reduced by 62%, and the productivity was increased by 2.6 times. The new procedure will make the advantage of cell-free technology more obvious, and promote its wider application.
protein synthesis, cell-free expression system, cell extract,Escherichia coli, in vitro
Supported by: National Natural Science Foundation of China (No. 21152002), the Fundamental Research Funds for the Central Universities(No. DC12010118).
国家自然科学基金 (No. 21152002),中央高校专项基金 (No. DC12010118) 资助。
时间:2013-01-17 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20130117.1629.001.html
(本文责编 陈宏宇)