Kozak序列对金黄色葡萄球菌黏附因子FnBPA-A DNA疫苗诱导小鼠免疫应答的影响
苏艳,王世民,邵俊高,张宝江,韦海娜
新疆农业大学动物医学学院,新疆 乌鲁木齐 830052
Kozak序列对金黄色葡萄球菌黏附因子FnBPA-A DNA疫苗诱导小鼠免疫应答的影响
苏艳,王世民,邵俊高,张宝江,韦海娜
新疆农业大学动物医学学院,新疆 乌鲁木齐 830052
苏艳, 王世民, 邵俊高, 等. Kozak序列对金黄色葡萄球菌黏附因子FnBPA-A DNA疫苗诱导的小鼠的免疫应答的影响.生物工程学报, 2013, 29(4): 458−465.
Su Y, Wang SM, Shao JG, et al. Effect of Kozak sequence on mice DNA vaccine immunization ofStaphylococcus aureusadhesion fibronectin-binding protein FnBPA-A. Chin J Biotech, 2013, 29(4): 458−465.
黏附因子FnbpA (纤连蛋白结合蛋白A,Fibronectin binding protein A) 是金黄色葡萄球菌表面的蛋白质成分,是该菌感染早期最重要的致病因子,可促进其对寄主组织的侵入,也是一个有潜力的免疫靶标。将牛乳源金黄色葡萄球菌中FnBPA基因的A功能区克隆至真核表达载体中,分别构建含Kozak序列和不含Kozak序列的FnBPA-A基因真核表达载体,重组质粒经鉴定测序正确后,免疫C57BL/6小鼠检测其抗体水平和淋巴细胞增殖情况,并对各组小鼠进行攻毒实验。检测的结果表明Kozak修饰的重组DNA在血清抗体效价 (P<0.05)和免疫保护率方面均优于不含Kozak序列的重组DNA,在刺激淋巴细胞增殖方面Kozak修饰的重组DNA的刺激效果虽然也高于不经修饰的重组DNA,但是差异不显著 (P>0.05)。根据总体的免疫效果来看,Kozak序列对增强FnBPA的重组DNA疫苗诱导的免疫应答起了不容忽视的作用。
金黄色葡萄球菌,黏附因子FnBPA,Kozak序列,重组DNA疫苗,免疫应答
由金黄色葡萄球菌引起的奶牛乳腺炎已引起人们的广泛关注,目前对该菌的研究发现,金黄色葡萄球菌表面可表达一些特异性蛋白,又称黏附因子,能促进与宿主细胞、细胞外基质和可溶血浆蛋白的粘附[1]。其中纤连素结合蛋白(Fibronectin-binding proteins,FnBPA) 是重要的黏附因子之一[2],能够介导金黄色葡萄球菌结合于细胞表面的纤维连结素,几乎所有的金黄色葡萄球菌都有纤连蛋白结合蛋白FnBPA[3],抑制其活性后可切断金黄色葡萄球菌早期感染途径。已有研究证明,抑制该菌的黏附功能可部分保护试验动物抵抗金黄色葡萄球菌的感染[4-5],因此该分子被认为是金黄色葡萄球菌粘附并侵入乳腺细胞必须的毒力因子[6],是感染的关键,也是一个极好的免疫靶位,目前已被视为新型预防和治疗性疫苗的潜在靶位[7]。
目前 FnBPA蛋白最受关注的功能区主要有A区与 D区。A区能够结合机体纤维蛋白原(Fibrinogen,Fg)[8]。D 区是能和纤连蛋白(Fibronectin,Fn) 结合的11或12个重复序列[9]。本研究选取了FnBPA A区的N2、N3亚区和1、2两个高结合力的重复序列为目的片段将其克隆至真核表达载体中,通过检测其在动物体内的表达和免疫效率,评估其作为DNA疫苗靶标的价值。
Kozak序列是很多哺乳动物细胞中能提高基因表达的一个上游调控元件[10]。以往的研究表明,该序列对增强外源基因在细胞内表达水平有重要的作用[11-12]。DNA疫苗在真核细胞中的表达主要受转录、翻译两个水平的调控,为提高FnBPA-A基因在真核细胞中的表达量,提高其免疫后的免疫效果,我们构建了基于 FnBPA-A基因带有Kozak序列和不带该序列的重组DNA真核表达载体,并对C57BL/6小鼠进行免疫,从抗体水平、淋巴细胞增殖水平和免疫保护效率方面比较了两者刺激机体产生免疫应答及免疫保护率的差异。
1 材料与方法
1.1 材料
1.1.1 载体、酶及主要试剂
含有FnBPA-A基因的PV-SFn由新疆农业大学微生物与免疫实验室构建并保存;LATaqDNA聚合酶、pMD 18-T载体、DNA Marker、中等分子量蛋白 Marker均购于大连宝生物工程有限公司;质粒小量提取试剂盒购于Omega公司;质粒大量提取试剂盒 GoldHi EndoFree Plasmid Maxi Kit,PM Western Midview Western 中分子量蛋白 Marker购于北京康为世纪生物科技有限公司;高效真核转染试剂购于北京威格拉斯生物技术有限公司;TMB显色液购于北京索莱宝科技有限公司;HRP标记羊抗鼠二抗购于北京中杉金桥生物技术有限公司;淋巴细胞分离液购于天津市灏洋生物制品科技有限责任公司。
1.1.2 菌株及试验动物
菌株Staphylococcussp. GW-1由本实验室从乳腺炎奶样中分离并鉴定,大肠杆菌DH5α由本实验室保存,5~7周龄的C57BL/6小鼠 (18~20g)购自新疆医科大学实验动物中心。
1.2 方法
1.2.1 真核表达载体PV-KFn与PV-SFn的构建
根据FnBPA-A基因序列和Kozak序列的特点设计引物,并在上下游引物加入BamHⅠ和XhoⅠ两酶切位点,构建真核表达载体PV-KFn。具体为:koF (5¢−3¢):CGG GAT CCG GAA ATG GCT AAC GTT AAT CAT AT,koR (5¢−3¢):GCG CTC GAG CTA TTC AAT GTA TCC GTC AAC。反应体系:模板 0.5 μL,10×LA PCR 缓冲液 5 μL,dNTP Mixture (2.5 mmol/L) 5 μL,上游引物(50 pmol/μL) 0.5 μL,下游引物 (50 pmol/μL)0.5 μL,TaqDNA聚合酶0.3 μL,灭菌去离子水补至50 μL。PCR反应程序:95 ℃预变性5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min ,30个循环;72 ℃延伸7 min。测序正确后加Kozak序列和不加该序列的重组表达载体分别命名为PV-KFn和PV-SFn。
1.2.2 重组蛋白的表达检测
构建好的重组载体转染BHK-21细胞,将收集的细胞培养液与5×SDS缓冲液混合煮沸处理,纯化蛋白作为阳性对照进行SDS-PAGE电泳,转移至PVDF膜。转好的膜用2%脱脂奶粉4 ℃封闭过夜。用浓度为1∶800的一抗37 ℃孵育2 h,PBST洗膜5次,用HRP标记1∶500的羊抗兔IgG 37 ℃温育1 h,PBST洗膜5次,DAB显色液显色后记录结果。
1.2.3 试验小鼠的DNA免疫
对试验小鼠进行分组 (试验组 PV-KFn 12只,试验组PV-SFn 12只,空载体组12只和空白对照组12只),免疫前采阴性血清,重组质粒DNA混匀,后腿肌肉注射100 μg/只。3周后进行第2次免疫,每次免疫后2周采血分离血清,检测血清样品的抗体效价。
1.2.4 试验小鼠的体液免疫应答检测
用间接 ELISA方法对免疫小鼠血清进行抗体效价的检测,具体操作如下:用纯化 FnBPA蛋白作包被抗原,4 ℃包被过夜。鼠血清初始1∶100倍稀释,随后进行倍比稀释至不同浓度。将稀释好的血清作一抗37 ℃温育2 h,PBST洗涤5次。以1∶4 000稀释HRP标记的羊抗鼠IgG作二抗,37 ℃温育1 h后,PBST洗涤5次,TMB显色液显色 30 min,2 mol/L硫酸终止,检测OD450值。
1.2.5 抗体对金黄色葡萄球菌黏附纤连素结合蛋白的抑制
用 50 μL 10 μg/mL 纤维蛋白原 (Fibrinogen,Fg) 做包被抗原4 ℃包被过夜,热灭活的金黄色葡萄球菌 GW-1悬液浓度调整为 2×108个/mL,与倍比稀释的免疫鼠血清 (1∶100至 1∶800)总体积为100 μL,37 ℃温育1 h。每个样品设3个重复,试验重复2次。包被过的96孔板封闭后加入与抗体反应过的菌悬液,37 ℃温育2 h。兔抗金葡菌GW-1血清 (1∶700) 作一抗37 ℃温育2 h,以1∶4 000稀释HRP标记的羊抗兔IgG作二抗,37 ℃温育1 h后,PBST洗涤3次,进行TMB显色及检测OD450值。
1.2.6 淋巴细胞转化实验
对二次免疫90 d后的小鼠无菌取脾脏,无菌将小鼠脾制成脾细胞悬液浓度调整为 2×106个/mL,于96孔板中加100 μL/孔,每只小鼠为9孔,其中3孔为ConA刺激组,ConA终浓度为10 μg/mL,3孔为 FnBPA-A 刺激组,加入FnBPA-A蛋白,3孔为正常脾细胞组。37 ℃培养52 h左右,加入MTT终浓度1 g/L,于振荡器上混匀,继续培养6 h后,加入150 μL DMSO终止反应,充分混匀,静置数分钟后测OD570值,计算刺激指数(SI),计算公式为:SI=A/B,A为刺激组OD570值,B为正常组脾细胞OD570值。
1.2.7 免疫小鼠的免疫保护试验
C57BL/6小鼠二免90 d后对小鼠进行攻毒试验,以最小致死量7×109CFU的金黄色葡萄球菌GW-1腹腔注射小鼠,每组6只,同时设未免疫和空载体对照组,攻毒后连续观察7 d,记录每组试验鼠的发病和死亡情况,计算免疫保护效率。
2 结果
2.1 重组载体的酶切鉴定
各重组质粒经BamHⅠ和XhoⅠ双酶切后,1%琼脂糖凝胶电泳结果如图 1所示,电泳结果表明,在1 700 bp左右得到了DNA片段 (和预期大小相符)。
2.2 Western blotting分析重组蛋白
Western blotting的结果表明 (图2),2种重组质粒转染BHK-21细胞后均能表达出分子量为63 kDa左右的FnBPA-A蛋白。

图1 PV-KFn和PV-SFn重组质粒的酶切鉴定图Fig. 1 Identification of recombinant plasmid PV-KFn and PV-SFn by enzyme digestion. M: DL15000 marker;1: PVAX-1 vector; 2: PV-KFn; 3: PV-SFn.
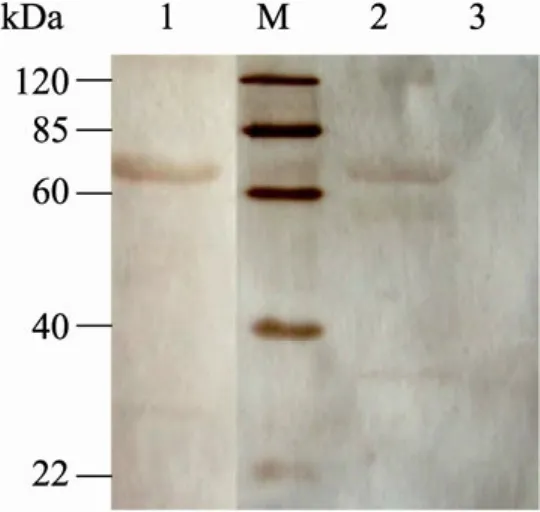
图2 Western blotting分析BHK-21细胞表达的目的蛋白Fig. 2 Western blotting analysis of expressed target protein in BHK-21 cell. M: marker; 1: PV-SFn recombinant plasmid; 2: PV-KFn recombinant plasmid;3: PVAX-1 empty vector.
2.3 重组质粒免疫小鼠后的抗体效价
重组质粒免疫小鼠后,血清中抗体效价的变化见图 3。与空载体对照组相比,初次免疫后PV-SFn重组质粒组与空载体对照组的抗体水平几乎持平,PV-KFn重组质粒组升高不明显,二次免疫后PV-KFn重组质粒组均比空载体对照组的抗体水平明显升高 (P<0.01)。且 PV-KFn抗体水平高于PV-SFn重组质粒组 (P<0.05)。表明Kozak序列对该重组DNA在体内的表达有正调控的作用,导致了相应抗原在动物体内诱生的抗体水平的升高。各组实验小鼠抗体OD450检测后的统计结果见图3。
2.4 抗体对纤维蛋白原黏附的抑制作用
为验证免疫后的血清对金黄色葡萄球菌黏附功能的影响,我们将免疫后血清与热灭活的菌体作用后检测其对菌体黏附功能的影响。如图4所示,与空载体和空白对照的血清相比,在相同的血清稀释度下,FnBPA-A免疫后的鼠血清可部分抑制金黄色葡萄球菌GW-1对纤维蛋白原的黏附作用。随血清稀释度的增加,抑制作用逐渐减弱。PV-KFn免疫后的血清抗体对纤维蛋白原黏附作用的抑制作用大于PV-SFn,但差异不显著。

图3 PV-KFn及 PV-SFn重组质粒免疫小鼠血清抗体效价的变化Fig. 3 Serum antibody level of mouse immunized with PV-KFn and PV-SFn recombinant plasmid. ns: P>0.05;*: P<0.05; **: P<0.01.
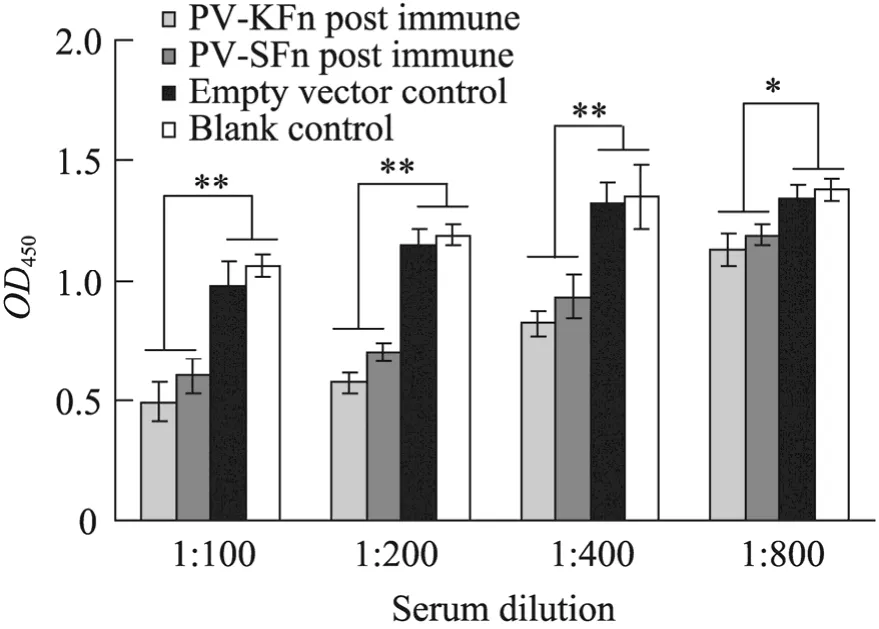
图4 PV-KFn和 PV-SFn免疫后的小鼠血清抗体对金黄色葡萄球菌GW-1黏附作用的抑制结果Fig. 4 Inhibition of bacterial GW-1 adhesion by antibodies after immunizing mice with PV-KFn and PV-SFn recombinant plasmids. ns: P>0.05; *: P<0.05;**: P<0.01.
2.5 重组质粒免疫小鼠后的淋巴细胞转化试验结果
用所构建的等量不同重组质粒免疫小鼠 2次,二免90 d后,对脾脏T淋巴细胞的MTT检测所得的刺激指数 (Stimulation index,SI) 如图5所示,MTT试验的结果显示PV-KFn比PV-SFn重组质粒组更能刺激机体内淋巴细胞的增殖。
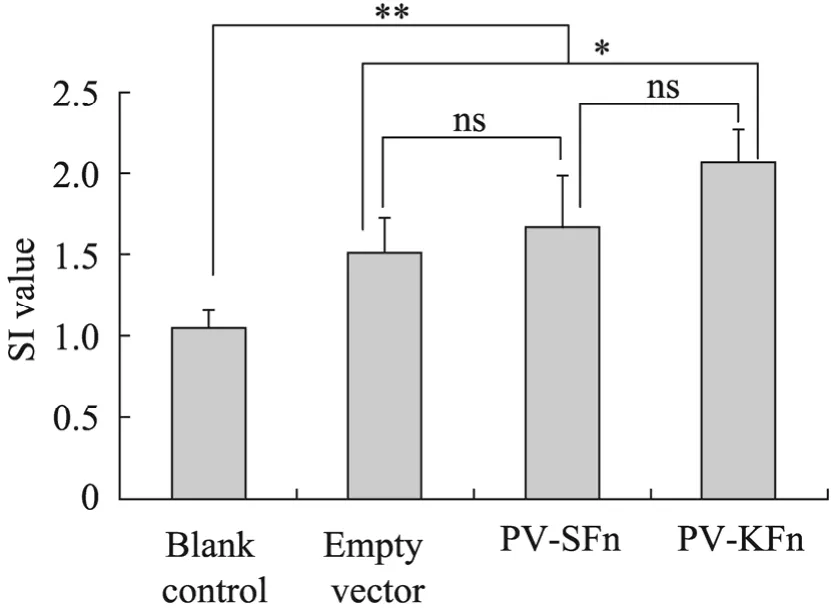
图 5 PV-KFn和 PV-SFn免疫后脾脏 T淋巴细胞MTT结果Fig. 5 MTT analysis of spleen T lymphocyte after immunizing with PV-KFn and PV-SFn recombinant plasmids. ns: P>0.05; *: P<0.05; **: P<0.01.
2.6 不同重组体免疫小鼠的免疫保护率
二次免疫接种后90 d,用保存的牛乳源金黄色葡萄球菌菌株GW-1进行攻毒试验,经过7 d的观察,PV-SFn分泌组免疫保护率为 40%;PV-KFn组的免疫保护率为60%;空白组和对照组小鼠24 h全部死亡。表明PV-KFn组的免疫保护率优于PV-SFn分泌组。
3 讨论
FnBPA (Fibronectin binding protein A) 是金黄色葡萄球菌重要的毒力因子之一[13],基于细菌表面蛋白的粘附机制研制的抗金黄色葡萄球菌核酸疫苗[14],被认为是有广阔研究前景的疫苗[15],可望通过阻断金黄色葡萄球菌对奶牛乳腺上皮细胞的粘附过程来预防乳腺炎的发生。但是当前以 FnBPA为靶基因研制的核酸疫苗虽有一定的效果,还需尝试多种方法提高核酸疫苗免疫效果[16]。目前国内外对 FnBPA的表达和免疫方面的研究多集中在D区序列,我们将对FnBPA的A区序列[17](FnBPA-A) 的免疫原性进行探索。
真核生物蛋白表达调控除了一些上游控制元件和一些因子参与外,和该蛋白起始密码子AUG周围的碱基种类也有很大关系。美国学者Kozak通过对699条脊椎动物cDNA 5¢非编码区4种碱基分布概率的统计学研究分析发现并得出了著名的“Kozak规则”[12,18]。当一个基因起始密码子周围的碱基符合Kozak规则或由于突变、人为原因改变而符合Kozak规则时,该蛋白表达量会有相应提高,杜明媚等用EGFP作为对象的研究结果证明了这点[11-12]。
外源基因在真核细胞中的表达主要受到转录、翻译两个水平的调控。商品化构建的真核表达载体大多会采用较强的启动子,使其转录水平受到较强的调控。对于我们用真核表达载体构建的质粒来说,表达外源基因时增强翻译水平表达就显得尤其重要。此前我们已对该基因的表达进行了相关的生物信息学分析[19],在此基础上本实验将目的基因起始密码子周围碱基经 Kozak规则修饰,成功构建PV-KFn真核表达质粒,期望在免疫接种该 DNA疫苗后可从翻译水平提高FnBPA的表达并进而提高动物机体的抗体水平和免疫保护率。
本实验通过对带有 Kozak序列的重组质粒PV-KFn质粒和不带该序列的重组质粒 PV-SFn免疫后结果的对比,我们发现虽然不带Kozak序列的重组质粒 PV-SFn具有一定的抗体诱生能力,但与PV-KFn组相比,无论是抗体水平、攻毒保护率方面都差一些。研究证明[20]当 Kozak序列用于真核基因表达载体的构建和表达,可显著提高细胞表达蛋白的水平且不影响目的蛋白的性质和功能。研究结果进一步从免疫动物的角度证明,Kozak序列对增强基于FnBPA的重组质粒诱导的体液免疫方面及攻毒保护力方面都会产生影响。该结果对于今后DNA疫苗的设计及提高其免疫保护效率等方面具有一定的参考价值。
[1]Patti JM, Allen BL, McGavin MJ. MSRAMM-mediated adherence of microorganisms to host tissues. Annu Rev Microbiol, 1994, 48: 585−617.
[2]Middleton, John R.Staphylococcus aureusantigens and challenges in vaccine development. Vaccine,2008, 7(6): 805−815.
[3]Zhou H, Li HP, The progress ofStaphylococcus aureussurface proteins. Lett Biotechnol, 2004,15(1): 73−75 (in Chinese).
周宏, 李韩平. 金黄色葡萄球菌表面蛋白研究进展. 生物技术通讯, 2004, 15(1): 73−75.
[4]Foster TJ, Hookm. Surface protein adhesins ofStaphylococcus aureus. Trends Microbiol, 1998,6(12): 484−488.
[5]Shkreta L, Talbota BG, Diarra S, et al. Immune responses to a DNA/ protein vaccination strategy againstStaphylococcus aureusinduced mastitis in dairy cows. Vaccine, 2004, 23(1): 114−126.
[6]Hauck Cr, Ohlsen K. Sticky connections:extracellular matrix protein recognition and integrin-mediated cellular invasion byStaphylococcus aureus. Curr Opin Microbiol, 2006,9(1): 5−11.
[7]Fitzgerald JR, Hartigan PJ. Molecular population and virulence factor analysis ofStaphylococcus aureusfrom bovine intramammary infection. J Appl Microbiol, 2000, 88:1028−1035.
[8]Keane FM, Loughman A, Valtulina V, et al.Fibrinogen and elastin bind to the same region within the A domain of fibronectin binding protein A, an MSCRAMM ofStaphylococcus aureus. Mol Microbiol, 2007, 63(3): 711−723.
[9]Fan X, Hao YQ, Zhang AR, construction and prokaryotic expression of the co-expression plasmid with FnBPB-ClFA gene encodingStaphylococcus aureusadhesion. Chin Vet Sci,2011, 41(2): 173−177 (in Chinese).
范鑫, 郝永清, 张爱荣, 等. 金黄色葡萄球菌黏附素 FnBPB-ClFA共表达质粒的构建与原核表达. 中国兽医科学, 2011, 41(2): 173−177.
[10]Petty AP, Dick CL, Lindsey JS. Translation of an atypical human cDNA requires fidelity of apurine-pyrimidine repeat region and recoding.Gene, 2008, 414(1/2): 49−59.
[11]Du MM, Ye L, Liu JW, et al. Enhancement of GFP Expression by Kozak Sequence +4G in HEK293 Cells. Chin J Biotech, 2008, 24(3): 491−494 (in Chinese).
杜明梅, 叶玲, 刘建伟, 等. Kozak序列+4G提高绿色荧光蛋白在 HEK293 细胞中的表达. 生物工程学报, 2008, 24(3): 491−494.
[12]Wang HZ, Wang XG, Zhai L. Construction of eukaryotic expression vector pcDNA3.1(-)+KG containing green fluorescent protein and its expression in HeLa cell. Biotechnol Bull, 2010, 1:188−192 (in Chinese).
王洪振, 王晓光, 翟雷. 真核表达载体pcDNA3.1(-)+KG的构建及在 HeLa细胞中的表达. 生物技术通报, 2010, 1: 188−192.
[13]Mamo W, Jonsson P, Flock JI, et al. Vaccination againstStaphylococcus aureusmastitis:immunological response of mice vaccinated with fibronectin binding protein (FnBP-A) to challenge withS. aureus. Vaccine, 1994, 12(11): 988−992.
[14]Shinji H, Yosizawa Y, Tajima A, et al. Role of fibronectinbinding proteins A and B inin vitrocellular infections and in vivo septic infections byStaphylococcus aureus. Infec Immun, 2011, 79:2215−2223.
[15]Hu C, Gong R, Guo AZ, et al. Protective effect of ligand-binding domain of fibronectin-binding protein on mastitis induced byStaphylococcus auresin mice. Vaccine, 2010, 28: 4038−4044.
[16]Muruganandam M. Engineered plasmid DNA vaccine forStaphylococcus aureus. Int J Biol Technol, 2011, 2(1): 7−10.
[17]Zhang XX, Shi QH, Wang SM, et al. Clone and sequence analysis of FnbpA gene ofStaphylococcus aureusisolated from Xinjiang dairy cow with subclinical mastitis. J Xinjiang Agri Univ, 2010, 33(5): 422−426 (in Chinese).
张向新, 石庆华, 王世民, 等. 新疆奶牛乳腺炎致病性金黄色葡萄球菌FnbpA基因的克隆与序列分析. 新疆农业大学学报, 2010, 33(5): 422−426.
[18]Kozak M. An analysis of 5’- noncoding sequences from 699 vertebrate messenger RNAs. Nucl Acids Res, 1987, 15(20): 8125−8148.
[19]Wang SM, Su Y. Bioinformatic analysis and design of staphylococcus aureus fibronectin-binding protein A (FnBPA) signal peptide and its eukaryotic secret expression. J Xinjiang Agri Univ,2012, 35(3): 212−216 (in Chinese).
王世民, 苏艳. 金黄色葡萄球菌纤连结合蛋白信号肽的生物信息学分析及其真核分泌表达. 新疆农业大学学报, 2012, 35(3): 212−216.
[20]Zhang Q, Li MC, Sun Y, et al. Heteroexpression ofRhizopus arrhizusΔ6-fatty acid desaturase gene inPichia pastoris. Chin J Biotech, 2005, 21(6):871−877 (in Chinese).
张琦, 李明春, 孙颖, 等. 少根根霉 Δ6-脂肪酸脱氢酶基因在毕赤酵母中的表达. 生物工程学报,2005, 21(6): 871−877.
September 23, 2012; Accepted: January 14, 2013
Yan Su. Tel: +86-991-8762704; E-mail: 2006au@163.com
Effect of Kozak sequence on mice DNA vaccine immunization ofStaphylococcus aureusadhesion fibronectin-binding protein FnBPA-A
Yan Su, Shimin Wang, Jungao Shao, Baojiang Zhang, and Haina Wei
College of Veterinary Medicine,Xinjiang Agricultural University,Urumqi830052,Xinjiang,China
Fibronectin-binding protein (FnBPA) is a protein that expresses on cell surface ofStaphylococcus aureusduring early stage of infection. FnBPA was capable of promotingStaphylococcus aureusto invade cells and was viewed as a potential immune target. Based on the FnBPA-A gene two recombinant expression vectors with or without Kozak sequence were constructed. After identified and confirmed by restriction enzyme digestion and sequencing they were used to immunize C57BL/6 mice. Then induced antibody titer, T lymphocyte proliferative response and experiment mice challenge test were measured. Our result indicates that humoral immune responses and challenge experiment induced by recombinant DNA with Kozak sequence were better than those without Kozak sequence (P<0.05). For T lymphocyte proliferative response the induced effect of recombinant DNA with Kozak sequence was higher than that without Kozak sequence, but there was no significant difference (P>0.05). We conclude that Kozak sequence could play an important role in immune response induced by FnBPA-A recombinant DNA.
Staphylococcus aureus, adhesion fibronectin-binding protein A, Kozak sequence, recombinant DNA vaccine,immune response
Supported by: National Natural Science Foundation of China (Nos. 31160191, 31260222), Ordinary University Basic Veterinary Medicine Key Disciplines Foundation of Xinjiang Uygur Autonomous Region.
国家自然科学基金 (Nos. 31160191,31260222),新疆维吾尔自治区普通高校重点学科基础兽医学科项目资助。
(本文责编 郝丽芳)