稀碱预处理棕榈残渣制备纤维乙醇
张海燕,周玉杰,李晋平,戴玲妹,刘德华,张建安,Yuen May Choo,Soh Kheang Loh
1 太原理工大学精细化工研究所,山西 太原 030024
2 清华大学核能与新能源技术研究院,北京 100084
3 清华大学化学工程系,北京 100084
4 马来西亚棕榈油协会,马来西亚 吉隆坡 50720
随着不可再生能源的日益短缺,能源危机日趋严重,属于生物质能的纤维素乙醇由于以非粮作物为原料,具有环保、清洁并可大规模工业生产等特点而得到广泛的青睐[1-4]。棕榈是东南亚重要的经济作物,在其加工过程中,每年产生的棕榈空果串,经脱油、挤干、撕裂后产生的纤维(以下简称棕榈残渣)约400万t,至今为止尚未找到合适的处理方法,绝大部分作填埋和焚烧处理,既浪费了资源,又污染了环境[5-8]。棕榈残渣原料密集,充分利用该资源制备生物乙醇及综合利用,具有巨大的潜力和广阔的发展前景。
利用木质纤维素生产乙醇主要包括原料的预处理、酶解和发酵三个步骤,其中预处理是关键步骤之一,它会直接影响到后续酶解中纤维素的可消化性[9-10]。目前,木质纤维素原料预处理的方法主要有物理法、化学法、物理化学法和生物法[11-13]。棕榈资源由于分布较为集中,因此对其预处理以及乙醇发酵的研究并不多见,其中预处理方法的报道以化学法为主。如 Umikalsom等[14]用等浓度0.5%的NaOH、HNO3、HCl对棕榈果壳串进行了预处理,发现用NaOH处理过的棕榈纤维酶解效率最高。Jung等[15]用氨水对棕榈空壳串进行预处理,在60 ℃用21% (W/W)氨水浸泡12 h后41.1%的木质素被脱除。Kim等[16]相继用稀硫酸、NaOH对棕榈残渣进行预处理,用稀酸预处理完后 90%的半纤维素和 32%的木质素被降解到液相中。Kassim等[17]用1% NaOH对棕榈果壳串进行预处理,然后用 0.7% (V/V)H2SO4水解,得到13.38 g/L木糖和0.54 g/L葡萄糖,后进行分步糖化发酵乙醇最高得率为0.51 g/g葡萄糖。上述研究表明碱对棕榈原料木质素有较好的脱除效果,但没有进一步对不同条件的碱预处理进行对比,并且利用棕榈残渣进行高底物浓度的乙醇同步糖化发酵还少有报道。
棕榈残渣的化学组成中木质素约占 17%~20%,由于木质素的存在不利于纤维素及半纤维素的酶解,因此对其进行脱木质素预处理将有助于提高酶解率。侯丽芬等[18]通过对酸法、稀碱和碱性 H2O2三种预处理条件进行比较,发现通过碱性H2O2预处理玉米芯,其木质素脱除率最高。本文比较了稀碱、碱/H2O2等预处理条件对棕榈残渣脱木质素以及酶解的影响,确定了适宜的预处理条件;考察了底物浓度、酶载量对酶解效果的影响以及不同底物浓度的乙醇同步糖化发酵。
1 材料与方法
1.1 原料与试剂
1.1.1 原料
实验用的棕榈残渣颗粒 (经机械粉碎),粒度20~40目,来自于马来西亚。
1.1.2 试剂与药品
高活力纤维素酶 (北京中纺化工股份有限公司提供),是纤维素酶和半纤维素酶的混合酶,纤维素酶滤纸酶活100 FPU/mL,半纤维素酶活295 IU/mL;试验所用其他化学试剂均为分析纯。
1.1.3 菌种
实验过程中采用的菌种:酿酒酵母Saccharomyces cerevisiae,编号为31014,来源于中国工业微生物菌种保藏管理中心 (CICC)。
1.1.4 仪器
SHIMADZU高效液相色谱仪 (日本岛津公司),由 LC-20AD双元泵、柱温箱、工作站、RID-10A型示差折光检测器 (RI)、SPD-20A 型紫外检测器 (UV)组成。Tg16-W微量高速离心机。精密 pH计,PHS-3C型,上海科学精密仪器厂。
1.2 方法
1.2.1 预处理条件
碱预处理条件:称取干重为 30 g的棕榈残渣,置于500 mL锥形瓶中,加入质量分数分别为0.5%、1%和2%的NaOH溶液300 mL,即固液比为1∶10,待试样充分浸润后,置于40 ℃摇床中,转速200 r/min,浸泡24 h;后置于121 ℃灭菌锅中,保温时间分别为5 min和30 min。反应结束后将样品通过抽滤进行固液分离,用蒸馏水将固体样品洗涤至pH呈中性,测定其固体回收率及组分含量,滤液取样用高效液相色谱测定其成分。
碱/H2O2预处理条件:称取干重为30 g的棕榈残渣,置于500 mL锥形瓶中,加入NaOH质量分数为1%、H2O2质量分数分别为0.6%、1%和2%的溶液300 mL,即固液比为1∶10,待试样充分浸润后,置于 40 ℃摇床中,转速200 r/min,浸泡24 h。反应结束后将样品通过抽滤进行固液分离,用蒸馏水将固体样品洗涤至pH呈中性,测定其固体回收率及组分含量,滤液取样用高效液相色谱测定其成分。
1.2.2 酶解条件
称取预处理后的棕榈残渣干重分别为1 g、2 g、3 g、4 g、5 g和6 g,置于50 mL锥形瓶中,加入pH值为4.8的醋酸-醋酸钠缓冲溶液5 mL,添加蒸馏水至液体总体积为20 mL,即酶解时的底物浓度分别为5%、10%、15%、20%、25%和30%,酶载量为10~40 FPU/g,温度为45 ℃,转速为150 r/min,酶解结束后取上清液用高效液相色谱测定其还原糖含量。
酶解转化率采用以下公式计算:
纤维素酶解转化率 (%)= 酶解液中葡萄糖含量×100 / (底物中纤维素含量×1.11);
半纤维素酶解转化率 (%)= 酶解液中木糖含量×100 / (底物中半纤维素含量×1.13);
其中,1.11是指1 g纤维素理论上产生1.11 g葡萄糖;1.13是指1 g半纤维素理论上产生1.13 g木糖。
1.2.3 同步糖化发酵条件
称取预处理后的棕榈残渣干重分别为1 g、2 g、3 g、4 g、5 g和6 g,置于50 mL锥形瓶中,加入5 mL醋酸-醋酸钠缓冲溶液 (pH 4.8),添加蒸馏水至总体积为20 mL,即同步糖化发酵时的底物浓度分别为5%、10%、15%、20%、25%和30%,酶载量为30 FPU/g,接种量为5%,温度为35 ℃,转速为150 r/min,发酵结束后取上清液用高效液相色谱测定其还原糖含量及乙醇含量。
乙醇得率采用以下公式计算:
乙醇得率 (%)= 发酵液中乙醇含量×100/(底物中纤维素含量×0.56);
其中,0.56是指1 g纤维素理论上产生0.56 g乙醇。
1.2.4 测定方法
棕榈残渣原料中三组分 (即纤维素、半纤维素和木质素)含量的测定方法见文献[19]。葡萄糖、木糖、乙醇、乙酸等物质的含量用高效液相色谱法进行测定。
高效液相色谱测定条件:色谱柱型号是Aminex® HPX-87H 柱 (Bio-Red美国),柱温65 ℃,流动相 0.005 mol/L H2SO4,流速为0.8 mL/min;RID-10A 检测器(岛津公司);进样量 20 μL。
2 结果与分析
2.1 预处理条件对原料组分的影响
不同预处理条件下的固体回收率及滤液组分分析如表1所示,在只有一步低温预处理条件下,NaOH浓度越大,固体回收率越低,NaOH浓度为0.5%时预处理后固体回收率为84.01%,而当 NaOH浓度增加至 2%时固体回收率却为76.59%。在两步预处理条件下,高温处理时间越长,固体回收率越低,最低为 72.67%,相应的滤液中葡萄糖和木糖浓度就越高,但都在 1 g/L之下,乙酸含量也有了明显提高,最高可以达到8.72 g/L,这是由于预处理强度越大,棕榈纤维原料中木质素脱除率就越高,纤维素和半纤维素也有少量的降解,但总的来说,纤维素和半纤维素主要存在于固相中。在碱/ H2O2预处理条件中,随着 H2O2浓度的增大,固体回收率有所降低,但基本保持在 76.17%~79.14%范围内,液相中木糖含量比其他预处理条件高,这是由于 H2O2对半纤维素也有一定的降解作用。由表1可以看出,液相中乙酸含量最高的是2% NaOH高温处理30 min的结果,乙酸浓度可以达到8.72 g/L,结合图1进行分析,2% NaOH高温处理30 min之后,木质素含量也最低,说明经过NaOH高温预处理之后,棕榈纤维内部结构具有更强的改变,木质素脱除率也就越高。由于预处理液中成分较为简单,可以考虑补加适量碱后循环利用。
不同预处理条件对棕榈残渣预处理后的固体组分含量测定结果如图1所示,随着NaOH浓度的增大,棕榈残渣中的纤维素和半纤维素含量逐渐增大,木质素含量逐渐减少。本文测定未处理的棕榈原料中纤维素含量为 32.52%,半纤维素含量为 21.25%,木质素含量为 17.57%。用0.5% NaOH预处理后三组分含量变化不大,当预处理条件中NaOH浓度为1%时,棕榈残渣中的纤维素含量可以达到45%,半纤维素含量可达到 26%,木质素含量降为 13%,与原料相比有较为明显的变化;2% NaOH与1% NaOH预处理后棕榈残渣中的三组分含量变化不大。用NaOH和 H2O2处理后,纤维素、半纤维素和木质素含量也可分别达 43%、28%和 15%,较原料也有明显变化。但随着 H2O2浓度的增大,三组分含量却不再改变。总之,预处理时间和H2O2用量对组分含量变化的影响不如 NaOH浓度和温度显著,因此,选择用1% NaOH高温预处理条件比较合适。
2.2 预处理条件对酶解的影响
对不同预处理条件下的棕榈残渣固体样品以底物浓度5%、酶载量30 FPU/g酶解72 h,结果如图2所示,随着NaOH浓度和预处理强度的增大,纤维素和半纤维素酶解率依次增大。浓度为 1% NaOH预处理后纤维素酶解率和半纤维素酶解率分别可达 80%以上,而浓度为 0.5%NaOH预处理后纤维素酶解率和半纤维素酶解率分别只有44.04%和38.65%。但是当NaOH浓度增加至2%时,纤维素酶解率和半纤维素酶解率较1% NaOH却不再增加,因此,本实验预处理条件中NaOH 适宜浓度为1%。

表1 预处理后固体回收率及液相组分分析Table 1 Effects of different pretreatment conditions on the solid recovery and the liquid composition
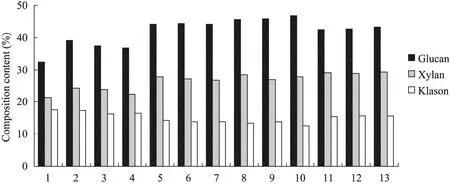
图1 不同预处理条件对棕榈残渣固体组分含量的影响Fig. 1 Effects of different pretreatment conditions on the contents of solid composition in palm residues. 1: untreated EFB; 2: 0.5% NaOH, 40 ℃, 24 h; 3: 0.5% NaOH, 40 ℃, 24 h; 121 ℃, 5 min; 4: 0.5% NaOH, 40 ℃, 24 h; 121 ℃,30 min; 5: 1% NaOH, 40 ℃, 24 h; 6: 1% NaOH, 40 ℃, 24 h; 121 ℃, 5 min; 7: 1% NaOH, 40 ℃, 24 h; 121 ℃, 30 min;8: 2% NaOH, 40 ℃, 24 h; 9: 2% NaOH, 40 ℃, 24 h; 121 ℃, 5 min; 10: 2% NaOH, 40 ℃, 24 h; 121 ℃, 30 min; 11:1% NaOH+0.6% H2O2, 40 ℃, 24 h; 12: 1% NaOH+1% H2O2, 40 ℃, 24 h; 13: 1% NaOH+2% H2O2, 40 ℃, 24 h.
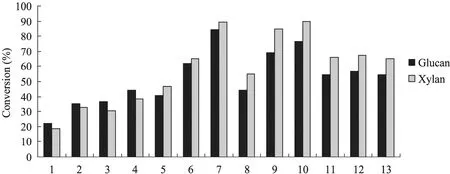
图2 不同预处理条件对棕榈残渣酶解的影响Fig. 2 Effects of different pretreatment conditions on enzymatic hydrolysis for palm residues. 1: untreated EFB; 2:0.5% NaOH, 40 ℃, 24 h; 3: 0.5% NaOH, 40 ℃, 24 h; 121 ℃, 5 min; 4: 0.5% NaOH, 40 ℃, 24 h; 121 ℃, 30 min; 5:1% NaOH, 40 ℃, 24 h; 6: 1% NaOH, 40 ℃, 24 h; 121 ℃, 5 min; 7: 1% NaOH, 40 ℃, 24 h; 121℃, 30 min; 8: 2%NaOH, 40 ℃, 24 h; 9: 2% NaOH, 40 ℃, 24 h; 121 ℃, 5 min; 10: 2% NaOH, 40 ℃, 24 h; 121 ℃, 30 min; 11: 1%NaOH+0.6% H2O2, 40 ℃, 24 h; 12: 1% NaOH+1% H2O2, 40 ℃, 24 h; 13: 1% NaOH+2% H2O2, 40℃, 24 h.
用1% NaOH在121 ℃对棕榈残渣高温预处理之后酶解转化率比40 ℃低温处理后的转化率高,说明高温预处理之后棕榈纤维内部结构有了更为明显的变化,增加了酶与底物的可及度,促进了纤维素和半纤维素的酶解。当NaOH浓度为1%时,随着高温预处理反应时间的增加,纤维素和半纤维素酶解率不断增大,121 ℃下反应5 min后,纤维素酶解率和半纤维素酶解率分别只有 62.07%和 64.98%,当反应时间为 30 min时,纤维素酶解率和半纤维素酶解率分别可达84.44%和89.28%,较5 min时有了明显的提高,说明高温下的反应时间对酶解率影响显著。因此,本实验预处理条件中121 ℃下反应 30 min较为合适。用NaOH和H2O2低温预处理后的固体样品,酶解率明显优于采用NaOH低温预处理的样品,但随着 H2O2浓度的增大,酶解率变化不大,纤维素和半纤维素酶解率分别为 57%和67%,效果不如碱高温处理效果明显。由图2可以看出,7号样品的酶解效果最好,因此,本实验中适宜的预处理条件为:NaOH浓度为1%,先在40 ℃浸泡24 h后置于121 ℃保温30 min。
2.3 酶用量对酶解的影响
用1% NaOH以固液比1∶10对棕榈残渣进行预处理,先在 40 ℃下浸泡 24 h,然后置于121 ℃下保温30 min,对预处理后的固体以不同酶用量 (10~40 FPU/g)进行酶解,酶解时底物浓度为5%,酶解72 h后结果如图3所示。随着酶用量的增大,酶解所得的葡萄糖浓度和木糖浓度也逐渐增大。当酶用量为10 FPU/g时,酶解72 h后葡萄糖浓度和木糖浓度分别为 15.91 g/L和10.42 g/L,纤维素酶解率和半纤维素酶解率分别为 65.71%和 72.72%,但是当酶用量增加至30 FPU/g时,酶解72 h后所得的葡萄糖浓度和木糖浓度分别为20.59 g/L和12.61 g/L,相应的纤维素酶解率和半纤维素酶解率分别可以达到84.44%和89.28%,达到最大值,之后随着酶用量的增大,葡萄糖和木糖浓度不再增加。预处理后固体样品中的木质素含量仍较高,这也可能是需要较高酶用量的原因。

图3 不同酶用量对酶解的影响Fig. 3 Effects of different enzyme dosage on enzymatic hydrolysis. (A)Relationship between glucose concentration and hydrolysis time. (B)Relationship between xylose concentration and hydrolysis time.
2.4 底物浓度对酶解的影响
用1% NaOH以固液比1∶10对棕榈残渣进行预处理,先在 40 ℃下浸泡 24 h,然后置于121 ℃下反应 30 min,预处理后的固体样品以30 FPU/g加酶量对不同浓度 (5%~30%)底物进行酶解,酶解72 h后结果如图4所示。随着底物浓度的增大,纤维素和半纤维素酶解率逐渐减小,而葡萄糖浓度和木糖浓度却逐渐增大。底物浓度为5%时纤维素和半纤维素酶解率最大,分别为84.44%和89.28%,葡萄糖浓度为20.47 g/L,木糖浓度为12.63 g/L。当底物浓度提高至10%时,纤维素和半纤维素酶解率分别为 66.55%和75.89%,此时葡萄糖和木糖浓度分别可以达到29.27 g/L和 20.89 g/L。而当底物浓度增加至25%时,葡萄糖浓度和木糖浓度不再随着底物浓度的增加而增大,分别为47.44 g/L和31.43 g/L,相应的纤维素酶解率和半纤维素酶解率分别为43.13%和50.29%,这可能是由于底物浓度越大时,酶解体系中的木质素含量也就越高,因此影响了酶的活性及稳定性,导致酶解率降低。
2.5 底物浓度对同步糖化发酵的影响
用1% NaOH以固液比1∶10对棕榈残渣进行预处理,先在 40 ℃下浸泡 24 h,然后置于121 ℃下反应30 min,预处理后的固体样品以酶载量30 FPU/g、接种量5%对不同浓度 (5%~30%)底物进行同步糖化发酵,发酵72 h后结果如图5所示。随着底物浓度的增大,发酵所得的乙醇浓度逐渐增大,当底物浓度为25%时乙醇浓度达到最大,为35.25 g/L,生产强度为0.49 g/(L·h),乙醇得率为理论得率的56.96%。在5%~30%范围内,底物浓度越大,发酵所得的乙醇得率越低。当底物浓度为5%时发酵72 h后乙醇得率为理论得率的79.07%,而当底物浓度增加至30%时乙醇得率仅为理论得率的 44.91%。这是由于随着底物的增加,导致机械搅拌和传质的困难,造成有害抑制物的积累,使得乙醇的得率有所降低。在整个发酵过程中,葡萄糖含量一直很低,浓度基本在5 g/L以下,只是在12 h有一些短暂的累积,发酵72 h结束时葡萄糖含量几乎为零,这表明酶解糖化得到的葡萄糖能很快地被酵母利用,这也是同步糖化发酵过程的主要特征。由于本实验所用的酵母菌不能利用木糖,所以随着发酵的进行木糖含量随之增加,发酵至72 h时底物浓度为25%的木糖浓度可以达到25.75 g/L,达到最大值。
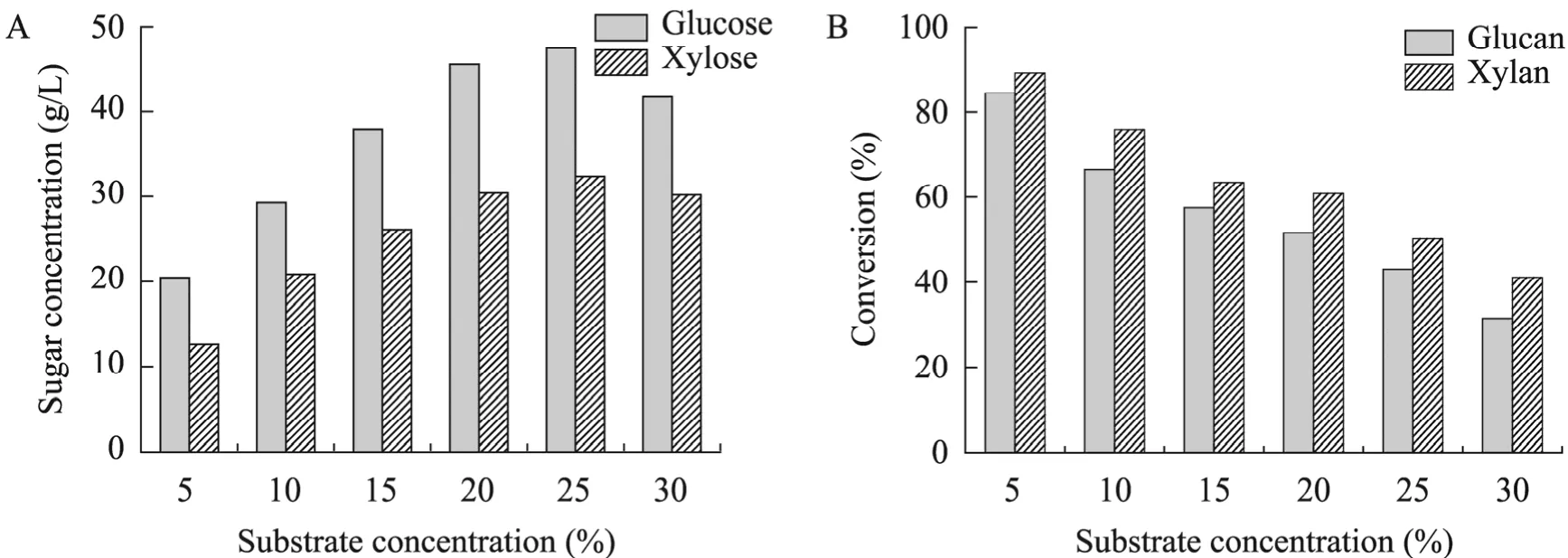
图4 不同底物浓度对酶解的影响Fig. 4 Effects of different substrate concentration on enzymatic hydrolysis. (A)Relationship between sugar concentration and substrate concentration. (B)Relationship between enzymatic hydrolysis conversion and substrate concentration.
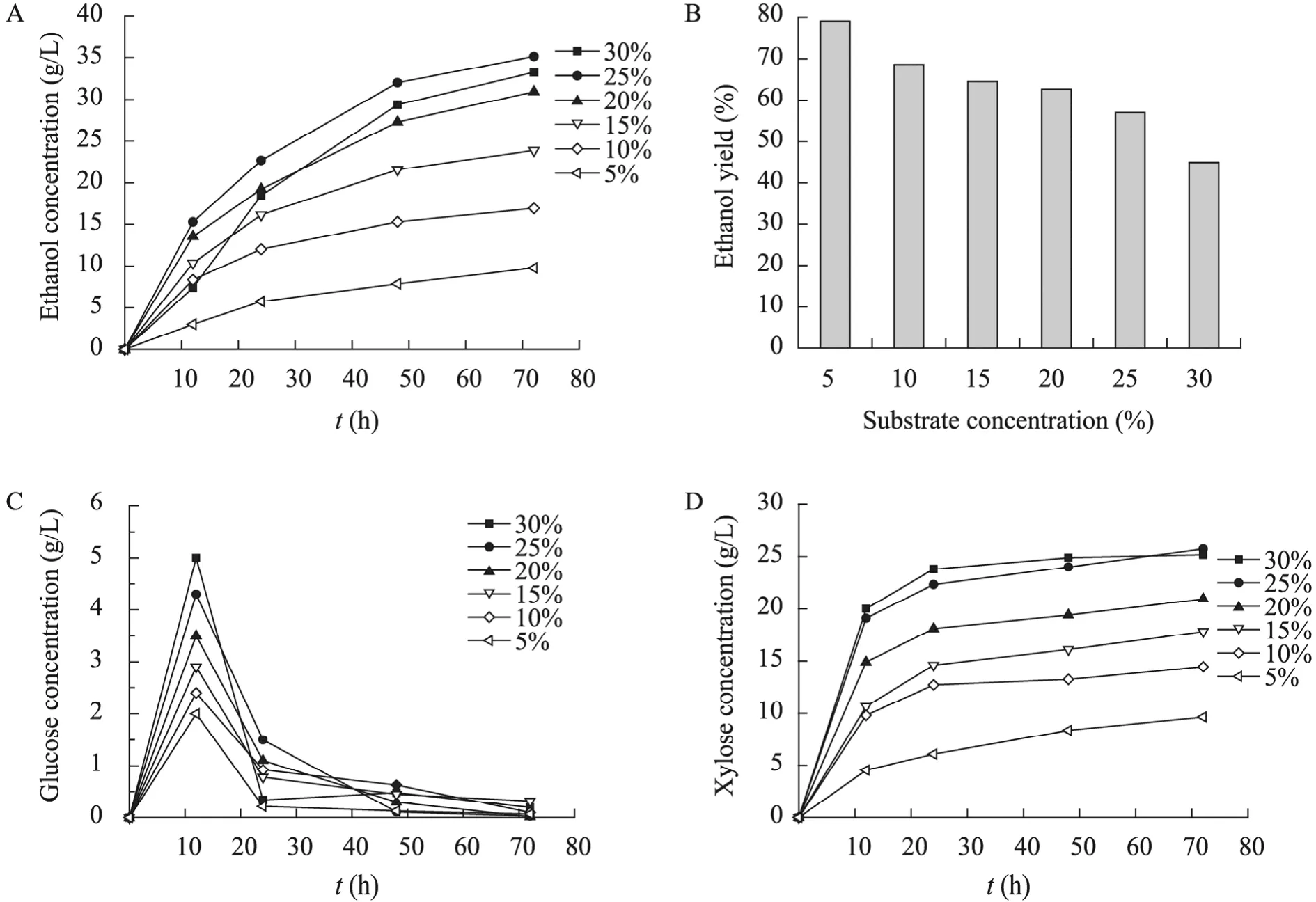
图5 不同底物浓度的同步糖化发酵过程Fig. 5 Simultaneous saccharification and fermentation of different substrate concentration. (A)Relationship between ethanol concentration and fermentation time. (B)Relationship between Ethanol yield and substrate concentration. (C)Relationship between glucose concentration and fermentation time. (D)Relationship between xylose concentration and fermentation time.
3 结论
本实验研究表明,碱处理棕榈残渣的较适宜预处理条件为:NaOH浓度为1%,固液比1∶10,先在40 ℃时浸泡24 h,然后置于121 ℃下保温30 min。在该预处理条件下,棕榈残渣固体样品中纤维素含量由32.52%变为44.08%,半纤维素含量由 21.25%变为 25.74%,木质素含量由17.57%变为13.89%,这说明大部分纤维素和半纤维素依然存在于固体中,而部分木质素被降解在液体中,NaOH对木质素的降解作用明显。对该预处理条件下的固体样品以底物浓度为5%进行酶解,纤维素酶解率和半纤维素酶解率分别为84.44%和89.28%,而未经预处理的棕榈残渣原料纤维素酶解率和半纤维素酶解率分别只有22.07%和18.39%。考察了酶载量和底物浓度对酶解的影响以及不同底物浓度的乙醇同步糖化发酵,当底物浓度为5%时,发酵72 h后乙醇的浓度为9.76 g/L,达到理论得率的79.09%,生产强度为0.14 g/(L·h);当底物浓度增加至25%时,发酵72 h后乙醇的浓度为35.25 g/L,达到理论得率的56.96%,生产强度为0.49 g/(L·h)。Jung等[15]对 21%氨水处理过的棕榈空壳串以 5%纤维素底物量进行同步糖化发酵,168 h后乙醇浓度为18.6 g/L,达到理论得率的65.6%,生产强度为0.11 g/(L·h)。常春等[20]考察了不同工艺的高底物浓度对纤维乙醇同步糖化发酵的影响,当原料浓度为30%时,采用预酶解补料同步糖化发酵耦合真空分离工艺的乙醇得率最高,可以达到44.98%,生产强度为 0.4 g/(L·h)。因此,后续的实验可以探讨通过进一步改善浸泡过程以及预酶解补料等手段来进一步提高酶解率和乙醇得率。
[1]Lynd LR, Weimer PJ, van Zyl WH, et al. Microbial cellulose utilization: fundamentals and biotechnology. Microbiol Mol Biol Rev, 2002,66(3): 506−577.
[2]Ma XG, Xu HY, Li WZ. Research progresses in fuel ethanol production from lignocellulosic materials. Nat Gas Chem Ind, 2008, 33(4): 60−65(in Chinese).马现刚, 徐恒泳, 李文钊. 木质纤维素生产燃料乙醇的研究进展. 天然气化工, 2008, 33(4):60−65.
[3]Hu XT. Progress of cellulose ethanol research &development. Chem Ind Eng Prog, 2011, 30(1):137−143 (in Chinese).胡徐腾. 纤维素乙醇研究开发进展. 化工进展,2011, 30(1): 137−143.
[4]Cui YQ, Lin Y, Hua XY, et al. Progress in fuel ethanol production from lignocellulosic biomass.Chem Ind Eng Prog, 2010, 29(10): 1868−1876 (in Chinese).崔永强, 林燕, 华鑫怡, 等. 木质纤维素为原料的燃料乙醇发酵技术研究进展. 化工进展, 2010,29(10): 1868−1876.
[5]Ng WPQ, Lam HL, Ng FW, et al. Waste-to-wealth:green potential from palm biomass in Malaysia. J Clean Prod, 2012, 34: 57−65.
[6]Tan HT, Lee KT, Mohamed AR. Secondgeneration bio-ethanol (SGB)from Malaysian palm empty fruit bunch: energy and exergy analyses.Bioresour Technol, 2010, 101(14): 5719−5727.
[7]Zhang Y, Xu JL, Wang Q, et al. Saccharification of palm shell by cellulase to produce ethanol. Trans CSAE, 2008, 24(10): 186−189 (in Chinese).张宇, 许敬亮, 王琼, 等. 纤维素酶水解棕榈壳制取乙醇研究. 农业工程学报, 2008, 24(10):186−189.
[8]Wang Q, Zhuang XS, Zhang Y, et al. Research on fuel ethanol production from palm shells. Food Fermen Ind, 2008, 34(9): 65−68 (in Chinese).王琼, 庄新姝, 张宇, 等. 棕榈壳发酵制取燃料乙醇的研究. 食品与发酵工程, 2008, 34(9):65−68.
[9]Hu D, Yang QD, Liu H, et al. Research progresses of the pretreatment technology of lignocellulose.Hunan Agric Sci, 2010(19): 105−108 (in Chinese).胡蝶, 杨青丹, 刘洪, 等. 木质纤维素预处理技术研究进展. 湖南农业科学, 2010(19): 105−108.
[10]Wen XY, Li YS, Zhang ZP, et al. Research progress in pretreatment of lignocellulose by enzymolysis. Liquor-Making Sci Technol, 2006(8):97−100 (in Chinese).文新亚, 李燕松, 张志鹏, 等. 酶解木质纤维素的预处理技术研究进展. 酿酒科技, 2006(8):97−100.
[11]Luo P, Liu Z. Pretreatment of lignocellulosic biomass for producing ethanol. Liquor-Making Sci Technol, 2005(8): 42−47 (in Chinese).罗鹏, 刘忠. 用木质纤维原料生产乙醇的预处理工艺. 酿酒科技, 2005(8): 42−47.
[12]Xing T, Cheng KK, Zhang JA, et al. Research progress on pretreatment technologies of lignocellulosic for fuel ethanol production. Mod Chem Ind, 2007, 27(S2): 92−97 (in Chinese).幸婷, 程可可, 张建安, 等. 利用木质纤维原料制取燃料乙醇预处理方法的研究进展. 现代化工, 2007, 27(S2): 92−97.
[13]Weil J, Westgate P, Kohlmann K, et al. Cellulose pretreatments of lignocellulosic substrates. Enzyme Microb Technol, 1994, 16(11): 1002−1004.
[14]Umikalsom MS, Ariff AB, Karim IAM, et al.Saccharification of pretreated oil palm empty fruit bunch fiber using cellulase of Chaetomium globosum. J Agric Food Chem, 1998, 46(8):3359−3364.
[15]Jung YH, Kim IJ, Han JI, et al. Aqueous ammonia pretreatment of oil palm empty fruit bunches for ethanol production. Bioresour Technol, 2011,102(20): 9806−9809.
[16]Kim S, Park JM, Seo JW, et al. Sequential acid-/alkali-pretreatment of empty palm fruit bunch fiber. Bioresour Technol, 2012, 109: 229−233.
[17]Kassim MA, Kheang LS, Bakar NA, et al.Biothanol production from enzymatically saccharified empty fruit bunches hydrolysate using Saccharomyces cerevisiae. J Environ Sci, 2011,5(6): 573−586.
[18]Hou LF, Ding CH, Sun XY, et al. Study on removement of lignin by pretreatments. Food Res Dev, 2008, 29(1): 94−96 (in Chinese).侯丽芬, 丁长河, 孙向阳, 等. 预处理脱除木质素的研究. 食品研究与开发, 2008, 29(1): 94−96.
[19]Sluiter A, Hames B, Ruiz R, et al. NREL Laboratory Analytical Procedure “Determination of Structural Carbohydrates and Lignin in Biomass”[EB/OL]. [2012-09-28]. http://www.nrel.gov/biomass/analytical_procedures.html. 42618.
[20]Chang C, Wang D, Wang LF, et al. Comparative study on processes of simultaneous saccharification and fermentation with high solid concentration for cellulosic ethanol production. J Chem Eng, 2012,63(3): 935−940 (in Chinese).常春, 王铎, 王林风, 等. 高底物浓度纤维乙醇同步糖化发酵工艺的比较. 化工学报, 2012,63(3): 935−940.