干扰视黄醇结合蛋白4对猪脂肪细胞PI3K/Akt信号通路的影响
蒲蕾,程佳,吴国芳,杨浩,仇杨,张振宇,杨公社,孙世铎
西北农林科技大学 动物脂肪沉积与肌肉发育实验室,陕西 杨凌 712100
干扰视黄醇结合蛋白4对猪脂肪细胞PI3K/Akt信号通路的影响
蒲蕾,程佳,吴国芳,杨浩,仇杨,张振宇,杨公社,孙世铎
西北农林科技大学 动物脂肪沉积与肌肉发育实验室,陕西 杨凌 712100
蒲蕾, 程佳, 吴国芳, 等. 干扰视黄醇结合蛋白4对猪脂肪细胞PI3K/Akt信号通路的影响. 生物工程学报, 2013, 29(4):447−457.
Pu L, Cheng J, Wu GF, et al. Effects of retinol binding protein 4 knockdown on the PI3K/Akt pathways in porcine adipocytes.Chin J Biotech, 2013, 29(4): 447−457.
视黄醇结合蛋白4 (Retinol binding protein 4,RBP4) 是一种脂肪细胞分泌因子,其表达水平的升高与胰岛素抵抗及Ⅱ型糖尿病等疾病密切相关,但具体作用机制尚不清楚。为明确此机制,通过包装RBP4干扰慢病毒并侵染猪前体脂肪细胞。运用胰岛素激活及诱导胰岛素抵抗模型,利用QRT-PCR及Western blotting方法检测RBP4的干扰效率及处理组PI3K/Akt信号通路相关基因的表达。结果显示RBP4的基因及蛋白的干扰效率达到60% (P<0.01) 以上。进一步研究发现在胰岛素诱导及胰岛素抵抗的情况下,LH1-shRBP4干扰后可显著提高胰岛素信号通路AKT2、PI3K、GLUT4和IRS1基因mRNA的表达;明显促进AKT2、PI3K和IRS1蛋白的磷酸化;提高AKT2、PI3K和GLUT4基因的总蛋白水平。总之,RBP4干扰通过上调PI3K/Akt胰岛素信号通路相关因子的表达及其磷酸化水平,提高了胰岛素敏感性。此研究将为胰岛素抵抗相关疾病的治疗提供新思路。
视黄醇结合蛋白4,慢病毒,前体脂肪细胞,猪,胰岛素信号通路
视黄醇结合蛋白 4 (Retinol binding protein 4,RBP4) 是一类相对分子质量为2l kDa的维生素A (全反式视黄醇) 运载蛋白,由181个氨基酸组成,肝脏是合成RBP4的主要场所。它是唯一运载维生素A的特殊蛋白,可将维生素A转运到各个组织[1]。
腹部肥胖是胰岛素抵抗的肥胖标志特征之一,Gavi等在对糖耐量受损的Ⅱ型糖尿病患者血清研究发现,血液RBP4水平与躯干脂肪百分比呈正向相关[2]。研究发现 RBP4水平的降低与脂肪从躯干到四肢的分布转化有关,而与机体总脂肪含量的降低无关[3]。经统计全世界约有4%~5%的人患有糖尿病,并且呈现逐年上升的趋势[4]。代谢综合症人群的五大 (空腹血浆葡萄糖、血清甘油三脂、血清高密度脂蛋白-胆固醇HDL-G、血压、腰围) 指标中,有4个 (除高血糖) 与 RBP4的含量呈现正向相关关系[1]。Graham等研究发现血清 RBP4水平与胰岛素抵抗存在显著的正相关性[3]。Cho等和Takebayashi等也观察到糖耐量异常和Ⅱ型糖尿病人群中血清RBP4水平显著升高[5-6]。对RBP4水平与体重指数及胰岛素抵抗的多重线性回归分析说明,RBP4与胰岛素抵抗和体重指数有显著的正向相关关系[7]。有研究发现,脂肪特异性敲除葡萄糖转运蛋白4 (Glucose transporter 4,GLUT4) 基因的小鼠,其脂肪组织中RBP4mRNA的表达较野生型高2.3倍,而在过表达脂肪GLUT4基因小鼠的脂肪组织中,RBP4mRNA的表达较野生型降低54%。众所周知,当机体胰岛素抵抗的情况下,机体组织的胰岛素敏感性是降低的,当一定量胰岛素刺激的情况下无法达到该有的葡萄糖转运应答反应。肥胖妇女及瘦型妇女的血清RBP4浓度无差异,血清RBP4的水平与胰岛素敏感性及非氧化型葡萄糖代谢呈反向相关关系,并且RBP4水平与葡萄糖或者脂质的氧化型代谢无关[8]。有研究指出,降低RBP4的表达水平也被认为是一种治疗Ⅱ型糖尿病的新方法[9]。RBP4的基础水平与胰岛素敏感性反向相关[10-11]。地塞米松处理脂肪细胞后可以诱导胰岛素抵抗的状态[12-14]。也有报道称高糖和高胰岛素可以引起人脂肪细胞胰岛素抵抗,影响GLUT4蛋白的转位,胰岛素受体底物蛋白 (Insulin receptor substrate,IRS) 络氨酸磷酸化,丝氨酸激酶 (Serine threonine kinase,Akt) 及磷酯酰肌醇 3激酶(Phosph-oinositide-3-kinase,PI3K) 的活性[15-16]。
综上所述,RBP4基因与胰岛素敏感性的关系极其密切,也被认为是胰岛素信号通路的候补基因之一[17],但是研究结果仅限相关性分析,RBP4与PI3K/Akt胰岛素信号通路之间的调控关系还尚未系统研究。因此,本实验拟围绕这一问题,以猪原代脂肪细胞为材料,通过胰岛素短时激活及高胰岛素+高糖+地塞米松诱导胰岛素抵抗模型,利用慢病毒介导的 RBP4干扰,研究RBP4的缺失是否能够提高胰岛素信号通路相关基因的表达,对胰岛素抵抗有所改善。为胰岛素抵抗引起的糖尿病的治疗提供理论依据。
1 材料与方法
1.1 材料
细胞培养用3日龄大白猪仔猪,均由西北农林科技大学实验猪场提供。LH1-shRBP4-EGFP及包装用293T细胞由本实验室保存。TaqDNA聚合酶、逆转录和Real-time PCR试剂盒、Trizol均购自 TaKaRa公司;DMEM 高糖培养基购自Hyclone公司;DMEM/F12(DMEM/F12 (1∶1)含17.5 mmol/L葡萄糖)、Ⅰ型胶原酶、胎牛血清均购自Gibco公司;质粒小量提取试剂盒、凝胶回收试剂盒均购自BioFlux公司;DEPC (焦炭酸二乙酯) 原液分装购自 Sigma公司;Western印迹所用抗体均购自Santa公司,其他试剂均为国产或进口分析纯。实时定量所用引物均由上海生物工程有限公司合成。
1.2 方法
1.2.1 RBP4慢病毒的包装及滴度测定
大量扩繁并提取LH1-shRBP4-EGFP重组载体质粒与pCMVp8.9△质粒和pVSVG质粒。将293T细胞以适宜的密度接种于培养皿中。待细胞密度达90%左右时进行包装;利用磷酸钙法将LH1-shRBP4-EGFP重组载体质粒与pCMVp8.9△质粒、pVSVG质粒以一定比例混合共转293T细胞;16~18 h后换为新鲜培养基;24 h后观察荧光蛋白表达情况,48 h和72 h后分别收集上清。3 000 r/min离心10 min,弃去细胞碎片,按照 10倍倍比稀释病毒,得到 100~10−6浓度梯度,分别感染293T细胞,2 d后观察荧光表达情况,计算病毒滴度。
计算公式为:病毒滴度 (TU/mL) =GFP阳性细胞数×病毒稀释倍数/0.01 mL。
1.2.2 猪原代前体脂肪细胞的培养
无菌条件下,分离3日龄大白猪肩胛部的皮下脂肪组织,PBS (加入双抗) 缓冲液冲洗3次,剪碎后移入装有Ⅰ型胶原酶消化液的容器中,置于37 ℃温浴摇床内振荡40~60 min,加含血清培养液终止消化;用孔径为200目的细胞钢筛过滤,用离心管收集滤液,1 500×g离心8 min,弃上清液;加入PBS,吹打均匀后离心,弃上清液,反复3次;加入含10%胎牛血清的DMEM/F12培养液,吹打均匀,接种于培养皿中。
1.2.3 猪脂肪细胞的处理及分组
猪原代脂肪前体细胞长至 80%时,用shRBP4的慢病毒侵染猪脂肪细胞,侵染8 h后换正常10%胎牛血清的DMEM/F12培养基。培养1 d后用传统的鸡尾酒法诱导脂肪细胞分化,处理 7 d后进行处理,具体操作如下:对照组(Con),正常培养基培养48 h收RNA,72 h收蛋白;胰岛素短时刺激组 (Ins),正常 DMEM/F12培养基培养48 h后,用含胰岛素10 nmol/L的DMEM/F12培养基培养90 min后收RNA及蛋白;胰岛素抵抗组 (IR),含胰岛素100 nmol/L+葡萄糖50 mmol/L+0.1 μmol/L dex的DMEM/F12培养基培养8 h后,用胰岛素处理90 min后收RNA,72 h收蛋白。
1.2.4 反转录及实时定量RT-PCR
利用Trizol法提取不同处理组细胞的RNA,按照TaKaRa逆转录试剂盒说明合成cDNA。然后利用两步法试剂盒说明在BIO-RAD iQ5系统中进行 qRT-PCR检测,分析检测结果,相对表达量用2−△△Ct进行计算,然后用SPSS软件对试验结果进行分析,引物信息见表1。
1.2.5 Western blotting检测PI3K/Akt信号通路相关基因的蛋白表达
按正常组 (无关、shR),Ins (无关、shR) 和IR (无关、shR) 的中皿细胞分别做好标记 (无关即nonsense乱序慢病毒对照,下图标为non),加入200 mL裂解液,于冰上裂解。用BCA法测定蛋白浓度,调整总蛋白浓度后,按1∶1加入2×上样缓冲液,沸水浴10 min,用12%预制胶进行SDS-PAGE电泳分离,电泳完毕后电转移到硝酸纤维素膜上,用5%脱脂牛奶室温封闭2 h,一抗孵育2 h,加入HRP标记的二抗孵育常温2 h,最后用发光液进行化学发光显示结果。

表1 实时定量PCR相关基因的引物序列及参数Table 1 Primer sequences and parameters for real-time PCR of related genes
2 结果与分析
2.1 RBP4慢病毒载体的包装与病毒滴度测定
将 LH1-shRBP4-EGFP重组载体质粒与pCMVp8.9△质粒和pVSVG质粒共转染293T细胞,48 h及72 h后细胞生长状态良好,90%以上细胞表达绿色荧光蛋白 (图 1)。分别在 48 h和72 h收集病毒上清,经过滤、浓缩后,测定其滴度为 0.6×107TU/mL。
2.2 RBP4慢病毒感染猪前体脂肪细胞后干扰效率的检测
将猪前体脂肪细胞按照 4×105/cm2密度接种小皿,继续培养24 h后,用含LH1-RBP4 shRNA和无关序列慢病毒,添加6 μg/mL凝聚胺助转剂的1.5 mL病毒液分别侵染细胞,6 h后更换为正常培养基,48 h后荧光显微镜下观察,可见90%以上的猪前体脂肪细胞已经表达绿色荧光蛋白(图2A、B)。病毒感染细胞48 h后,提取总RNA,反转录后进行qRT-PCR检测。感染72 h后,收蛋白进行Western blotting检测。实时定量结果表明,shRNA慢病毒载体感染猪前体脂肪细胞后,RBP4 mRNA及蛋白水平均显著下调 (图2C、D),shRNA基因的干扰效率达到 60%,能满足后续实验要求。
2.3 胰岛素刺激及IR的情况下干扰RBP4对PI3K/Akt信号通路相关基因mRNA的影响

图1 重组慢病毒的产生和荧光蛋白表达Fig. 1 Production and identification of recombinant lentivirus. (A) GFP expression at 48 h, more than 90% cells expressed GFP. (C) GFP expression at 72 h, GFP expression enchanced at 72 h. (B and D) Merged by green fluorescence in A and C.
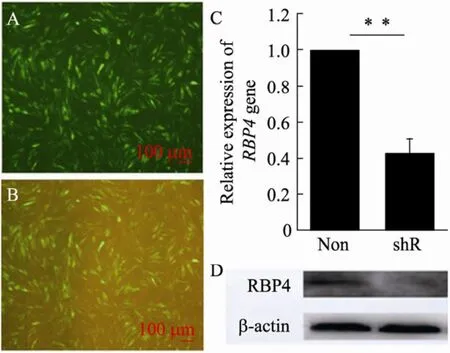
图2 RBP4在猪前体脂肪细胞中的干扰效率检测Fig. 2 Identification of the interference efficiency about RBP4 in porcine preadipocytes. (A) GFP expression of porcine preadipocytes, about 85% cells could express GFP. (B) Merge by green fluorescence in A. (C) qRT-PCR analysis RBP4 and β-actin mRNA expression in porcine preadipocytes infected by lentivirus including shRBP4 namely shR and scrambled shRNA, namely as non, β-actin as internal control. (D)Western blotting analysis of RBP4 and β-actin protein expression in porcine preadipocytes infected by lentivirus including RBP4 and scrambled shRNA. Scrambled as non, β-actin as internal control (**P<0. 01).
培养猪原代脂肪细胞 (图 3A),分别加无关序列干扰慢病毒及shRBP4慢病毒,图3B为病毒在猪脂肪细胞中的表达的绿色荧光图,可见约90%以上的细胞表达绿色荧光蛋白。待细胞汇合进行成脂诱导7 d (图3C),可见猪原代前体脂肪细胞已 70%以上不同程度地充脂,成为了猪成熟脂肪细胞。图D和E为无胰岛素的对照组和胰岛素瞬时处理组猪脂肪细胞的形态观察图,可见两组细胞之间形态相似,与图3C中诱导后的猪脂肪细胞形态差异也不大。图F为猪脂肪细胞经过胰岛素抵抗诱导后的细胞形态图,可见细胞形态几乎消失,较Con组和Ins组细胞的折光性减弱,核质模糊,轮廓模糊,细胞的立体感消失,细胞成脂减少。可见当胰岛素抵抗诱导的情况下,细胞状态变差,呈现不同程度的病理及老化状态。提取各处理组总RNA,反转录后进行实时荧光定量RT-PCR分析,检测RBP4及PI3K/Akt胰岛素信号通路基因丝氨酸-苏氨酸蛋白激酶2 (AKT2)、磷脂酰肌醇-3-激酶 (PI3K)、胰岛素受体底物1 (IRS1)、葡萄糖转运蛋白4 (GLUT4)和β-actin等基因的mRNA表达情况 (图4)。经统计分析发现,慢病毒干扰RBP4后对照组、Ins及IR组中RBP4的mRNA表达与同处理的无关序列病毒处理组相比极显著下降 (P<0.01),说明此实验干扰效果达到实验需要。对照组 (Con组) 中RBP4干扰后对PI3K/Akt胰岛素信号通路相关基因AKT2、PI3K、IRS1和GLUT4基因的mRNA表达无明显促进作用。干扰RBP4后胰岛素处理组 (Ins组) 的PI3K/Akt胰岛素信号通路相关基因AKT2、PI3K、IRS1和GLUT4的mRNA表达量都极显著上升 (P<0.01)。并且 Ins组与Con组相比 PI3K/Akt胰岛素信号通路各基因的表达水平显著上调,这一结果表明在前体脂肪细胞中,胰岛素成功激活了胰岛素信号通路。IR组与 Ins组相比胰岛素通路相关基因都有显著下降,但干扰RBP4可以缓解相关基因表达下降的趋势。干扰RBP4后,AKT2、PI3K及GLUT4基因mRNA表达上升有极为显著上升 (P<0.01),同时IRS1基因的表达也有显著升高 (P<0.05)。
2.4 胰岛素刺激及 IR的情况下干扰 RBP4对 PI3K/Akt信号通路相关基因蛋白表达的影响
提取各处理组总蛋白进行 Western blotting分析,具体检测RBP4及PI3K/Akt胰岛素信号通路基因 AKT、pAKT (Thr308)、PI3K (p85)、pPI3K(p85-Y485 及 p55-Y199)、IRS1、pIRS1 (Ser 307)、GLUT4和β-actin的蛋白表达 (图5)。经分析发现,干扰RBP4后,可促进pIRS1 (Ser307) 的表达,对IRS1总蛋白的影响不大。干扰RBP4后可对pPI3K (p85-Y485及p55-Y199) 的蛋白表达有激活作用,Ins组及IR组的激活作用较明显,干扰RBP4可增加PI3K的总蛋白的表达。干扰RBP4后可显著增加pAKT (Thr308) 蛋白的表达,对照组 AKT的总蛋白表达无明显影响,但对 Ins及IR组的AKT总蛋白表达有促进作用。干扰RBP4对各个处理组GLUT4蛋白的表达有促进作用。

图3 胰岛素刺激及胰岛素抵抗的情况下猪脂肪细胞的形态学观察Fig. 3 Pig adipocytes morphology observation under the circumstance of insulin stimulate and insulin resistance. (A)Porcine preadipocyte before being infected by lentivirus. (B) Porcine preadipocyte after being infected by lentivirus. (C)After infected by lentivirus preadipocytes were induced for 7 days to differentiate by cocktail way. (D) After induced 7 days, control group normal cell. (E) After induced 7 days, insulin stimulus group cell. (F) After induced 7 days, insulin resistance group cell.

图4 胰岛素刺激及胰岛素抵抗的情况下猪脂肪细胞干扰RBP4对PI3K/Akt胰岛素信号通路相关基因mRNA水平分析Fig. 4 Relative mRNA expression levels of insulin signal pathway in adipocytes infected with RBP4 shRNA, under the circumstance of insulin stimulate and insulin resistance. Real-time PCR analysis RBP4, AKT2, PI3K, IRS1, GLUT4 and β-actin mRNA expression in porcine adipocytes infected by lentivirus including sh RBP4 namely shR and scrambled shRNA namely non, the group of control namely Con, the group of insulin stimulate namely Ins and the group of insulin resistance namely IR, as is show in A-E (*P<0. 05; **P<0. 01).
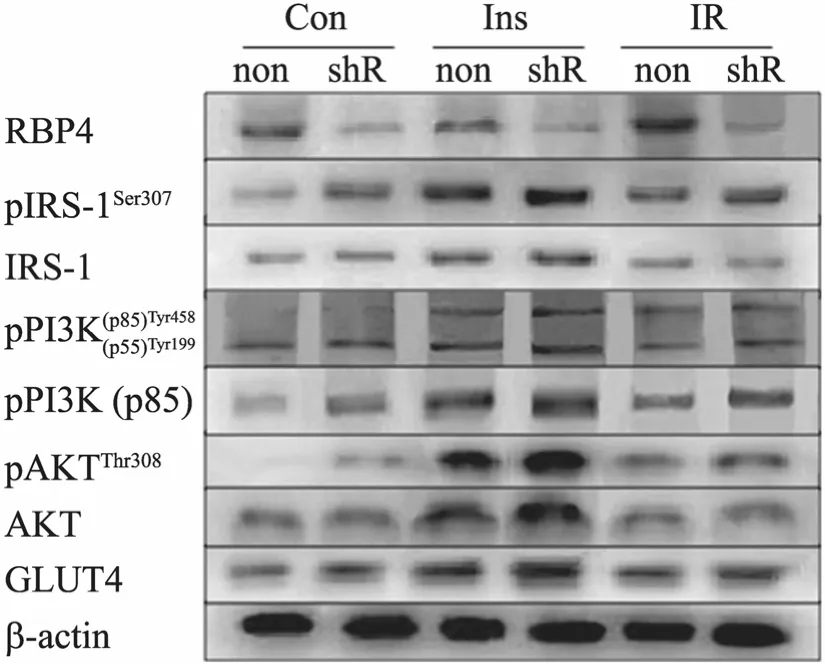
图5 胰岛素刺激及胰岛素抵抗的情况下RBP4干扰对PI3K/Akt胰岛素信号通路相关基因蛋白表达的影响Fig. 5 Protein expression levels of insulin signal pathway in adipocytes infected with RBP4 shRNA, as the insulin stimulate and insulin resistance.Preadipocytes infected by lentivirus were induced for 7 days by cocktail way, then the insulin stimulate and conduct with insulin resistance, total proteins were extracted for Western blotting. β-actin as internal control. Western blotting analysis of RBP4, AKT,pAKT, PI3K, pPI3K, IRS1, pIRS1 and GLUT4 protein expression, infected by lentivirus including sh RBP4 namely shR and scrambled shRNA, namely non, the name of group is as same as Fig. 4.
3 讨论
机体中 PI3K/Akt信号通路是经典的胰岛素信号转导的主要途径[18]。这个通路运行的过程可概括为:胰岛素首先与细胞表面胰岛素受体(INSR) 结合,激活 IRS蛋白酪氨酸的磷酸化,进而使PI3K磷酸化,产生瀑布效应,使AKT磷酸化激活,最后使 GLUT4蛋白易位[19],GSK3促进糖原合成等调节葡萄糖的吸收,完成胰岛素的细胞特异性应答介导[20-21]。目前发现 AKT共有3种亚型:AKTl、AKT2和AKT3,三者之间有将近80%的同源性。AKTl在大部分组织中表达,而AKT2主要存在于胰岛素效应组织,AKT3在睾丸和脑组织中高表达[22]。脂肪组织是胰岛素的效应组织之一,故本实验检测的是AKT2的基因和蛋白的表达。IRS1和IRS2是胰岛素受体的两个重要底物。在胰岛素代谢效应方面,促进肌肉、脂肪组织摄取利用葡萄糖,IRS1起主要作用,故本研究只检测IRS1的基因及蛋白表达,未涉及 IRS2。目前 GLUT4基因还尚未划分到PI3K/Akt胰岛素信号通路,但是它是 PI3K/Akt信号通路的效应基因已很明确。因此本实验也检测了GLUT4蛋白及mRNA水平的表达变化。胰岛素抵抗指机体对适量胰岛素的生物学反应低于正常刺激水平,胰岛素生理作用的发挥在胰岛素信号转导的过程中起着至关重要的作用,其作用减弱或受阻,使得胰岛素作用减弱,将会导致IR形成。AKT是PI3K/Akt胰岛素信号通路中关键蛋白,激活的AKT能促进GLUT4转位,相反可导致胰岛素抵抗,在葡萄糖的跨膜转运中起决定作用[23]。有研究表明,用胰岛素刺激组织,可使PI3K/Akt信号通路激活,进而使GLUT4从细胞内向质膜转位,是胰岛素受体后信号转导通路中的一个核心环节[20]。另外也有研究发现胰岛素抵抗时细胞摄取葡萄糖的量减少,可能是GLUT4葡萄糖转运子的功能丧失等机制导致的[23]。
RBP4基因是脂肪细胞分泌的一种细胞因子[24],具有调节脂代谢及葡萄糖代谢的功能,RBP4与胰岛素的敏感性及胰岛素抵抗及Ⅱ型糖尿病有相关性,但仅限于宏观的相关性研究,具体 RBP4在胰岛刺激及胰岛素抵抗时,对PI3K/Akt胰岛素信号通路相关基因的影响还尚未见系统的研究。因此本实验利用胰岛素短时激活处理和高胰岛素+高糖+dex诱导建立的胰岛素抵抗细胞模型两种处理,研究 RBP4干扰后对PI3K/Akt胰岛素信号通路的影响。
当细胞未进行胰岛素刺激时,PI3K/Akt胰岛素信号通路处于未激活状态,PI3K/Akt基因的表达水平都处于较低的基础状态,在干扰RBP4后对胰岛素相关基因的表达无明显影响。当用胰岛素刺激后,PI3K/Akt胰岛素信号通路相关基因的基础水平都显著上升,且诱导胰岛素抵抗的情况下,PI3K/Akt胰岛素信号通路相关基因的表达与胰岛素刺激相比基因的 mRNA及蛋白表达水平都明显下降了,说明构建的胰岛素抵抗模型成功。实验表明当干扰RBP4后对胰岛素信号相关基因AKT2、PI3K、GLUT4和IRS1的mRNA表达都有极显著的促进作用。这与Nora等在2007年对人体脂肪组织中RBP4的mRNA与GLUT4的 mRNA水平呈负相关的结果相符[25]。当在胰岛素抵抗的条件下,与胰岛素激活的情况相比PI3K/Akt胰岛素信号通路相关基因的表达都有明显下降,RBP4干扰后对这一下降趋势有所缓解。Western blotting分析与实时定量分析结果相似,干扰RBP4后可促进IRS1、PI3K、AKT蛋白的磷酸化。这个结果与 Yang等发现的 RBP4抑制骨骼肌中胰岛素信号传导中PI3K酪氨酸磷酸化和 IRS1酪氨酸磷酸化程度的结论一致[9]。干扰RBP4后,可增加PI3K、AKT、GLUT4蛋白的表达,这与刘慧红等免疫组化的 PI3K与RBP4的含量成反比的研究结果一致[26]。通过比较发现IR组与Con组相比GLUT4蛋白的表达量有略微上升,可能因为GLUT4转运葡萄糖功能的行使受蛋白的表达量和蛋白的转位活性两方面的调控。可能因为胰岛素抵抗模型诱导的时候还是存在胰岛素,初期可少量促进GLUT4的蛋白表达,但是随着诱导的进行GLUT4蛋白的膜转位活性受到了抑制,导致了在胰岛素抵抗的情况下,GLUT4蛋白的表达较对照组稍高。干扰RBP4后对IRS1总蛋白表达的影响不大,可能是因为RBP4只是在IRS1的磷酸化水平的调节方面发挥了作用,对 IRS1的总蛋白表达产生的影响不显著。在2007年Osta等的研究中发现RBP4对IRS1蛋白磷酸化的作用,他们利用免疫共沉淀发现超表达 RBP4抑制了肥胖和Ⅱ型糖尿病胰岛素受体底物1丝氨酸307位点的磷酸化[27]。
总之,RBP4表达的减少上调了PI3K/Akt胰岛素信号通路相关基因的mRNA及蛋白的表达,使葡萄糖转运蛋白 4跨膜转运葡萄糖的能力增强,增加了胰岛素的敏感性,为糖尿病的治疗提供了一种新的思路。
[1]Quadro L, Blaner WS, Salchow DJ, et al. Impaired retinal function and vitamin A availability in mice lacking retinol binding protein. EMBO J, 1999,18(17): 4633−4644.
[2]Gavi S, Stuart LM, Kelly P, et al. Retinol-binding protein 4 is associated with insulin resistance and body fat distribution in nonobese subjects without type 2 diabetes. J Clin Endocrinol Metab, 2007,92(5): 1886−1890.
[3]Graham TE, Yang Q, Bluher M, et al.Retinol-binding protein 4 and insulin resistance in lean, obese, and diabetic subjects. Engl J Med,2006, 354(24): 2552−2563.
[4]Ediwin AMG. The rise of childhood type1 diabetes in the 20thcentury. Diabetes, 2002, 51(12):3353−3361.
[5]Cho YM, Youn BS, Kwak SH, et al. Plasma retinol-binding protein 4 concentrations are elevated in human subjects with impaired glucose tolerance and type 2 diabetes. Diabetes care, 2006,29(11): 2457−2461.
[6]Takebayashi K, Suetsugu M, Wakabayashi S, et al.Retinol-binding protein 4 levels and clinical features of type2 diabetes patients. J Clin Endocrinol Metab, 2007, 92(7): 2712−2719.
[7]Reinehr T, Wagner BS, Christian L, et al.Retinol-binding protein 4 and its relation to insulin resistance in obese children before and after Weight Loss. J Clin Endocrinol Metab, 2008, 93(6):2287−2293.
[8]Kowalska I, Marek SC, Adamska A, et al. Serum retinol-binding protein 4 is related to insulin resistance and nonoxidative glucose metabolism in lean and obese women with normal glucose tolerance. J Clin Endocrinol Metab, 2008, 93(7):2786−2789.
[9]Yang Q, Graham TE, Mody N, et al. Serum retinol-binding protein 4 contributes to insulin resistance in obesity and Type 2 diabetes. Nature,2005, 436: 356−362.
[10]Hammarstedt A, Pihlajamaki J, Graham TE, et al.High circulating levels of RBP4 and mRNA levels of Ap2, PGC-1α and UCP-2 predict improvement in insulin sensitivity following pioglitazone treatment of drug-naive type 2 diabetic subjects. J Intern Med, 2008, 263(4): 440−449.
[11]Gavi S, Qurashi S, Louise M, et al. Influence of age on the association of retinol-binding protein 4 with metabolic syndrome. Obesity, 2008, 16(4):893−895.
[12]Garvey WT, Huecksteadt TP, Lima FB, et al.Expression of a glucose transporter gene cloned from brain in cellular models of insulin resistance:dexamethasone decreases transporter mRNA in primary cultured adipocytes. Mol Endocrinol, 1989,3(7): 1132−1141.
[13]Qi D, An D, Kewalramani G, et al.Dexamethasone-induced insulin resistance altered cardiac fatty acid composition and utilization. Am J Physiol Endocrinol Metab, 2006, 291(2): 420−427.
[14]Sakoda H, Ogihara T, Anai M, et al.Dexamethasone-induced insulin resistance in 3T3-L1 adipocytes is due to inhibition of glucose transport rather than insulin signal transduction.Diabetes, 2000, 49(10): 1700−1708.
[15]Frida R, Jonas B, Maria S, et al. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate 1 protein depletion in human adipocytes. Metabolism, 2007, 56(2):190−198.
[16]Nie J, Ding QL. Effects of high glucose and hyperinsulinism on GLUT4. Medical Recapitulate,2007, 13(11): 826−828 (in Chinese).
聂娟, 丁启龙. 高葡萄糖和高胰岛素对葡萄糖转运子 4影响的研究. 医学综述, 2007, 13(11):826−828.
[17]Craig RL, Chu WS, Elbein SC. Retinol binding protein 4 as a candidate gene for type 2 diabetes and prediabetic intermediate traits. Mol Genet Metab, 2007, 90(3): 338−344.
[18]Sahiel AR, Pessin JE. Signaling pathways in insulin action: molecular target's of insulin resistance. J Clin Invest, 2000, 106(2): 165−169.
[19]Rea S, James DE. Moving GLUT4: the biogenesis and trafficking of GLUT4 storage vesicles.Diabetes, 1997, 46(11): 1667−1677.
[20]Hajduch E, Litherland GJ, Hundal HS. Protein kinase B(PKB/Akt)-a key regulator of glucose transport. FEBS Lett, 2001, 492(3): 199−203.
[21]Dana SR, Brunet A, Greenberg ME. Cellular survival: a play in three Akts. Genes Dev, 1999,13(22): 2905−27.
[22]Cho JY, Park J. Contribution of natural inhibitors to the understanding of the PI3K/PDK1/PKB pathway in the insulin-mediated intracellular signaling cascade. Int J Mol Sci, 2008, 9(11):2217−2230.
[23]Zisman A, Peroni OD, Abel ED, et al. Targeted disruption of the glucose transporter 4 selectively in muscle causes insulin resistance and glucose intolerance. Nat Med, 2000, 6(8): 924−928.
[24]Sandra G, Jon SO, Gregory RS. Adipose tissue as an endocrine organ. Mol Cell Endocrinol, 2010,316(2): 129−139.
[25]Nora K, Graham TE, Janin B, et al. Serum Retinol-binding protein is more highly expressed in visceral than in subcutaneous adipose tissue and is a marker of intra-abdominal fat mass. Cell Metab,2007, 6(2): 79−87.
[26]Liu HH, Liu W, Zhang LJ. Effects of retinol-binding protein on PI3K in somatic muscle tissue of insulin resistant rats. Chinese Foreign Med Res, 2011, 9(18): 11−14 (in Chinese).
刘慧红, 刘伟, 张黎军. 血清视黄醇结合蛋白 4对胰岛素抵抗大鼠骨骼肌组织磷脂酰肌醇3激酶的影响. 中外医学研究, 2011, 9(18): 11−14.
[27]Osta DA, Liden M. Retinol-binding protein 4 attenuates insulin-induced phosphorylation of IRS1 and ERK1/2 in primary human adipocytes. FASEB J, 2007, 21(13): 3696−3704.
October 8, 2012; Accepted: December 20, 2012
Shiduo Sun. Tel/Fax: +86-29-87092120; E-mail: ssdsm@tom.com
国家转基因生物新品种培育重大专项 (No. 2011ZX08006-005),科技部技术推广项目 (No. K332021202),西北农林科技大学创新团队计划资助。
Effects of retinol binding protein 4 knockdown on the PI3K/Akt pathways in porcine adipocytes
Lei Pu, Jia Cheng, Guofang Wu, Hao Yang, Yang Qiu, Zhenyu Zhang, Gongshe Yang,and Shiduo Sun
Laboratory of Animal Fat Deposition and Muscle Development,Northwest A & F University,Yangling712100,Shaanxi,China
Retinol-binding protein 4 (RBP4) is adipocyte-derived secreted adipokines and elevated RBP4 expression level was closely related to insulin resistance and type II diabetes mellitus. However, the exact mechanisms are unknown. To clarify the mechanism, RBP4 lentivirus particles were packaged to infect porcine preadipocytes. Then porcine preadipocytes were activated by insulin or induced model of insulin resistance. RBP4 interference efficiency and the gene expression of each treatment groups in PI3K/Akt pathways were examined by QRT-PCR and Western blotting. The result shows that RBP4 mRNA and protein expressions were suppressed more than 60% (P<0.01). Furthermore, no matter under insulin stimulation or insulin resistance, RBP4 knockdown significantly increased the mRNA expressions ofAKT2,PI3K,GLUT4andIRS1compared with the control. The protein phosphorylate levels of AKT2, PI3K, IRS1 arised, meanwhile enhanced the AKT2, PI3K, GLUT4 total protein expressions. Collectively, knockdown of RBP4 increased the insulin sensitivity through upregulated PI3K/Akt pathways related factors’ expression and phosphorylation in porcine adipocytes.This research will provide a new idea to treat insulin resistance related diseases.
retinol-binding protein 4 (RBP4), lentivirus vectors, preadipocyte, pig, insulin signal pathway
Supported by: National Major Special Project on New Varieties Cultivation for Transgenic Organisms (No. 2011ZX08006-005), MOST Technology Promotion Project (No. K332021202), Program for Innovative Research Team in Northwest A&F University.
(本文责编 陈宏宇)