聚合级L-乳酸的非粮生物质发酵研究进展
于波,曾艳,姜旭,王丽敏,马延和
1 中国科学院微生物研究所,北京 1001012 中国科学院生命科学与生物技术局工业生物技术与产业化处,北京 100864
聚合级L-乳酸的非粮生物质发酵研究进展
于波1,曾艳2,姜旭1,王丽敏1,马延和1
1 中国科学院微生物研究所,北京 100101
2 中国科学院生命科学与生物技术局工业生物技术与产业化处,北京 100864
于波, 曾艳, 姜旭, 等. 聚合级L-乳酸的非粮生物质发酵研究进展. 生物工程学报, 2013, 29(4): 411−421.
乳酸在化工、医药和食品加工等领域有着广泛的用途。随着聚乳酸产业的兴起,对聚合级 L-乳酸的需求量也不断增加。开发低成本的非粮生物质乳酸发酵工艺、实现发酵-分离耦合是降低聚合级L-乳酸成本、摆脱原料价格不断上涨压力的技术趋势。文中简要综述了近2~3年使用非粮生物质发酵生产聚合级L-乳酸的技术进展,并对未来乳酸发酵工艺作了展望。
L-乳酸,非粮生物质,发酵-分离耦合
乳酸是世界三大有机酸之一,其分子具有一个羟基和一个羧基,可用于合成各种化学品。因此,在化工、医药和食品加工等领域有着广泛的用途 (图1)。乳酸具有旋光性,可分为L-乳酸和D-乳酸两种光学异构体。其中L-乳酸在工业上用途广泛,可以脱水生成丙烯酸,酯化生成包括乳酸乙酯在内的各种工业溶剂,还原生成1,2-丙二醇等各种化工原料。L-乳酸最重要、最大宗的工业应用是用于生产可降解聚合物-聚乳酸[1]。随着我们环境保护意识的不断增强,大力开发可生物降解新材料,成为目前世界材料技术发展趋势之一。聚乳酸是生物材料中最大的品种,其生产过程无污染,产品可完全生物降解,实现在自然界中的循环,是理想的绿色高分子材料。目前,全世界塑料产品的年总消费量已超过3亿t,我国为3 500万t以上,如果10~20年后替代石油基聚合物的消费量按10%计,世界聚乳酸需求量每年将达3 000万t以上,具有广阔的发展前景。聚乳酸已被世界视为继金属材料、无机材料、化石基高分子材料之后的“第四类最具广泛应用价值和环保应用价值的新型高分子材料”,在我国已被持续列入“十五”、《食品工业“十一五”纲要》、《国家中长期科技发展计划》和《生物基材料产业科技发展“十二五”专项规划》重点科研攻关项目之一。
作为生产聚乳酸材料关键的单体,聚合级L-乳酸的需求量也在不断攀升。近几年,乳酸在食品和医药等领域的应用比例基本持平甚至有所下降,而在聚合材料的应用比例快速增长,预计2013年的需求比例将超过40%,因此,未来工业对乳酸的需求增长点将从食品级 L-乳酸逐步过渡到聚合级L-乳酸[2]。作为大宗的生物基材料,目前聚乳酸的价格偏高,还无法与石化来源的材料相竞争。乳酸的价格将是决定聚乳酸产业未来是否能与化学基材料相抗衡的关键[3]。同时,作为未来优先发展的 30种生物质来源的重要平台化学品之一 (美国能源部报告-《Top Value Added Chemicals from Biomass》,2004 年 8 月),乳酸的生产成本也将是决定乳酸在其他工业领域应用的重要因素。目前,随着来源于食物作物的淀粉糖的价格不断攀升,乳酸发酵工业的利润逐渐降低。因此,开发其低成本发酵工艺,尤其是采用各种廉价非粮生物质原料来进行发酵生产将是降低乳酸生产成本,促进聚乳酸产业快速发展的重要技术趋势。

图1 乳酸平台化学品及其衍生品Fig. 1 Platform chemicals of lactic acid and its derivatives.
乳酸发酵采用的菌种主要有米根霉Rhizopus oryzae和一些细菌等。米根霉生产L-乳酸的光学纯度较高,因而受到一定的关注[4-5]。然而,米根霉发酵产酸的转化率较低,经济性不够[6]。目前产业上发酵菌种还是细菌类为主,包括乳杆菌和芽胞杆菌等。本文将重点关注近2~3年国际上乳酸发酵研发的最新报告,着重介绍采用廉价的非粮原料,如纤维素原料、木薯、菊芋、花生粕等为发酵基质生产高光学纯 L-乳酸的工艺和乳酸清洁发酵工艺进展,并对未来乳酸发酵工艺作了展望。
1 廉价非粮原料发酵L-乳酸
从经济的角度看,发酵法生产乳酸依赖多方面的因素,而原材料的支出显得尤为重要。用糖类 (葡萄糖、蔗糖、淀粉等) 作为底物生产乳酸成本较高。目前,利用廉价原料发酵生产L-乳酸的研究主要集中在纤维素、木薯、糖蜜、菊芋等。
1.1 纤维素原料
木质纤维素以其大量,可持续和廉价的优势成为一种有前景的底物原料。利用纤维素为原料生产乳酸也受到很多的关注。已经有很多综述文章讨论了乳酸菌以木质纤维素为原料生产乳酸的常规过程,包括:原料预处理,酶解得到发酵用糖,发酵技术和乳酸的分离纯化[7]。本文将简单综述一下 2010年以来利用纤维素生物质发酵乳酸的最新进展情况 (表1)。
凝结芽胞杆菌是近年来报道比较多的,可以利用纤维素资源发酵生产乳酸的菌株。最早报道的高产乳酸的凝结芽胞杆菌Bacilluscoagulans36D1是由美国佛罗里达大学分离获得的一个嗜热乳酸发酵菌,它能够通过磷酸戊糖途径有效利用戊糖,能利用木质纤维素中的糖分。在50 ℃和pH 5.0的条件下,可同步糖化发酵纤维素,能从木糖和葡萄糖中得到高浓度 (150~180 g/L)的乳酸,并且副产物少。在近期的文章报道中,Bacilluscoagulans36D1可以同步糖化发酵结晶纤维素,L-乳酸的发酵浓度达80 g/L,转化率接近80%,显示了该菌在纤维素利用方面的优势[8]。
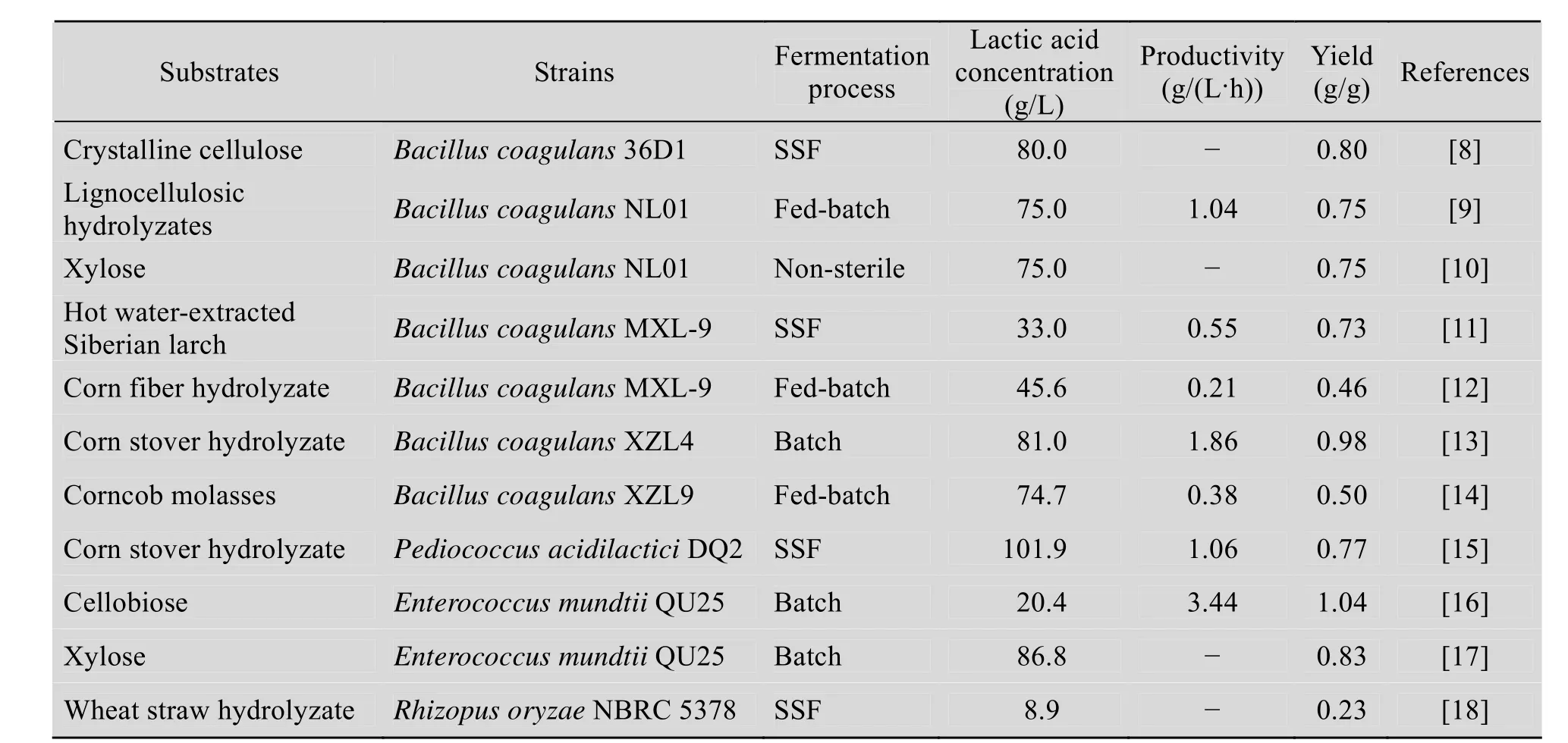
表1 利用纤维生物质资源生产L-乳酸Table 1 Lactic acid production from cellulosic biomass
我国科研工作者报道了一株高效生产 L-乳酸的嗜热芽胞菌BacilluscoagulansNL01。采用非灭菌的开放式发酵工艺条件,以NaOH作为碱性中和剂调酸。分批发酵中,用酶法糖化的含有固体残留物的木质纤维素水解液生产出56.37 g/L的L-乳酸。补料分批发酵中,利用木质纤维素水解液的L-乳酸发酵水平达到75.03 g/L,转化率为74.5%,平均产率为1.04 g/(L·h)[9]。利用该菌株在非灭菌条件下发酵木糖生产乳酸。经过72 h的分批发酵,从100 g/L的木糖中得到了75 g/L的乳酸。通过实验还发现,乙酸和乙酰丙酸被认定为木糖发酵中重要的抑制剂,它们显著地降低乳酸生产率。但是低浓度的甲酸 (<2 g/L)对乳酸生产表现出促进作用[10]。Wang等报道了利用一株嗜热菌BacilluscoagulansXZL9发酵玉米芯糖蜜,该菌株可以同等利用五碳糖和六碳糖,L-乳酸的发酵浓度达到74.7 g/L[14]。Xue等报道了嗜热菌BacilluscoagulansXZL4利用玉米秸秆水解液为碳源和花生粕为廉价氮源发酵生产 L-乳酸。在分批发酵中,乳酸发酵浓度达到81.0 g/L,糖酸转化率达到98%,光学纯度大于99.9% (发酵液中检测不到D-乳酸),发酵水平和转化率均为目前文献报道的最高值[13]。
除凝结芽胞杆菌外,近期也报道了一些其他种属的菌株具有高效利用纤维素发酵产乳酸的例子。Zhao等分离到一株对温度和木质纤维素具有高度耐受性的乳酸生产菌株乳酸片球菌Pediococcus acidilacticiDQ2。该菌能够在玉米秸秆的高固体负荷的条件下同步糖化发酵产高浓度的乳酸。玉米秸秆先用硫酸进行预处理,然后通过生物解毒去除预处理过程中产生的抑制剂。在48 ℃,pH 5.5,近30% (W/W) 的固体负荷条件下,L-乳酸的浓度最大可以达到101.9 g/L,转化率为 77.2%,产率为 1.06 g/(L·h)[15]。Abdel-Rahman等报道了一株能够高效利用葡萄糖和纤维二糖产L-乳酸的菌株肠球菌Enterococcus mundtiiQU25。该菌株能够同时代谢葡萄糖和纤维二糖,且没有明显的碳代谢产物抑制。在最适培养条件下,其高光学纯度的L-乳酸产量随着纤维二糖浓度的增加而增加,这表明Enterococcus mundtiiQU25在以纤维素水解液为原料高效生产乳酸方面有巨大潜力[16]。该菌株还能够有效利用木糖生产L-乳酸。在分批发酵中,L-乳酸的发酵浓度达到87 g/L,转化率为0.84 g/g,并且具有极高的光学纯度 (≥99.9%)[17]。Cui等采用混合培养鼠李糖乳杆菌Lactobacillus rhamnosus和短乳杆菌Lactobacillus brevis来提高纤维素和半纤维素衍生糖 (来源于玉米秸秆) 的利用率从而提高乳酸的产量。在利用碱处理后的玉米秸秆的同步糖化发酵过程中,混合培养发酵菌发酵产乳酸获得了0.70 g/g的转化率,这比单独培养鼠李糖乳杆菌和短乳杆菌的转化率分别高出了18.6%和29.6%[19]。
工程项目质量,由于其影响因素多,波动大、变异大、隐蔽性以及终检局限大等特点,造成工程项目质量管理中往往会不可避免地出现一些问题,工程项目质量管理不是一个单一的短期的过程,而应该是一个长期的系统的过程。施工项目质量控制的系统过程主要分为事前质量控制,事中质量控制和事后质量控制。
Saito等也进行了米根霉的筛选,其希望获得能高效利用纤维素资源生产乳酸的优良米根霉菌株。他们从 56株米根霉中筛选到一株最优菌Rhizopus oryzaeNBRC 5378,该菌株能够利用木糖生产乳酸。通过同步糖化发酵小麦秸秆中的纤维素和半纤维素,但糖酸转化率仅为0.23 g/g[18]。
凝结芽胞杆菌具有嗜热性,可以进行不用灭菌的开放式发酵以显著降低生产成本[20]。同时凝结芽胞杆菌产乳酸的糖酸转化率 (>95%),生产的 L-乳酸光学纯度高 (>99%),与报道的其他菌株相比较,L-乳酸的发酵水平也较高,因此凝结芽胞杆菌更适应于纤维素为底物的高光学纯L-乳酸的发酵生产。但总体上说,在现有的技术水平下,木质纤维素为原料发酵生产乳酸的发酵水平距离工业化还有一定的距离,生产强度也较低,经济性不足。需要进一步的技术研发,就乳酸发酵过程而言,最主要的技术突破是要加强菌株本身对纤维素水解液中抑制发酵成本,如糠醛类化合物的耐受性,从而显著提高发酵强度和发酵水平。
1.2 木薯
木薯(Cassava)是世界三大薯类之一,广泛栽培于热带和亚热带地区。在我国南亚热带地区,木薯是仅次于水稻、甘薯、甘蔗和玉米的第五大作物。它在饲料生产、工业应用等方面具有重要作用,已成为广泛种植的淀粉加工和饲料作物。目前,有少量文章报道利用木薯粉作为唯一碳源发酵生产 L-乳酸的工艺。John等报道了利用木薯渣生产L-乳酸的工艺,采用同步液化糖化发酵工艺,乳酸的发酵水平达到 83.8 g/L, 转化率为0.96 g/g[21]。我国科研工作者报道了一株鼠李糖乳杆菌发酵木薯粉产乳酸,在同步糖化发酵工艺条件下,乳酸的发酵水平超过 175 g/L,转化率0.71 g/g,发酵强度1.8 g/(L·h),这是目前报道的利用木薯粉一步发酵法生产 L-乳酸的最高水平[22]。Phrueksawan等报道了一株米根霉具有利用木薯浆固态发酵生产L-乳酸的能力,在最适条件下,米根霉转化木薯浆成乳酸盐的转化率为0.21 g/g。经过加入纤维素酶和糖化酶处理,释放更多的碳源后,乳酸盐对木薯浆的转化率提高到0.46 g/g[23]。
利用木薯粉为廉价原料发酵乳酸的产业化推进已经走到了前面。全球最大的乳酸生产商PURAC公司已经在泰国建立了基于木薯为原料的L-乳酸发酵生产线 (www.purac.com),这也彰显了木薯在乳酸和其他大宗化学品发酵生产中的广阔应用前景。
1.3 菊芋
菊芋Jerusalem artichoke,俗名洋姜,菊科,向日葵属,多年生草本植物。菊芋原产北美洲,经欧洲传入我国。其土壤适应性强、无病虫害,可以在干旱、盐碱等非耕边际土地种植,是一种典型的非粮生物质资源。现有文献报道多集中在利用菊芋发酵产乙醇或2,3-丁二醇等[24-25]。利用菊芋或菊芋工业废渣为原料生产乳酸,也将是降低乳酸发酵成本的重要途径之一。
我国浙江大学的研究者在纤维床生物反应器 (Fibrous bed bioreactor) 中利用固定化的乳酸乳球菌Lactococcus lactis细胞发酵菊芋水解液生产L-乳酸。首先在95 ℃条件下,酸处理后得到菊芋水解液。进而利用水解液添加酵母粉为氮源发酵生产L-乳酸。在该条件下,固定化细胞比游离细胞都表现出更优异的L-乳酸生产能力。分批补料模式下,最大L-乳酸浓度达142 g/L,随后的纤维素生物反应系统反复分批发酵进一步表现出该系统长期高产L-乳酸的持续性和稳定性。结果表明,纤维床生物反应器系统和菊芋水解液在工业规模下经济生产 L-乳酸具有潜力[26]。中国科学院微生物研究所也开发了菊芋粉发酵生产高光学纯L-乳酸的工艺。利用酶解工艺后的菊芋水解液和廉价的玉米浆粉为发酵基质,采用高温发酵工艺,L-乳酸的发酵水平达到 134 g/L,转化率达到了0.96 g/g总还原糖,光学纯度也达到了99%以上。该工艺采用常规发酵工艺,更有利于直接用于现有乳酸工业生产线,具有较好的应用前景[27]。
1.4 其他廉价非粮原料发酵生产L-乳酸
除了应用纤维素生物质资源、木薯粉及菊芋粉等目前研究比较多的廉价非粮原料发酵乳酸外,近期部分文献也介绍利用其他工业废弃物发酵生产L-乳酸。
1.4.1 其他廉价碳源发酵
从稻米洗涤排水池中分离得到一株产乳酸菌Lactobacillus rhamnosusM-23,它能够利用未经灭菌的稻米洗涤污水和米糠同步糖化发酵生产L-乳酸,且无需添加其他营养物质。其最大乳酸产量达59 g/L,产率为1.23 g/(L·h),产品光学纯度达95%,转化率达到了0.85 g/g[28]。Secchi等报道了利用生产乳清干酪后的副产品生产L-乳酸。乳清干酪的副产品含有大量的乳糖,因而是一种环境污染物。为了评估将乳清干酪副产品生物转化成乳酸是否为一种可行的处理办法,并且提供额外附加值,Secchi等研究了干酪乳杆菌Lactobacillus casei、瑞士乳杆菌Lactobacillus helveticus和嗜热链球菌Streptococcus thermophilus利用乳清干酪副产品发酵生产L-乳酸的可能性。结果表明,乳清干酪副产品能被用来生产乳酸,且转化率达92%。进一步通过添加营养剂显著提高了乳酸菌的发酵性能,乳酸的产率达2 g/(L·h)。并且与纯培养相比,混合培养能够降低营养补充剂的用量,利用干酪乳杆菌和嗜热链球菌混合培养,得到了光学纯度达99%的L-乳酸[29]。
水网藻Hydrodictyon reticulatum含有47.5%的还原糖,包括35%的葡萄糖。因此,它可被作为生产L-乳酸的乳酸菌的底物。韩国学者分离获得的一株副干酪乳杆菌Lactobacillus paracaseiLA104,该菌株利用水网藻为发酵基质,采用同步糖化发酵生产L-乳酸,其转化率达46 g乳酸/100 g干水网藻,乳酸终浓度为37 g/L,产率为1.03 g/(L·h)[30]。
1.4.2 廉价氮源发酵
氮源最主要的功能是构成微生物细胞和含氮的代谢产物。乳酸细菌对营养物质要求较高,酵母粉含有丰富的氨基酸、维生素和微量元素,是目前在乳酸发酵研究中应用最为广泛的氮源。但是酵母粉的成本较高,寻找合适的酵母粉替代物是研究的热点[31]。在乙醇工业中会产生大量的乙醇发酵废液,乙醇发酵废液是啤酒酵母发酵经济作物后的废弃物,其中含有大量的可溶性蛋白和氨基酸等发酵原料,具有作为一种替代酵母抽提物的潜力。利用Lactobacillus paracasei为发酵菌种,通过优化发酵温度、pH值和乙醇发酵液的自溶时间,最终乳酸浓度、全部乳酸产量和乳酸转化率比使用的酵母抽提物发酵分别提高了17%、41%和 14%[32]。Djukić-Vuković等研究了利用酒糟平行生产乳酸和菌体生物量的可能性。在分批发酵中,初始糖浓度为55 g/L,其最高乳酸转化率和产率分别为92.3%和1.49 g/(L·h)。进一步采用分批补料发酵,乳酸产量明显提高。且发酵液中的Lactobacillus rhamnosusATCC7469活细胞数达109CFU/mL,可作为一种富含生物量的生物饲料,提高了利用酒糟发酵乳酸的经济性[33]。最近报道的一株Bacillus subtilisMUR1能分别在12 h和52 h内生产99.3 g/L和183.2 g/L的 L-乳酸,且底物转化率达 98.5%,其最大的L-乳酸产率为 16.1 g/(L·h),并且该菌生产 L-乳酸的培养基可用玉米浆部分替代酵母抽提物[34]。乳杆菌Lactobacillussp. B2能利用蔗糖浆为碳源,发酵螃蟹废弃物为氮源,实现了几丁质和L-乳酸的联产。在生产几丁质的同时,发酵获得了19.5 g/L的乳酸 (转化率为77%)[35]。
2 乳酸发酵-膜分离耦合新工艺
传统发酵生产乳酸过程中为了降低乳酸对菌株的抑制,普遍采用钙盐调酸技术,即添加CaCO3或Ca(OH)2将发酵产生的乳酸转变为乳酸钙,进而通过硫酸置换纯化技术获得L-乳酸。钙盐法提取工艺流程长、污染大,产生大量的CaSO4残渣,且产品质量差,难以满足聚乳酸生产的原料要求。另一方面,发酵过程中加碱生成的乳酸盐仍然对细胞代谢有抑制作用,其现象是产物乳酸浓度和细胞产乳酸速度成反比,随着乳酸盐浓度的升高,对细胞的生理活性的抑制也在不断加剧,以致细胞最后停止生长。如果能开发一个新的工艺,将反应与分离进行耦合,可以原位移走目标产物,有效减少产物的反馈抑制,实现边发酵、边分离,提高发酵产率。基于以上原因,发酵和分离耦合的新型连续发酵工艺则成为了国内外研究的热点[36]。
膜分离技术具有分离效率高、操作条件温和、分离介质无毒、没有二次污染、工艺放大可靠等优点。Freidman和Gaden于1970年最先报道了发酵-透析耦合连续生产乳酸的研究,结果发现利用葡萄糖为底物,乳酸发酵产率可在传统批次式的一般不超过 3.0 g/(L·h)的基础上提高 60%[37]。早期采用的透析技术因分离效率不高,对乳酸耦合发酵水平的提高程度有限。上世纪 80年代以来,随着错流式膜分离技术的不断发展与成熟,针对乳酸发酵-错流式膜分离耦合过程的研究日益增多。乳酸发酵产率得到了大幅提高,最高已能达到22.0 g/(L·h),显示了膜分离技术与发酵耦合生产乳酸的应用前景[38]。近期,Wang等开发了一种双极膜分离工艺来探讨了乳酸发酵和电渗析分离相结合的兼容性。将发酵过的乳酸盐混合物流经双极膜进行电渗析,并对其影响乳酸产量和碱液的动态电流密度进行了研究和条件优化。最后,进行了乳酸发酵和双极膜电渗析分离耦合实验,并达到了 86%的乳酸回收率[39]。
Bailly等建立了一个完整的全膜乳酸生产工艺,采用两步电渗析法纯化乳酸。发酵液首先利用微滤膜澄清,去除菌体及大分子蛋白质。由于发酵液采用的钙盐调酸工艺,发酵液的二价金属离子,在双极膜操作过程中易造成膜的污染,所以发酵液再次经过纳滤工艺去除二价金属离子。澄清的发酵液经过第一步电渗析浓缩后,再经过双极膜的二次电渗析转化为乳酸和相应的碱,碱返回发酵罐再次作为中和剂使用[40]。虽然Habova等进一步证明此两步电渗析法生产乳酸的过程环境友好[41],但是该工艺需要经过多次膜分离,增加了膜污染的步骤,进而增加了膜分离的成本,并且此过程无法实现发酵分离耦合。如果从乳酸发酵工艺入手,使用一价离子碱调酸,可以避免二价金属离子对膜的污染。然而,钠等一价金属离子对乳酸发酵菌株的毒性较大,显著抑制了乳酸发酵强度和发酵水平。因此,开发新的乳酸发酵菌种,例如可以使用钠盐或铵盐发酵的菌株,配合膜分离耦合工艺,可以显著提高膜分离的经济性。Qin等通过离子束诱变提高了一株芽胞杆菌的钠盐耐受能力,诱变后的菌株Bacillussp. Na-2在使用NaOH调酸工艺条件下,L-乳酸发酵水平超过100 g/L[42]。
3 钠盐调酸条件下的L-乳酸发酵新工艺
利用 NaOH代替 CaCO3作为乳酸发酵的中和剂,可以解决目前“钙盐法”乳酸发酵传统工艺对环境的污染问题。自然界中存在大量的嗜极微生物,能够耐受类似于工业加工条件下的各种极端环境,其中嗜碱微生物由于具有良好的耐受一价金属离子的能力,或许可以成为乳酸等有机酸发酵的优良宿主,而逐步获得了科研工作者的重视[43]。嗜碱菌是一类最适生长pH在8.0以上(通常在9.0~10.0之间) 的微生物。很多嗜碱菌同时也是嗜盐菌[44]。使用嗜碱菌进行乳酸发酵具有很多的优势。一方面在嗜碱乳酸菌的发酵过程中,可以利用 NaOH代替 CaCO3作为中和剂来维持发酵过程中pH的稳定,中和形成的乳酸钠可以使用双极性膜电渗析法进行乳酸的提取和分离,避免了传统发酵工艺中CaSO4固体废料的产生,从而降低污染,保护环境,而提取乳酸后产生的NaOH可以作为中和剂循环使用,降低成本。另一方面由于中和剂和乳酸的反应,乳酸发酵液中含有高浓度的盐离子,而嗜碱乳酸菌相对中性乳酸菌来讲具有嗜盐或者耐盐的性质,有利于嗜碱微生物的生长,可以在一定程度上提高乳酸发酵的产量。此外,嗜碱菌对高pH值的适应性还可以避免杂菌污染[43]。
目前,对嗜碱菌株作为乳酸发酵生产菌的报道较少。日本学者Calabia等首先报道了一株生产乳酸的嗜碱微生物嗜盐乳杆菌Halolactibacillus halophilus。该菌株可以利用蔗糖和葡萄糖为底物发酵产乳酸。其中利用蔗糖为底物,L-乳酸的终浓度为65.8 g/L,糖酸转化率为83%,光学纯度为98.8%;在以葡萄糖为底物时,L-乳酸的终浓度为59.6 g/L,糖酸转化率为76%,光学纯度为98.3%。该菌株的底物耐受性欠佳,当蔗糖或葡萄糖的底物浓度提高到100 g/L时,乳酸的终产量分别下降到28.2 g/L和34.5 g/L[45]。中国科学院微生物所极端微生物研究组新分离获得了一株嗜碱菌芽孢杆菌Bacillussp. WL-S20,该菌株可以利用葡萄糖和廉价氮源花生粕高效发酵生产 L-乳酸,并且发酵液中 L-乳酸的光学纯接近100% (检测不到D-乳酸)。经过发酵优化后,单次补料分批发酵,L-乳酸的终浓度达到180 g/L,糖酸转化率为98.6%。多次脉冲分批补料发酵,L-乳酸的最高浓度可达 225 g/L,糖酸转化率为99.3%[46]。嗜碱菌Bacillussp. WL-S20的L-乳酸发酵能力超过了很多非极端菌的发酵水平,丰富了 L-乳酸发酵菌株资源,为开展新型的乳酸发酵-分离耦合工艺发酵工艺提供了新思路。
4 未来乳酸发酵技术展望
乳酸也是一种多用途的绿色平台化合物。乳酸、乳酸盐及其衍生物已被广泛应用于食品、医药、化工、制革、环保、酿造及纺织等工业领域,乳酸及其衍生物的需求量逐年递增。随着葡萄糖等原料成本的不断上涨,乳酸的生产成本也在不断的增加,已经严重影响了乳酸发酵行业的利润率。如何在价格不断上涨的原料成本压力下实现乳酸的低成本生物制造是摆在乳酸产业面前的一个非常严峻的问题。通过经济-技术性分析,未来的乳酸发酵工业可能要实现连续厌氧发酵,工业发酵水平要超过180 g/L,转化率超过95%,发酵强度要达到20 g/(L·h)[47]。目前,现报道的菌株对廉价非粮生物质的利用效率不高,还需要通过进一步的菌株改造,优化底物利用速率和效率,以及通过生理工程改造提高菌株的工业适应性等[48]。随着技术的不断进步,我们完全可以实现工业发酵生产线上的乳酸发酵水平超过180 g/L,转化率超过 95%的指标。但是,乳酸的发酵是典型的产物抑制型发酵,高浓度的乳酸(盐) 会显著影响菌体的生长和产酸效率。实现20 g/(L·h) 的高强度发酵对乳酸发酵菌种生理适应性是一个重大的挑战,虽然合成生物学的发展使显著提高菌株的工业适应能力成为了可能[49],但是要达到如此高强度的发酵速率,单纯靠菌株本身的改造是难以实现的,需要结合过程工艺的优化。同时,为了提高乳酸发酵的经济性,开展连续厌氧发酵工艺是趋势,而基于膜分离技术的发酵-分离耦合工艺,可以实现乳酸的连续厌氧发酵和低成本分离。通过开发适用于钠盐调酸工艺的新菌种,结合低污染的动态旋转膜分离工艺,实现乳酸发酵-分离耦合,可以降低对乳酸发酵菌株的抑制,显著提高发酵强度和转化率,这将是乳酸和其他大宗有机酸实现高强度、低成本发酵的一个技术方向。
[1]Gao C, Ma C, Xu P. Biotechnological routes based on lactic acid production from biomass. Biotechnol Adv, 2011, 29(6): 930−939.
[2]Jong ED, Higson A, Walsh P, et al. Bio-based chemicals: value added products from biorefineries[EB/OL]. [2013-1-4]. http://www.ieabioenergy.com/LibItem.aspx?id=7311.
[3]Okano K, Tanaka T, Ogino C, et al.Biotechnological production of enantiometric pure lactic acid from renewable resources: recent achievements, perspectives, and limits. Appl Microbiol Biotechnol, 2010, 85(3): 413−423.
[4]Wu X, Jiang S, Liu M, et al. Production of L-lactic acid byRhizopus oryzaeusing semicontinuous fermentation in bioreactor. J Ind Microbiol Biotechnol, 2011, 38(4): 565−571.
[5]Chotisubha-anandha N, Thitiprasert S, Tolieng V,et al. Improved oxygen transfer and increased L-lactic acid production by morphology control ofRhizopus oryzaein a static bed bioreactor.Bioprocess Biosyst Eng, 2011, 34(2): 163−172.
[6]Thitiprasert S, Sooksai S, Thongchul N.In vivoregulation of alcohol dehydrogenase and lactate dehydrogenase inRhizopus oryzaeto improve L-lactic acid fermentation. Appl Biochem Biotechnol, 2011, 164(8): 1305−1322.
[7]Abdel-Rahman MA, Tashiro Y, Sonomoto K.Lactic acid production from lignocellulose-derived sugars using lactic acid bacteria: overview and limits. J Biotechnol, 2010, 156(4): 286−301.
[8]Ou MS, Ingram LO, Shanmugam KT. L: (+)-Lactic acid production from non-food carbohydrates by thermotolerantBacillus coagulans. J Ind Microbiol Biotechnol, 2011, 38(5): 599−605.
[9]Ouyang J, Ma R, Zheng Z, et al. Open fermentative production of L-lactic acid byBacillussp. strain NL01 using lignocellulosic hydrolyzates as low-cost raw material. Bioresour Technol, 2012,doi: 10.1016/j.biortech.2012.09.096 [Epub ahead of print].
[10]Ouyang J, Cai C, Chen H, et al. Efficient non-sterilized fermentation of biomass-derived xylose to lactic acid by a thermotolerantBacillus coagulansNL01. Appl Biochem Biotechnol, 2012,168(8): 2387−2397.
[11]Walton SL, Bischoff KM, van Heiningen AR, et al.Production of lactic acid from hemicellulose extracts byBacillus coagulansMXL-9. J Ind Microbiol Biotechnol, 2010, 37(8): 823−830.
[12]Bischoff KM, Liu S, Hughes SR, et al.Fermentation of corn fiber hydrolysate to lactic acid by the moderate thermophileBacillus coagulans. Biotechnol Lett, 2010, 32(6): 823−828.
[13]Xue ZW, Wang LM, Ju JS, et al. Efficient production of polymer-grade L-lactic acid from corn stover hydrolyzate by thermophilicBacillussp. strain XZL4. SpringPlus, 2012, 1: 43.
[14]Wang L, Zhao B, Liu B, et al. Efficient production of L-lactic acid from corncob molasses, a waste by-product in xylitol production, by a newly isolated xylose utilizingBacillussp. strain.Bioresour Technol, 2010, 101(20): 7908−7915.
[15]Zhao K, Qiao Q, Chu D, et al. Simultaneous saccharification and high titer lactic acid fermentation of corn stover using a newly isolated lactic acid bacteriumPediococcus acidilacticiDQ2. Bioresour Technol, 2012, doi: 10.1016/j.biortech.2012.09.063 [Epub ahead of print]
[16]Abdel-Rahman MA, Tashiro Y, Zendo T, et al.Isolation and characterisation of lactic acid bacterium for effective fermentation of cellobiose into optically pure homo L-(+)-lactic acid. Appl Microbiol Biotechnol, 2011, 89(4): 1039−1049.
[17]Abdel-Rahman MA, Tashiro Y, Zendo T, et al.Efficient homofermentative L-(+)-lactic acid production from xylose by a novel lactic acid bacterium,Enterococcus mundtiiQU 25. Appl Environ Microbiol, 2011, 77(5): 1892−1895.
[18]Saito K, Hasa Y, Abe H. Production of lactic acid from xylose and wheat straw byRhizopus oryzae. J Biosci Bioeng, 2012, 114(2): 166−169.
[19]Cui F, Li Y, Wan C. Lactic acid production from corn stover using mixed cultures ofLactobacillus rhamnosusandLactobacillus brevis. Bioresour Technol, 2011, 102(2): 1831−1836.
[20]Qin JY, Zhao B, Wang XW, et al. Non-sterilized fermentative production of polymer-grade L-lactic acid by a newly isolated thermophilic strainBacillussp. 2-6. PLoS One, 2009, 4(2): e4359.
[21]John RP, Nampoothiri KM, Pandey A,Simultaneous saccharification and fermentation of cassava bagasse for L-(+)-lactic acid production usingLactobacilli. Appl Biochem Biotechnol,2006, 134(3): 263−272.
[22]Wang LM, Zhao B, Liu B, et al. Efficient production of L-lactic acid from cassava powder byLactobacillus rhamnosus. Bioresour Technol, 2010,101(20): 7895−7901.
[23]Phrueksawan P, Kulpreecha S, Sooksai S, et al.Direct fermentation of L(+)-lactic acid from cassava pulp by solid state culture ofRhizopus oryzae. Bioprocess Biosyst Eng, 2012, 35(8):1429−1436.
[24]Hu N, Yuan B, Suan J, et al. ThermotolerantKluyveromyces marxianusandSaccharomyces cerevisiaestrains representing potentials for bioethanol production fromJerusalem artichokeby consolidated bioprocessing. Appl Microbiol Biotechnol, 2012, 95(5): 1359−1368.
[25]Li, D., Dai, J.Y., Xiu, Z.L. A novel strategy for integrated utilization ofJerusalem artichokestalk and tuber for production of 2,3-butanediol byKlebsiella pneumoniae. Bioresour Technol, 2010,101(21): 8342−8347.
[26]Shi Z, Wei P, Zhu X, et al. Efficient production of l-lactic acid from hydrolysate ofJerusalem artichokewith immobilized cells ofLactococcus lactisin fibrous bed bioreactors. Enzyme Microbial Technol, 2012, 51(5): 263−268.
[27]Wang LM, Xue ZW, Zhao B, et al.Jerusalem artichokepowder: a useful material in producing high-optical-purity L-lactate using an efficient sugar-utilizing thermophilicBacillus coagulansstrain. Bioresour Technol, 2013, 130: 174−180.
[28]Watanabe M, Makino M, Kaku N, et al.Fermentative L-(+)-lactic acid production from non-sterilized rice washing drainage containing rice bran by a newly isolated lactic acid bacteria without any additions of nutrients. J Biosci Bioeng,2013, 115(4): 449−452.
[29]Secchi N, Giunta D, Pretti L, et al. Bioconversion of ovine scotta into lactic acid with pure and mixed cultures of lactic acid bacteria. J Ind Microbiol Biotechnol, 2012, 39(1): 175−181.
[30]Nguyen CM, Kim JS, Hwang HJ, et al. Production of L-lactic acid from a green microalga,Hydrodictyon reticulum, byLactobacillus paracaseiLA104 isolated from the traditional Korean food, makgeolli. Bioresour Technol, 2012,110: 552−559.
[31]Wang LM, Li FS, Zhao B, et al. Highly efficient production of D-lactate bySporolactobacillussp.CASD with simultaneous enzymatic hydrolysis of peanut meal. Appl Microbiol Biotechnol, 2011,89(4): 1009−1017.
[32]Moon SK, Lee J, Song H, et al. Characterization of ethanol fermentation waste and its application to lactic acid production byLactobacillus paracasei.Bioprocess Biosyst Eng, 2012, doi:10.1007/s00449-012-0810-5 [Epub ahead of print]
[33]Djukić-Vuković AP, Mojović LV, Vukašinović-Sekulić MS, et al. Integrated production of lactic acid and biomass on distillery stillage. Bioprocess Biosyst Eng, 2012, doi 10.1007/s00449-012-0842-x[Epub ahead of print]
[34]Gao T, Wong Y, Ng C, et al. L-lactic acid production byBacillus subtilisMUR1. Bioresour Technol, 2012, 121: 105−110.
[35]Flores-Albino B, Arias L, Gómez J, et al. Chitin and L(+)-lactic acid production from crab(Callinectes bellicosus) wastes by fermentation ofLactobacillussp. B2 using sugar cane molasses as carbon source. Bioprocess Biosyst Eng, 2012,35(7): 1193−1200.
[36]Madzingaidzo L, Danner H, Braun R. Process development and optimization of lactic acid purification using electrodialysis. J. Biotechnol,2002, 96(3): 223−239.
[37]Freidman MR and Gaden jr EL. Growth and lactic acid production byL. delbrueckiiin a dialysis culture system. Biotechnol Bioeng, 1970, 12(6):961−974.
[38]Boyaval P, Corre C, Terre S. Continuous lactic acid fermentation with concentrated product recovery by ultrafiltration and electrodialysis. Biotechnol Lett,1987, 9(3): 207−212.
[39]Wang X, Wang Y, Zhang X, et al. In situ combination of fermentation and electrodialysis with bipolar membranes for the production of lactic acid: operational compatibility and uniformity.Bioresour Technol, 2012, 125: 165−171.
[40]Bailly M, Balmann HR, Aimar P, et al. Production process of fermented organic acids targeted around membrane operations: design of the concentration step by conventional electrodialysis. J Membrane Sci, 2001, 191(1-2): 129−142.
[41]Habova V, Melzoch K, Rychtera M, et al.Electrodialysis as s useful technique for lactic acid separation from a model solution and a fermentation broth. Desalination, 2004, 162(10):361−372.
[42]Qin JY, Wang XW, Zheng ZJ, et al. Production of L-lactic acid by a thermophilicBacillusmutant using sodium hydroxide as neutralizing agent.Bioresour Technol, 2010, 101(19): 7570−7576.
[43]Sarethy IP, Saxena Y, Kapoor A, et al. Alkaliphilic bacteria: applications in industrial biotechnology. J Ind Microbiol Biotechnol, 2011, 38(7): 769−790.
[44]Horikoshi K. Alkaliphiles: some applications of their products for biotechnology. Microbiol Mol Biol Rev, 1999, 63(4): 735−750.
[45]Calabia BP, Tokiwa Y, Aiba S. Fermentative production of L-(+)-lactic acid by an alkaliphilic marine microorganism. Biotechnol Lett, 2011,33(7): 1429−1433.
[46]Meng Y, Xue YF, Yu B, et al. Efficient production of L-lactic acid with high optical purity by alkaliphilicBacillussp. WL-S20. Bioresour Technol, 2012, 116: 334−339.
[47]Hermann BG, Patel M. Today’s and tomorrow’s bio-based bulk chemicals from white biotechnology: a techno-economic analysis. Appl Biochem Biotechnol, 2007, 136(3): 361−388.
[48]Zhang YP, Li Y. Engineering the antioxidative properties of lactic acid bacteria for improving its robustness. Curr Opin Biotechnol, 2013, 24(2):142−147.
[49]Zhu LJ, Zhu Y, Zhang YP, et al. Engineering the robustness of industrial microbes through synthetic biology. Trends Microbiol, 2012, 20(2): 94−101.
January 11, 2013; Accepted: January 23, 2013
Bo Yu. Tel: +86-10-62555203; E-mail: yub@im.ac.cn
Trends in polymer-grade L-lactic acid fermentation by non-food biomass
Bo Yu1, Yan Zeng2, Xu Jiang1, Limin Wang1, and Yanhe Ma1
1Institute of Microbiology,Chinese Academy of Sciences,Beijing100101,China
2Division of Industrial Bio-Tech Research and Development,Bureau of Life Science and Biotechnology,Chinese Academy of Sciences,Beijing100864,China
Lactic acid has a wide range of uses in the chemical, pharmaceutical and food industry. With rapid development of poly (lactic acid) industry, the demand for polymer-grade L-lactic acid is continuously increasing.Developing low-cost, non-food-biomass-lactic-acid fermentation process and the fermentation-separation coupled technology are trends to reduce polymer-grade L-lactic acid production cost. This review summarized the most recent advances in low-cost L-lactic acid fermentation based on the use of non-food biomass, followed by addressing the key issue that might be strategically important for future development of polymer-grade L-lactic acid production in industry.
L-lactic acid, non-food biomass, fermentation-separation coupled technology
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2011AA02A202).
国家高技术研究发展计划 (863计划) (No. 2011AA02A202) 资助。
时间:2013-03-13 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20130313.1519.002.html
(本文责编 陈宏宇)