气相色谱-质谱联用技术及其在代谢组学中的应用
李娟,任路静,孙冠男,黄和
南京工业大学生物与制药工程学院,江苏 南京 210009
气相色谱-质谱联用技术及其在代谢组学中的应用
李娟,任路静,孙冠男,黄和
南京工业大学生物与制药工程学院,江苏 南京 210009
李娟, 任路静, 孙冠男, 等. 气相色谱-质谱联用技术及其在代谢组学中的应用. 生物工程学报, 2013, 29(4): 434−446.
Li J, Ren LJ, Sun GN, et al. Gas chromatography-mass spectrometry (GC-MS) and its application in metabonomics. Chin J Biotech, 2013, 29(4): 434−446.
代谢组学是以高通量、高灵敏度、高分辨率的现代仪器分析方法为手段,对细胞、体液、组织中所有代谢物进行无偏向的定性与定量分析的一门学科。气相色谱-质谱联用技术具有较高的检测灵敏度和鉴定准确度,通过标准谱图库的比对可对代谢物进行快速的鉴定,因此被广泛应用于生物样品的代谢产物的检测中。文中对近年来气相色谱-质谱联用技术的发展以及在代谢组学研究中取得的成果进行了综述。首先介绍了气相色谱-质谱联用技术的分类和常用的样品衍生化方法;继而从样品预处理、定性与定量分析、数据分析三方面介绍了气相色谱-质谱联用技术分析代谢物的方法,并系统地对该技术在微生物、植物、疾病诊断领域的应用实例进行了评述;最后提出了当前气相色谱-质谱联用技术在代谢组学研究中存在的问题并对后续的研究进行了展望。
气相色谱-质谱联用,代谢组学,微生物,衍生化
代谢组学是继基因组学、转录组学和蛋白质组学之后迅速发展起来的一门新兴学科,它以高通量、高灵敏度、高分辨率的现代仪器分析方法为手段,结合模式识别等化学计量学方法,考察生物体系 (细胞、组织或生物体) 受刺激或扰动后 (如将某个特定的基因变异或环境变化后),其代谢产物的变化或其随时间的变化规律[1]。所谓代谢组是基因组的下游产物也是最终产物,是一些参与生物体新陈代谢、维持生物体正常功能和生长发育的小分子化合物的集合。
通常,代谢组学研究的对象并非某些特定的物质,而是要尽可能多地获取所有代谢产物的信息。而分析对象的大小、数量、官能团、挥发性、带电性、电迁移率等物理化学参数的差异对分析结果影响极大[2]。现有的主要检测手段包括:核磁共振技术 (NMR)、液相色谱质谱联用技术(LC-MS)、毛细管电泳质谱联用技术 (CE-MS)以及气相色谱质谱联用技术 (GC-MS)。其中与CE-MS、LC-MS或LC-NMR等分析仪器相比,GC-MS仪器中经气相色谱柱分离后的样品呈气态,流动相也是气体,与质谱的进样要求相匹配,最容易将这两种仪器联用;它具有灵敏度高、分离效率高、易用、耐用、成本低、可选择性地分离和检测大量痕量代谢物质和同质异构体等优点。由于其高标准化地应用了电子电离,能产生广泛的和高重复性的破裂片段,即使得到的质谱数据在数据库中不存在,其破碎模式亦可用于获得更多关于代谢产物定性或化合物种类的信息[3]。故 GC-MS已成为代谢组学中广泛应用的重要分析方法,目前发展也较为成熟,是复杂混合物分析的主要定性和定量手段之一。
1 GC-MS联用技术介绍
1.1 GC-MS联用技术分类
按照质谱技术,GC-MS联用技术通常有气相色谱-四级杆质谱或磁质谱 (GC-MS)、气相色谱-离子阱质谱 (GC-ITMS)、气相色谱-飞行时间质谱 (GC-TOFMS)。四级杆质谱仪扫描方式又有全扫描和选择离子扫描 (SIM) 之分,全扫描是对指定质量范围内的离子全部扫描并记录,得到的质谱图可以提供未知物的分子质量和结构信息。而SIM方式仅对选定的离子进行检测,可消除样品中其他组分造成的干扰,检测灵敏度、选择性极强,主要用于对具有某种特性的代谢物进行定量分析[4]。TOFMS提供了更快的扫描率和额外的敏感性,采集到的每一个数据点都对应一个完整的质谱图,检测挥发性化合物的能力比四级杆质谱强,在目前代谢组学的研究中应用最为普遍[5]。ITMS结构小巧,能在极低压强下长时间储存离子,因此对真空泵的要求降低,从而减轻质谱仪重量和电源消耗,更加便于小型化设计,故其应用也越来越广泛[6-7]。
1.2 GC-MS中的衍生化方法
GC-MS一般用于测定包括氨基酸、胺、脂肪酸、有机酸、糖、糖胺、糖磷酸、嘌呤、嘧啶和芳香族化合物在内的代谢物,其检测限一般为信噪比 (S/N)=3∶1时的浓度。但这些代谢物的极性强、挥发性低,往往不能直接进样分析,需要将这些物质进行适当的化学处理转化成相应的挥发性衍生物,才能适用气相色谱的测定范围,衍生化的过程同时能改善结构及其近似化合物分离的选择性,克服载体、柱壁对高极性、低挥发性样品的吸附,从而有效改善样品的峰形,此外选择特殊的衍生化方法还可用来拆分某些较难分离的手性化合物[8]。
在GC-MS检测中选用衍生化试剂需注意衍生化产物的质谱特性,即质量碎片的特征性强,同时分子量要适中,既适合质量型检测器检测,也有利于与基质干扰物分离。常用的衍生化试剂分为硅烷化、酰化和烷基化三类,其反应原理及优缺点见表1,其中应用最广泛的是硅烷化试剂和酰化试剂。
2 GC-MS分析代谢物的研究方法
自1957年实现GC-MS联用以来,该技术得到了迅速发展。由于其能够提供较高的分辨率和检测灵敏度,并且有可供参考、比较的标准谱图库,可方便地得到待分析代谢物的定性结果。它在生命科学中的应用,使我们能在基因组学、转录组学和蛋白质组学的基础上更好地描述和评估生命系统。
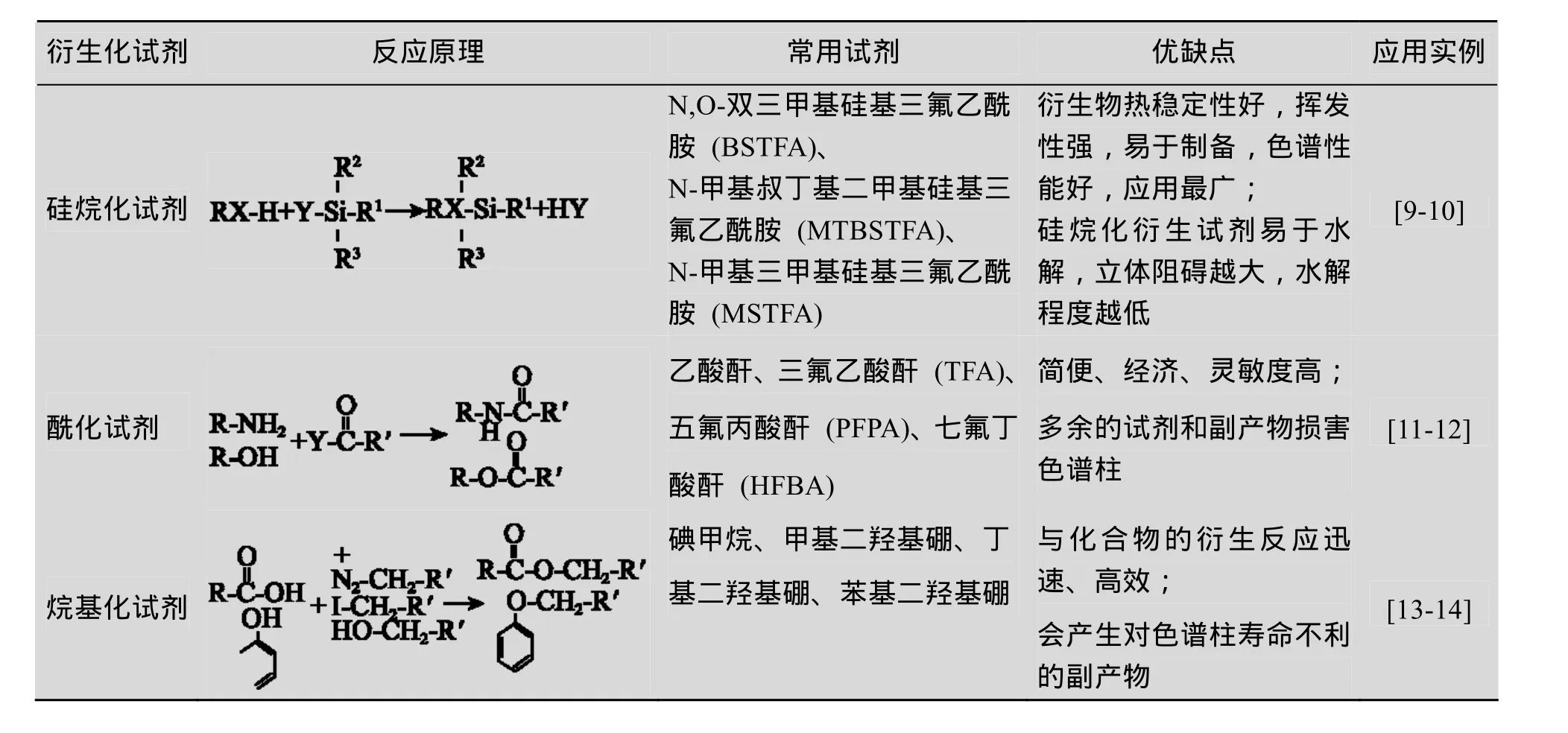
表1 GC-MS的衍生化方法的比较Table 1 Comparison on different derivative methods of GC-MS
由于GC-MS分析的变异性取决于以下三个方面:1) 分析方法(色谱、检测和衍生化样品的稳定性);2) 样品制备(淬灭、提取和浓缩);3) 样品的变异性。因此,为保证分析方法的线性、准确性、灵敏度及稳定性,应根据研究对象、目的和分析化合物的不同,对预处理过程及分析方法进行全面的评估与优化,以确定利用GC-MS进行代谢物分析的最佳方法。Zhang等在利用GC-TOFMS对高血脂老鼠的尿液进行代谢组学分析时,从分离鉴定出的代谢物中,选取有机酸、氨基酸、碳水化合物等代表性物质进行方法验证,以保证定量分析的准确性[15-16]。
2.1 样品预处理技术
利用GC-MS分析生物体内的代谢物,需要对样品进行预处理及衍生化,预处理过程主要包括代谢淬灭、细胞浓缩、代谢物提取等。为获取微生物具有代表性的样品,分析时样品的代谢组成分必须保证与取样时一致,才能反映样品当时的代谢活动,因此这一反映特定生理状态的代谢状态必须要被“固定”住,直到分析完成,该过程称为淬灭。由于不同微生物细胞壁的结构不同,对渗透压的耐受程度以及膜通透性也存在差异,因此代谢淬灭所选择的方法也无法统一。目前报道的淬灭方法中,冷甲醇淬灭方法温和,且可通过离心富集细胞,在多种微生物代谢物检测中广泛应用,但不同的菌株所采用的甲醇浓度差异较大 (表2)。
离心后的沉淀物中不但包含菌体和细胞内液,还混有细胞间液。这些细胞间液包含了培养基成分及细胞外代谢产物,若沉淀物经过提取后细胞内/外液无法区别,将影响对胞内代谢物的准确检测。故提取前仔细洗涤菌体沉淀将有助于排除混有细胞间液所产生的干扰,但是缺点是容易使一些自由出入细胞膜的组分 (如小分子有机酸) 浓度降低并容易导致细胞破碎。因此,在细胞浓缩过程中既要做到除去细胞间液也要减少胞内代谢物的损失。
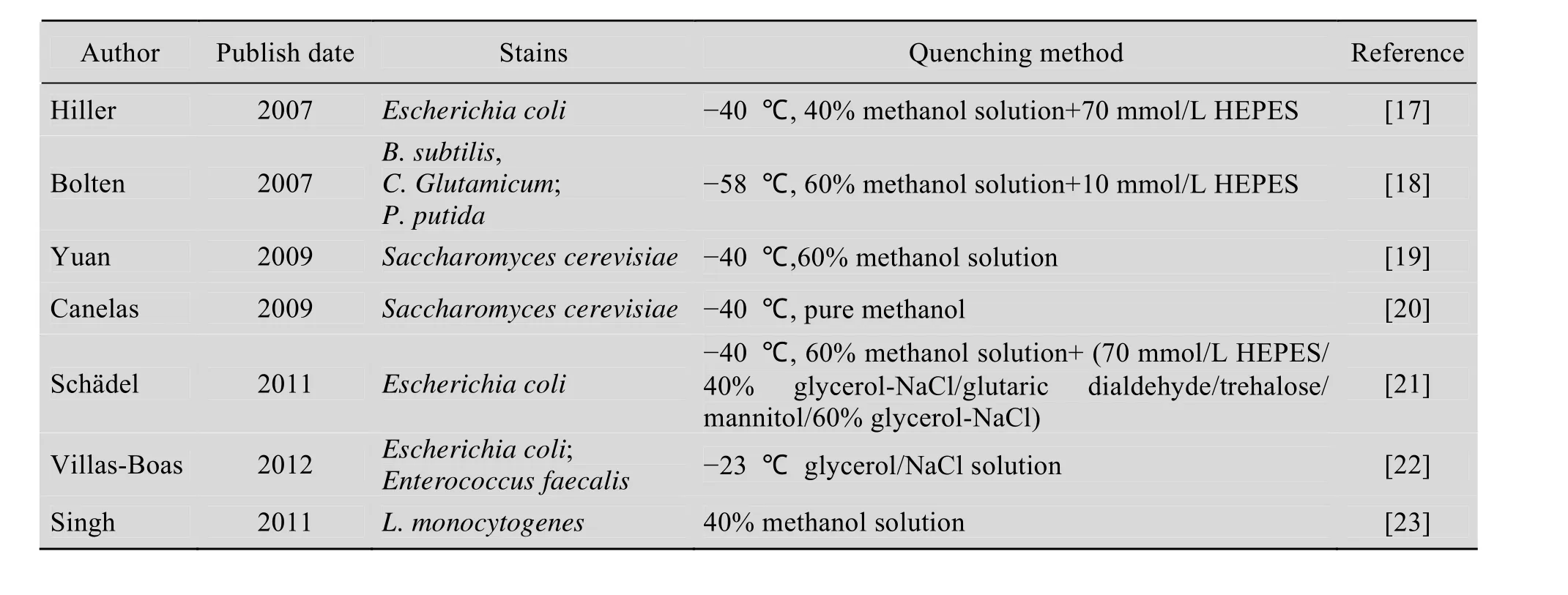
表2 微生物代谢组学分析中淬火及细胞破碎方法Table 2 Quenching and cell crushing methods in microbial metabolomics analysis
代谢物提取以尽可能多地获得所需物质,避免物理或化学改性,减少稀释效应为原则[24]。Maharjan等采用酸碱破坏、冷甲醇破壁、甲醇或乙醇高温提取、氯仿-甲醇溶菌提取等 6种不同的方式提取大肠杆菌中的代谢物,以同位素标记的葡萄糖作为检验指标比较提取效果,发现低温下(−40 )℃以甲醇作为提取溶剂时效果最佳[25]。然而,衡量一个提取方法的好坏不能只关注最终代谢产物的量,还要确保提取过程中代谢物的稳定,因此在提取时往往要加入缓冲溶液来减少提取过程对细胞的破坏,从而增强代谢物分析的稳定性,如乙醇胺、磷酸盐、羟乙基哌嗪乙磺酸(HEPES)、哌嗪乙磺酸 (PIPES) 等。除了液液萃取之外,微波辅助萃取、超临界流体萃取等方法可缩短提取时间、提高提取效率、降低溶剂消耗,在微生物代谢物分析领域也被广泛使用[26-27]。
2.2 代谢物的定性与定量
GC-MS检测中物质的定性需要利用其质谱进行数据检索,故其分析过程离不开各种代谢途径和生物化学的数据库。基因组学和蛋白质组学已有较完善的书库供搜索、使用,而代谢组学尚未有类似功能完备的数据库,但一些生化数据库[28-29]可用于已知代谢物的生物功能解释和未知代谢物的结构鉴定,如京都基因与基因组百科全书KEGG (http://www.genome.jp/kegg/)、NIST(http://webbook.nist.gov/chemistry/)、METLIN(http://metlin.scripps.edu/)、HMDB (http://www.hmdb.ca/)、MMCD (http://mmcd.nmrfam.wisc.edu/)、Fiehn database (http://fiehnlab.ucdavis.edu/db/)、GMD (http://gmd.mpimp-golm.mpg.de/)、SDBS(http://www.aist.go.jp/RIODB/SDBS/menu-e.html)及ExPASy (http://www.expasy.org/)。此外还有一些针对特定生物体的完整数据库,如 IRIS (水稻)、AraCyc (拟南芥)。
在代谢组学研究中,为确保分析数据的有效性与可靠性,需要进行定量分析以减少样品处理及检测中产生的差异。一般的定量分析方法有外标法、内标法。外标法适用于检测/修正检测器偏差,控制分析系统的惰性。而内标法通常以同位素标记的代谢物或非内源性物质 (与某种代谢物特性相似的物质) 作为内标,将样品中每种代谢物都进行定量检测,在提取、衍生化或分析前加入内标,可有效控制样品处理中不同步骤产生的误差。此外,以同位素标记的微生物代谢物作为内标的方法目前也应用广泛,即微生物生长的培养基中,碳源物质均用同位素标记,则提取出的所有代谢物可作为内标使用[30]。
2.3 GC-MS数据分析
基于GC-MS技术的代谢组学研究产生的大量复杂数据需要借助成熟的统计学工具才能够得到合理的解释,进而深入研究微生物代谢物的隐含意义。目前用于代谢组学数据分析的主要手段为模式识别技术,包括非监督学习方法和有监督学习方法。非监督学习方法的算法不给出训练集,输入的数据以“无人监督”方式被分类,主要有主成分分析、非线性映射、簇类分析等;有监督学习方法会给出一些输入数据和答案作为分类系统的“训练集”,用来构建模型并评估必需的参数,分析应用的判别式包括偏最小二乘法-判别分析、正交算法、人工神经网络及基于进化的计算算法。
其中,主成分分析和偏最小二乘法-判别分析是代谢组学研究中最常用的模式识别方法。这两种方法通常以得分图 (Score plot) 表示对样品分类的信息,载荷图 (Loading plot) 表示对分类有贡献的变量及其贡献大小,从而发现可作为生物标志物的变量。Matlab、SIMCA-P、SAS是代谢组学数据分析中的常用软件,而近年来一些具有特殊功能的分析方法/软件发展迅速,多维数据的表现形式逐渐实现多元化 (表3)。

表3 多维数据分析软件的应用Table 3 Application of multidimensional data analysis softwares
3 GC-MS联用技术在代谢组学中的应用
3.1 微生物
微生物的代谢物是基因表达的最终产物,基因和蛋白表达的微小变化可以在代谢物上得到放大,因此对微生物细胞提取物进行分析有助于了解细胞的能量吸收和生长过程。
在基于GC-MS的微生物代谢组学研究中,首要的任务是对代谢物分离鉴定方法的建立与优化。谷氨酸棒杆菌作为应用广泛的模式生物之一,其代谢组分析方面的工作已较为成熟。Strelkov以基于 GC-MS首次建立了一种可快速鉴定谷氨酸棒杆菌代谢物的方法,可检测1 000多种化合物,且测量重现性的误差仅在 6%以内[36]。Borner等通过样品预处理的平行化和部分自动化,也建立了该菌代谢组的高通量分析方法,不仅将 GC-MS分析时间由 60 min缩短至18 min,还实现了650种代谢物的定量化[37]。
代谢组学分析可通过代谢物差异有效鉴定微生物在不同环境下细胞的代谢差异,从而更深入地了解外界环境所造成的微观物质变化。Miura利用 GC-MS比较白腐真菌黄孢原毛平革菌在空气和100%氧气条件下发酵的生长差异,获取对氧气压力敏感的代谢产物[38],为其工业化进程及生产模式提供全新的视角。元英进课题组利用 GC-TOFMS对不同条件下酿酒酵母发酵生产酒精过程中的代谢物作了一系列的研究。首先鉴定了酿酒酵母在工业连续发酵与批次发酵时中心碳代谢流物质、氨基酸等胞内代谢产物,并采用主成分分析获得两种模式的标志性物质[39],这有效反映了工业发酵的真实过程。随后考察了酿酒酵母对真空发酵的适应进化过程及接种密度对高密度发酵的影响,通过对碳代谢物质、氨基酸及脂肪酸的鉴定,结合多维数据分析方法——PCA、HCA,得到特征性物质的变化趋势,验证出在接种量为40 g/L条件下酵母细胞中的甘油与脯氨酸能在高细胞浓度的压力下有效维护酵母细胞正常的生理代谢活动[40,19],将这些代谢组信息与转录组、脂质组相结合,可对酵母发酵过程形成系统性的认识。在考察不同菌种对环境压力的应激反应时,发现原始酵母在抑制剂作用下会强化蛋白分解,导致氧化应激、产生大量活性氧自由基,而耐抑制型酵母中高含量的嘧啶可对细胞起保护作用;酵母的单倍体与双倍体细胞,在乙醇压力下的代谢差异明显减弱,且单倍体的代谢更易受乙醇压力的影响[41-42],而这种目标代谢物检测可作为筛选高产量菌株的有效途径。
此外,基因改造对某些微生物表型特征的影响并不明显,而代谢组学能有效地探测基因改造引起的改变,并实现突变株间的表现型分化。Tian等在筛选高产琥珀酸的大肠杆菌菌株时,敲除基因sdhAB或ackA-pta后,琥珀酸产量的提高并不明显,但利用GC-FID、GC-MS对突变株及野生型菌株进行代谢轮廓分析后,发现两种突变株中琥珀酸、天冬氨酸、脯氨酸的代谢却存在显著的差异[43]。Buchinger等也利用GC-MS技术分析敲除氮源调节因子——AmtR基因对谷氨酸棒杆菌代谢组和转录组的影响,发现突变株中含有糖酵解途径、磷酸戊糖途径及柠檬酸循环中代谢物的不同形式,其中谷氨酸盐在突变株中明显减少且排泄受损[44]。
GC-MS对多种化合物具有较强、较灵敏的分析能力,故对于鉴定比较微生物不同菌株之间的代谢物差异、同一菌株在不同生长环境下的代谢变化具有特殊的意义。结合统计学方法,将分析中存在极大差异的代谢物,作为此微生物的生物标记物,为其更深入的研究提供必要的基础。
3.2 植物
GC-MS联用技术也是目前在植物代谢分析中应用最广泛的分离检测手段之一。早期对土豆提取物的代谢轮廓分析已证实GC-MS平台是分离鉴定复杂的植物基体中大量代谢物的有效工具,并能实现特定物质的定量分析[45]。Schwarzinger等利用热分解-GC-MS分析五味子不同部位 (种子、果实、种壳、树叶等) 的特性,通过热裂解蒸发出热稳定的木酚素类物质等,鉴定出的各部位组分均与 CO2超临界流体提取的分析结果相吻合[46]。Noctor等采用 GC-TOFMS建立了树叶粗提取物中氨基酸产生信息的数量本质,考察拟南芥叶子的甲醇/水提取物分析结果的标准偏差,并结合高效液相色谱 (HPLC) 更精确地检测氨基酸[47]。
在利用GC-MS分析过程中,通常需要不同的提取方法获得更完整的代谢物信息,以便较全面地了解植物中的代谢轮廓相关信息。Jin等在对红景天挥发性组分的初步研究中,分别通过水蒸馏和顶空液相的方法提取并检测出75和68种代谢物,在比较两相中的组分及含量后发现红景天中主要含有的芳香油类物质均为单萜醇[48]。Nappo等在采用GC-MS考察底栖硅藻Cocconeis scutellum的代谢轮廓时,分别在电子轰击电离源与化学电离源下,检测了不同有机溶剂——乙醚和丁醇提取出的代谢物,初步阐明了Cocconeis scutellum的代谢型及其在海洋底栖生物中的生态作用[49]。
通过GC-MS技术对植物不同组成的提取物进行检测,可有效地分析出其代谢轮廓的差异,可应用于植物的种植、品种的质量评估等方面。Tianniam等利用热分解-GC-MS检测手段和PLS-DA数据分析,有效鉴别多种白芷并建立了可用于精确、可靠预测白芷质量的模型[50]。
3.3 疾病诊断与药物分析
利用GC-MS技术对人或动物体内的代谢物进行较全面的测定,可用于疾病的诊断、疾病发病过程的监测、以及药理学中对药品疗效和代谢状况的考察。
在疾病诊断中,通过对患者与正常人的血清、血浆或尿液等进行检测比较,分析代谢物间的差异从而获得鉴定某种疾病的标记物。Wang和Mao通过GC-MS分别检测了阿尔茨海默尔症患者和肾移植手术中出现急性排斥反应病人的血清,由代谢轮廓分析得出二十二碳六烯酸(DHA) 为阿尔茨海默尔症中最具潜力的脂肪酸生物标记物[51],而通过监督聚簇分析代谢物水平的差异,有效地鉴定了肾移植手术中的病人状况[52]。血浆中代谢物的分析可对2型糖尿病患者及治疗前后的代谢轮廓有清楚的认识[53],还可对冠状动脉心脏病进行临床实践分类识别[54]。Wu等在对肝细胞癌的研究中,通过分析尿液和食道癌患者的粘膜组织,获得了病人与正常人的代谢差异及临床病理学的特性,为建立诊断模式提供了基础[55]。Lin等利用 GC-MS考察了细胞系A549和AGS感染甲型流感病毒后的代谢轮廓,由两者代谢物的差异及模式识别不同细胞系对病毒的敏感度[56]。Song等抽样调查了中国神经管缺失的原因及先天性代谢紊乱,发现孕妇患者由于维生素B12缺失等会引起新生儿肝内胆汁淤积,并诱发神经管缺失症[57]。
在药理学中,GC-MS对药品成分较强的分析鉴别能力使其广泛应用于体内药物分析和药物代谢动力学等方面的研究中。Song等利用GC×GC-TOFMS分析了78种药品标准混合物样品,发现能够检测出多数药物组分,其中曲马朵、地西泮、奥氮平和地昔帕明在分析中表现出典型的线性关系和精确度,除扑热息痛和苯妥英形成不规则的峰外,其他药物形成色谱峰均可识别分析[58],有效地证明GC-MS可用于观察药物在人体内的吸收效果。Bando等发现样品采集过程会对药理学分析结果产生重要的影响,且在尿液与血浆代谢组学分析中,发现储存时间会明显改变尿液的代谢轮廓;而血浆代谢轮廓的分析受采样点、抗凝血剂影响较大,与麻醉效果无关[59]。Aa等利用了 GC-TOF-MS对注入不同剂量雷公藤内酯的老鼠进行血清代谢组分析,发现雷公藤内酯会引起代谢型的偏差,并促使牛磺酸、脂肪酸产生干扰,最终表现出其对肝脏的毒性[60]。
3.4 其他
GC-MS在动物、食品生产等领域也有较为成熟的应用,通过对代谢物的检测分析,有效地了解代谢物的变化趋势,为宏观的表型提供微观的解释[61]。针对红尾肉蝇因光周期诱导的蛹期滞育和温度诱导的快速冷硬化现象,Michaud等利用GC-MS分析比较出该过程中代谢物变化存在极大的差异,并讨论了发生改变的代谢物在生物体抗寒中发挥的作用,提出GC-MS检测结果对昆虫生理学系统分析的价值[62]。Ralston-Hooper也利用 GC×GC-TOFMS分析不同生长环境及化学应激 (阿特拉嗪) 下的粘杜父鱼的代谢轮廓,建立了可行的色谱峰归一化方法,观察不同环境条件下样品的差异[63]。Park等采用GC-MS分析出了豆豉发酵过程中的定向代谢物,包括 20种氨基酸、12种有机酸和9种脂肪酸,并比较了发酵不同时期各物质的变化[64],为豆豉生产过程控制提供了独特的视角。
4 GC-MS联用技术在代谢组学分析中存在的问题及展望
GC-MS最主要的缺点是分析物必须为具挥发性的物质。由于大部分代谢产物是不能挥发的,因此,繁复的衍生化步骤是必需的[3]。而在样品的预处理、衍生化过程中,极易产生分析结果的多变性,并使样品的色谱图复杂化,其中多重峰、多底物现象最为常见。多重峰现象是一种化合物由于自身分解、副产物的形成或杂质的引入而产生多个产物[65],多重底物现象是 GC-MS色谱图中的单个峰对应多种底物[66]。Xu等提出导致多重峰现象的原因在于副产物的形成和化学键的衍生化不完全。而几何异构体的结构转换也会造成多重峰及多重底物现象,例如 D-葡萄糖在溶液中至少存在5种异构体,且均处于动力平衡,经衍生化后极易形成5个峰。此外,提取、衍生化及GC-MS分析过程中会使部分热不稳定的物质发生分解反应,这也会导致多重峰、多重底物的发生[67]。这些现象直接影响分析结果的重现性,在数据收集中会导致代谢途径中结构相似的代谢物之间的信号重复,从而影响代谢途径的进一步研究。
此外,代谢组学中的样品通常为复杂的混合物,利用GC-MS分析时GC会出现无法完全分离各种物质的现象,致使某些同系物间会产生重叠信号,针对这一问题,Wang等提出采用独立成分分析方法,分解相互独立的信号分量,有助于多种代谢物的鉴定[68]。
与代谢组学的其他分析手段如 LC-MS、CE-MS相比,GC-MS虽然较为成熟,但由于GC-MS分析样本中代谢物普遍需要衍生化预处理,造成多重峰、多重底物等现象,需要对其进一步深入研究。1) 开发新型的衍生化试剂,使其与多个官能团发生衍生化反应,可获得重复性好的方法。2) 此外,研发在线的衍生化方法,保证代谢物的硅烷化反应程度的完全,还可利用与代谢物结构/生理相似的标准品,模拟出相关代谢物潜在的影响,以提高分析的准确性。3) 如何获得可参照的内标物实现所有代谢物的绝对定量分析,也将成为GC-MS应用于代谢组学中的研究重点。
[1]Alvarez-Sanchez B, Priego-Capote F, Luque de Castro MD. Metabolomics analysis I. Selection of biological samples and practical aspects preceding sample preparation. Trends Anal Chem, 2010,29(2): 111−119.
[2]Xu GW. Metabonomics—Method and Application.Beijing: Science Press, 2008: 10−11 (in Chinese).
许国旺. 代谢组学——方法与应用. 北京: 科学出版社, 2008: 10−11.
[3]Zhu LK. Recent development of microbial metabolomics and its applocations. Chin J Conserv Dent, 2010, 20(1): 51−54 (in Chinese).
朱来宽. 微生物代谢组学及其应用的研究进展.牙体牙髓牙周病学杂志, 2010, 20(1): 51−54.
[4]Wong JW, Zhang K, Brown D, et al. Multiresidue pesticide analysis of ginseng powders using acetonitrile- or acetone-based extraction,solid-phase extraction cleanup, and gas chromatography-mass spectrometry/selective ion monitoring (GC-MS/SIM) or -tandem mass spectrometry (GC-MS/MS). J Agric Food Chem,2010, 58(10): 5884−5896.
[5]Coles J, Guilhaus M. Orthogonal acceleration-a new direction for time-of-flight mass spectrometry:fast, sensitive mass analysis for continuous ion sources. Trends Anal Chem, 1993, 12(5): 203−213.
[6]Losadaa S, Santos FJ, Galceran MT, et al. Gas chromatography-ion trap tandem mass spectrometry method for the analysis of methoxylated polybrominated diphenyl ethers in fi sh. J Chromatogr A, 2010, 1217: 5253−5260.
[7]Wang DL, Miao XS, Li QX. Analysis of organochlorine pesticides in coral (Porites evermanni) samples using accelerated solvent extraction and gas chromatography/ion trap mass spectrometry. Arch Environ Contam Toxicol, 2008,54(2): 211−218.
[8]Danielsson APH, Moritz T, Mulder H, et al.Development of a gas chromatography/mass spectrometry based metabolomics protocol by means of statistical experimental design.Metabolomics, 2012, 8(1): 50−63.
[9]Jonsson P, Gullberg J, Moritz T, et al. A strategy for identifying differences in large series of metabolomic samples analyzed by GC/MS. Anal Chem, 2004, 76(6): 1738−1745.
[10]Koubaa M, Mghaieth S, Roscher A, et al. GC-MS analysis of C-labeling in sugars for metabolic flux analysis. Anal Biochem, 2012, 425(2): 183−188.
[11]Pietrogrande MC, Basaglia G. Enantiomeric resolution of biomarkers in space analysis:chemical derivatization and signal processing for gas chromatography-mass spectrometry analysis of chiral amino acids. J Chromatogr A, 2010, 1217(7):1126−1133.
[12]Rodríguez-Sánchez S, Hernández-Hernández O,Sanz ML, et al. A derivatization procedure for the simultaneous analysis of iminosugars and other low molecular weight carbohydrates by GC-MS in mulberry (Morussp.). Food Chem, 2011, 126(1):353−359.
[13]Hong JE, Pyo H, Park SJ, et al. Determination of hydroxy-PCBs in urine by gas chromatography/mass spectrometry with solid-phase extraction and derivatization. Anal Chim Acta, 2005, 531(2): 249−256.
[14]Zhao HX, Wang LP, Li X, et al. Multiwalled carbon nanotubes as a solid-phase extraction adsorbent for the determination of three barbiturates in pork by ion trap gas chromatography-tandem mass spectrometry(GC/MS/MS) following microwave assisted derivatization. Anal Chim Acta, 2007, 586:399−406.
[15]Zhang Q, Wang GJ, A JL, et al. GC/MS analysis of the rat urine for metabonomic research. J Chromatogr B, 2007, 854: 20−25.
[16]Zhang Q, Wang G J, Du Y, et al. Application of GC/MS-based metabonomic profiling in studying the lipid-regulating effects ofGinkgo bilobaextract on diet-induced hyperlipidemia in rats. Acta Pharmacol Sin, 2009, 30: 1674−1687.
[17]Hiller J, Franco-Lara E, Weuster-Botz D.Metabolic profiling ofEscherichia colicultivations: evaluation of extraction and metabolite analysis procedures. Biotechnol Lett,2007, 29(8): 1169−1178.
[18]Bolten CJ, Kiefer P, Letisse F, et al. Sampling for metabolome analysis of microorganisms. Anal Chem, 2007, 79(10): 3843−3849.
[19]Ding MZ, Yuan YJ, Tian HC, et al. Inoculum size-dependent interactive regulation of metabolism and stress response ofSaccharomyces cerevisiaerevealed by comparative metabolomics. J Biotechnol, 2009, 144(4): 279−286.
[20]Canelas AB, Pierick A, Ras C, et al. Quantitative evaluation of intracellular metabolite extraction techniques for yeast metabolomics. Anal Chem,2009, 81(17): 7379−7389.
[21]Schädel F, David F, Franco-Lara E. Evaluation of cell damage caused by cold sampling and quenching for metabolome analysis. Appl Microbiol Biot, 2011, 92(6): 1261−1274.
[22]Duportet X, Aggio RBM, Carneiro S, et al. The biological interpretation of metabolomic data can be misled by the extraction method used.Metabolomics, 2012, 8(3): 410−421.
[23]Singh AK, Ulanov AV, Li Z, et al. Metabolomes of the psychrotolerant bacteriumListeria monocytogenes10403S grown at 37 °C and 8 °C.Int J Food Microbiol, 2011, 148(2): 107−114.
[24]Zhou DW, Zhu ZY. Sample preparation for microbial metabolome analysis. Chemistry, 2008,6: 404−407 (in Chinese).
周大炜, 朱之燕. 微生物代谢组学的样品前处理.化学通报, 2008, 6: 404−407.
[25]Maharjan RP, Ferenci T. Global metabolite analysis: the influence of extraction methodology on metabolome profiles ofEscherichia coli. Anal Biochem, 2003, 313 (1): 145−154.
[26]Edwards JL, Chisolm CN, Shackman JG, et al.Negative mode sheathless capillary electrophoresis electrospray ionization-mass spectrometry for metabolite analysis of prokaryotes. J Chromatogr A, 2006, 1106: 80−88.
[27]Lim GB, Lee SY, Lee EK, et al. Separation of astaxanthin from red yeastPhaffia rhodozymaby supercritical carbon dioxide extraction. Biochem Eng J, 2002, 11: 181−1871.
[28]Go EP. Database resources in metabolomics:anoverview. J Neuroimmune Pharm, 2010, 5(1):18−30.
[29]Carroll AJ, Badger MR, Harvey Millar A. The metabolome express project: enabling web-based processing, analysis and transparent dissemination of GC/MS metabolomics datasets. BMC Bioinformatics, 2010, 11: 376.
[30]Birkemeyer C, Luedemann A, Kopka J, et al.Metabolome analysis: the potential ofin vivolabeling with stable isotopes for metabolite profiling. Trends Biotechnol, 2005, 23(1): 28−33.
[31]Moon JY, Jung HJ, Moon MH, et al. Heat-map visualization of gas chromatography-mass spectrometry based quantitative signatures on steroid metabolism. J Am Soc Mass Spectr, 2009,20(9): 1626−1637.
[32]Aggio R, Ruggiero K, Villas-Boas SG. Pathway Activity Profiling (PAPi): from the metabolite profile to the metabolic pathway activity.Bioinformatics, 2010, 26(23): 2969−2976.
[33]Xu Y, Goodacre R. Multiblock principal component analysis: an efficient tool for analyzing metabolomics data which contain two influential factors. Metabolomics, 2012, 8(1): 37−51.
[34]Droste P, Miebach S, Niedenführ S, et al.Visualizing multiomics data in metabolic networks with the software Omix—A case study.Biosystems, 2011, 105(2): 154−161.
[35]Aggio R, Villas SG, Ruggiero K. Metab: an R package for high-throughput analysis of metabolomics data generated by GC-MS.Bioinformatics, 2011, 27(16): 2316−2318.
[36]Strelkov S, Elstermann M, Schomburg D.Comprehensive analysis of metabolites inCorynebacterium glutamicumby gas chromatography/mass spectrometry. Biol Chem,2004, 385(9): 853−861.
[37]Borner J, Buchinger S, Schomburg D. A high-throughput method for microbial metabolome analysis using gas chromatography/mass spectrometry. Anal Biochem, 2007, 367(2):143−151.
[38]Miura D, TanakaH, Wariishi H. Metabolomic dif f erential display analysis of the white-rot basidiomycetePhanerochaete chrysosporiumgrown under air and 100% oxygen. FEMS Microbiol Lett, 2004, 234(1): 111−116.
[39]Ding MZ, Yuan YJ, Cheng JS, et al. Comparative metabolomic analysis on industrial continuous and batch ethanol fermentation processes by GC-TOF-MS. Metabolomics, 2009, 5(2): 229−238.
[40]Ding MZ, Yuan YJ, Zhou X. Metabolome prof i ling reveals adaptive evolution ofSaccharomycescerevisiaeduring repeated vacuum fermentations.Metabolomics, 2010, 6(1): 42−55.
[41]Ding MZ, Yuan YJ, Wang X, et al. Comparative metabolic profiling of parental and inhibitors-tolerant yeasts during lignocellulosic ethanol fermentation. Metabolomics, 2012, 8(2):232−243.
[42]Ding MZ, Yuan YJ, Li BZ, et al. Metabolome analysis of differential responses of diploid and haploid yeast to ethanol stress. OMICS, 2010,14(5): 553−561.
[43]Tian J, Xu GW, Shi CY, et al. Phenotype differentiation of threeE. colistrains by GC-FID and GC−MS based metabolomics. J Chromatogr B,2008, 871(2): 220−226.
[44]Buchinger S, Burkovski A, Strösser J, et al. A combination of metabolome and transcriptome analyses reveals new targets of theCorynebacterium glutamicumnitrogen regulator AmtR. J Biotechnol, 2009, 140: 68−74.
[45]Roessner U, Willmitzer L, Wagner C, et al.Simultaneous analysis of metabolites in potato tuber by gas chromatography-mass spectrometry.Plant J, 2000, 23(1): 131−142.
[46]Schwarzinger C, Kranawetter H. Analysis of the active compounds in different parts of theSchisandra chinensisplant by means of pyrolysis-GC/MS. Monatsh Chem, 2004, 135(9):1201−1208.
[47]Noctor G, Prioul JL, Bergot G, et al. A comparative study of amino acid measurement in leaf extracts by gas chromatography-time of fl ight-mass spectrometry and high performance liquid chromatography with fl uorescence detection.Metabolomics, 2007, 3(2): 161−174.
[48]Jin YZ, Row KH, Park DW, et al. Primary study of volatiles composition ofRhodiola sachalinensisby using gas chromatography and mass spectrometry(GC/MS). Korean J Chem Eng, 2010, 27(4),1262−1268.
[49]Nappo M, Bastida J, Berkov S, et al. Metabolite profiling of the benthic diatomCocconeis scutellumby GC-MS. J Appl Phycol, 2009, 21(3): 295−306.
[50]Tianniam S, Bamba T, Fukusaki E. Pyrolysis GC-MS-based metabolite fingerprinting for quality evaluation of commercialAngelica acutilobaroots.J Biosci Bioeng, 2010, 109 (1), 89−93.
[51]Wang DC, Wan XL, Sun CH, et al. Serum fatty acid prof i les using GC-MS and multivariate statistical analysis: potential biomarkers of Alzheimer’s disease. Neurobiol Aging, 2012, 33(6):1057−1066.
[52]Mao YY, Cheng YY, Bai JQ, et al. A pilot study of GC/MS-based serum metabolic profiling of acute rejection in renal transplantation. Transpl Immunol,2008, 19(1): 74−80.
[53]Zeng MM, Zhou ZG, Che ZH, et al. GC−MS Based plasma metabolic prof i ling of type 2 diabetes mellitus. Chromatographia, 2009, 69: 941−948.
[54]Zheng XT, Qu HB, Shen J, et al. Plasma fatty acids metabolic prof i ling analysis of coronary heart disease based on GC-MS and pattern recognition. J Pharmaceut Biomed, 2009, 49(2): 481−486.
[55]Wu H, Shen XZ, Xue RY, et al. Metabolomic prof i ling of human urine in hepatocellular carcinoma patients using gas chromatography/mass spectrometry. Anal Chim Acta, 2009, 648(1):98−104.
[56]Lin SH, Cai ZW, Liu N, et al. GC/MS-based metabolomics reveals fatty acid biosynthesis and cholesterol metabolism in cell lines infected with inf l uenza A virus. Talanta, 2010, 83(1): 262−268.
[57]Song YZ, Zheng XY, Li BX, et al. Selective screening for inborn errors of metabolism and secondary methylmalonic aciduria in pregnancy at high risk district of neural tube defects: a human metabolome study by GC-MS in China. Clin Biochem, 2008, 41: 616−620.
[58]Song SM, Wynne P, Marriott P, et al.Comprehensive two-dimensional gas chromatography with time-of-f l ight mass spectrometry (GC×GC-TOFMS) for drug screening and conf i rmation. Forensic Sci Int, 2004, 143:87−101.
[59]Bando K, Fukusaki E, Kawahara R, et al.Influences of biofluid sample collection and handling procedures on GC−MS based metabolomic studies. J Biosci Bioeng, 2010, 110(4): 491−499.
[60]Aa JY, Wu ZM, Shao F, et al. Gas chromatography time-of-f l ight mass spectrometry based metabolomic approach to evaluating toxicity of triptolide. Metabolomics, 2011, 7(2): 217−225.
[61]Dervilly-Pine G, Courant F, Chéreau S, et al.Metabolomics in food analysis: application to the control of forbidden substances. Drug Test Anal,2012, 4: 59−69.
[62]Michaud MR, Denlinger DL. Shifts in the carbohydrate, polyol, and amino acid pools during rapid cold-hardening and diapause-associated cold-hardening in Xesh Xies (Sarcophaga crassipalpis): a metabolomic comparison. J Comp Physiol B, 2007, 177(7): 753−763.
[63]Ralston-Hooper K, Sepulveda MS, Adamec J.Development of GCxGC/TOF-MS metabolomics for use in ecotoxicological studies with invertebrates. Aquat Toxicol, 2009, 88(1): 48−52.
[64]Park MK, Kim YS, Cho IH. Metabolite prof i ling ofCheonggukjang, a fermented soybean paste, during fermentation by gas chromatography-mass spectrometry and principal component analysis.Food Chem, 2010, 122(4): 1313−1319.
[65]Chan ECW, Koh PK, Mal M, et al. Metabolic profiling of human colorectal cancer using high-resolution magic angle spinning nuclear magnetic resonance (HR-MAS NMR) spectroscopy and gas chromatography mass spectrometry(GC/MS). J Proteome Res, 2009, 8(1): 352−361.
[66]Xu F, Zou L, Nam Ong C. Multiorigination of chromatographic peaks in derivatized GC/MS metabolomics: a confounder that influences metabolic pathway interpretation. J Proteome Res,2009, 8(12): 5657−5665.
[67]Xu F, Zou L, Nam Ong C. Experiment-originated variations, and multi-peak and multi-origination phenomena in derivatization-based GC-MS metabolomics. Trends Anal Chem, 2010, 29(3):269−280.
[68]Wang GJ, Cai WS, Shao XG. A primary study on resolution of overlapping GC-MS signal using mean-field approach independent component analysis. Chemometr Intell Lab, 2006, 82:137−144.
September 1, 2012; Accepted: January 16, 2013
He Huang. Tel/Fax: +86-25-83172094; E-mail: biotech@njut.edu.cn
国家重点基础研究发展计划 (973计划) (Nos. 2009CB724700,2011CBA00802),江苏省自然科学基金 (No. BK2012424),国家科技支撑计划 (No. 2011BAD23B03),国家高技术研究发展计划 (863计划) (No. 2012AA021704) 资助。
Gas chromatography-mass spectrometry (GC-MS) and its application in metabonomics
Juan Li, Lujing Ren, Guannan Sun, and He Huang
College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing210009,Jiangsu,China
Metabonomics involves the unbiased quantitative and qualitative analysis of the complete set of metabolites present in cells, body fluids and tissues (the metabolome) based on modern analytic technique with high throughput, high sensitivity, and high resolution. Gas chromatography-mass spectrometry (GC-MS) is used to gain qualitative results of detected metabolites for biological samples as it provides superior distinguishability, detection sensitivity and integrated standard mass spectrometry library. In this article, the historic developments of GC-MS and its application in metabonomics in the past several years were reviewed. Firstly, the classification and the derivative methods of GC-MS were introduced. Subsequently, sample pretreatment process, qualitative and quantitative analysis and data analysis during detecting metabolites by GC-MS were introduced, then its application in microorganism, plant and disease diagnosis was systematically summarized. Finally, the problems in metabonomics study based on GC-MS and the research prospect in the future were discussed.
gas chromatography-mass spectrometry, metabonomics, microorganism, derivation
Supported by: National Basic Research Program of China (973 Program) (Nos. 2009CB724700, 2011CBA00802), Natural Science Foundation of Jiangsu Province (No. BK2012424), National Science and Technology Pillar Program (No. 2011BAD23B03), National High Technology Research and Development Program of China (863 Program) (No. 2012AA021704).
(本文责编 郝丽芳)