PI-103对人卵巢癌细胞株SKOV3/DDP顺铂化疗效果的影响
刘俊,蔡云朗,任慕兰,吴迪 ,曾娅
(1.东南大学医学院 江苏南京 210009;2.东南大学附属中大医院妇产科,江苏 南京 210009)
卵巢癌是目前死亡率最高的妇科恶性肿瘤,化疗是卵巢癌的重要治疗措施之一。但相当多患者因肿瘤细胞产生药物耐药而导致化疗失败,因此,增强对化疗药物的敏感性是提高卵巢癌治疗效果的有效途径之一。肿瘤细胞产生化疗耐药的共同途径是抑制凋亡,细胞进入凋亡程序的能力直接影响其化疗药物发挥作用的效应。肿瘤细胞抑制进入凋亡程序,进而可以表现出对化疗药物的耐药性,这也是肿瘤细胞的一种自我保护。磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋 白 激 酶 B(serine/threonine kinase,Akt;protein kinase B,PKB)/哺乳动物雷帕霉素靶体蛋白(mammalian target of rapamycin,mTOR)通路具有调节细胞生长、增殖、迁移,促进细胞周期进程以及参与血管形成等多种功能,是最主要的抑制细胞凋亡的信号途径[1-3]。本研究探讨 PI3K/mTOR双抑制剂 PI-103对人卵巢浆液性乳头状囊腺癌顺铂耐药细胞株(SKOV3/DDP)细胞顺铂化疗的影响以及可能机制,进一步阐明该通路与卵巢癌细胞顺铂耐药的关系,为耐药卵巢癌的治疗提供实验依据。
1 材料与方法
1.1 材料
SKOV3/DDP(北京市肿瘤医院药物研究所)。一抗:Akt兔抗人多克隆抗体、Phospho-Akt(Ser473)抗体(Bioworld公司),rps6鼠抗人单克隆抗体、Phosphorps6兔抗人单克隆抗体、Bax兔抗人单克隆抗体、Bcl-2兔抗人单克隆抗体(美国Cell signaling biotechnology公司),β-actin兔抗人单克隆抗体(Sigma公司);二抗:HRP-标记山羊抗鼠IgG、HRP-标记山羊抗兔IgG(北京康为世纪生物科技有限公司);PI-103(Cayman公司);顺铂(DDP,山东齐鲁制药厂);CCK-8试剂盒购自江苏碧云天生物技术研究所产品;胎牛血清(杭州四季青公司);RPMI 1640培养基(Gibco公司)。
1.2 方法
1.2.1 细胞培养 SKOV3/DDP细胞用含10%胎牛血清的RPMI 1640完全培养基,在37℃、5%CO2、相对湿度90%的恒温培养箱中培养,细胞呈贴壁生长。
1.2.2 PI-103与SKOV3/DDP细胞共同培养 取对数生长期SKOV3/DDP细胞消化制成细胞悬液,调整细胞浓度,以1×105ml-1接种于96孔板,培养24 h后,加入 PI-103 的终浓度为 0.25、0.5、1.0、2.0、4.0 μmol·L-1,继续培养 24、48、72 h,每个样本设 3个复孔。
1.2.3 PI-103联合DDP与SKOV3/DDP细胞共同培养 两种药物联合作用时,DDP终浓度为0.78、1.56、3.13、6.25、12.50、25.00、50.00 及 100.00 μmol·L-1,PI-103 浓度为 0.25、0.5、1.0、2.0、4.0 μmol·L-1,每个样本至少设3个复孔,继续孵育72 h。
1.2.4 CCK-8 法测定细胞抑制率 将 1.2.2、1.2.3处理过的96孔板,每孔加20 μl CCK-8溶液,在细胞培养箱内继续孵育2 h,在酶标仪上测定波长为450 nm的吸光度(OD)值,计算细胞抑制率[抑制率=(1-实验组OD值/对照组OD值)×100%]。根据各组DDP浓度和抑制率,计算两者的回归系数a、b,代入公式:Y=a+bln X,计算细胞顺铂IC50值。
1.2.5 流式细胞仪检测细胞凋亡率 实验分组(1)联合用药组:取 PI-103 浓度为 1 μmol·L-1,DDP浓度为 12.5 μg·ml-1(接近于其 DDP IC50值);(2)DDP组:取 DDP 的浓度为 12.5 μg·ml-1;(3)PI-103 组:取 PI-103 的浓度为 1 μmol·l-1;(4)对照组:不加药物处理。
按以上分组处理SKOV3/DDP细胞后均继续培养24 h后消化、收集,制成含1×106ml-1的单细胞悬液1 ml,预冷的PBS冲洗3次,加入1 ml预冷的70%乙醇,4 ℃ 固定 24 h,离心,PBS冲洗,用含有10 μg·ml-1PI和 0.1%RNase A 的 PBS液染色,室温避光30 min后用流式细胞仪测定细胞凋亡率。
1.2.6 Western blot检测 SKOV3/DDP 细胞 Akt、磷酸化的蛋白激酶B(p-Akt)、rpS6、磷酸化的核糖体蛋白S6(p-rpS6)、Bcl-2、Bax及β-actin的表达 分别以PI-103、DDP及PI-103、DDP联合作用于SKOV3/DDP细胞24 h后,每瓶细胞使用400 μl含苯甲基磺酰氟(PMSF)的RIPA裂解缓冲液抽提细胞总蛋白。40 μg蛋白经聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后转移至PVDF膜,室温封闭2 h,一抗4℃孵育过夜,用含0.05%Tween 20的TBS缓冲液(TBST)漂洗3次,每次10 min;加入相应的碱磷酶标记的二抗(1∶5 000),室温1 h,ECL显影、定影、曝光,结果采用Image J软件进行灰度分析。以β-actin作为上样内参,目的蛋白条带灰度与内参条带灰度的比值作为各组实验数据。每个样本至少重复3次,取平均值。
1.3 统计学处理
4月26日在奔赴阿斯特拉罕途中第三个点即是扎木扬村,在扎木扬渡口渡过伏尔加河,就可以来到建于19世纪的和硕特庙(Хошеутовский хурул)。
2 结 果
2.1 PI-103对SKOV3/DDP细胞生长的影响
见图1。
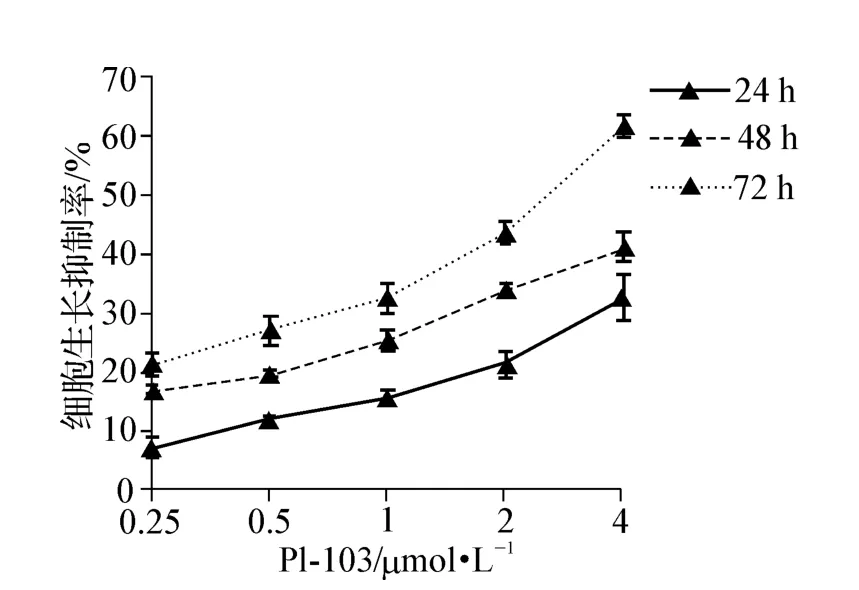
图1 PI-103对卵巢癌SKOV3/DDP细胞生长抑制率的影响Fig 1 The effect of PI-103 on inhibition rate in SKOV3/DDP cell lines
PI-103能够抑制SKOV3/DDP细胞的增殖,随着PI-103 浓度的增加(0.25、0.5、1.0、2.0、4.0 μmol·L-1),细胞生长抑制率逐渐增加(P <0.001),而且随着药物作用时间(24、48、72 h)的延长,细胞的生长抑制作用也明显增加(P<0.001)。
2.2 不同浓度PI-103对SKOV3/DDP细胞顺铂化疗的影响
见表1。
表1 PI-103与DDP联用对SKOV3/DDP细胞生长的抑制率的影响(± s,n=3)Tab 1 The effect of PI-103 combined with DDP on inbibition rate in SKOV3/DDP cell lines± s,n=3)

表1 PI-103与DDP联用对SKOV3/DDP细胞生长的抑制率的影响(± s,n=3)Tab 1 The effect of PI-103 combined with DDP on inbibition rate in SKOV3/DDP cell lines± s,n=3)
与对照组比较,a P <0.05
DDP/μg·mol-1 对照组PI-103 浓度/μmol·L-1 0.25 0.5 1.0 2.0 4.0 F 值 P值0.78 11.53 ±2.11 16.29 ±1.55a 20.46 ±0.06a 25.47 ±1.07a 30.66 ±0.41a 34.33 ±0.41a 136.082 <0.001 1.56 14.97 ±2.87 21.87 ±2.84 27.72 ±3.53a 24.36 ±1.03a 42.81 ±1.64a 44.78 ±3.61a 38.763 <0.001 3.13 23.49 ±5.19 25.32 ±3.84 36.05 ±2.09a 40.55 ±2.49a 49.12 ±6.32a 51.78 ±4.13a 22.876 <0.001 6.25 34.35 ±3.78 37.26 ±1.66 43.31 ±3.15 47.19 ±4.67a 56.94 ±5.58a 61.61 ±2.84a 23.742 <0.001 12.5 45.00 ±2.09 44.83 ±1.63 47.78 ±1.32 54.30 ±4.43a 59.39 ±2.26a 62.06 ±1.21a 28.752 <0.001 25 60.13 ±1.66 61.71 ±7.23 60.11 ±4.60 64.97 ±2.52 72.40 ±1.72a 75.07 ±1.30a 8.734 0.001 50 69.56 ±4.78 71.32 ±6.70 71.11 ±6.25 72.23 ±6.61 77.77 ±2.45 79.44 ±1.26 1.881 0.171 100 84.33 ±1.28 85.20 ±2.76 84.93 ±1.84 85.69 ±2.71 85.80 ±1.82 86.07 ±2.450.267 0.928
当 DDP 浓度为 0.78 μg·ml-1时,各实验组SKOV3/DDP细胞抑制率与对照组相比差异均有统计学意义(P <0.001)。当 DDP 浓度为 1.56 或 3.13 μg·ml-1,与浓度分别为 0.5、1.0、2.0、4.0 μmol的 PI-103共培养时,SKOV3/DDP细胞抑制率与对照组比较差异均有统计学意义(P<0.001)。当DDP浓度为6.25或 12.5 μg·ml-1,与浓度分别 1.0、2.0、4.0 μmol·L-1的PI-103共培养时,SKOV3/DDP细胞抑制率与对照组比较差异均有统计学意义(P<0.001)。当DDP 浓 度 为 25 μg· ml-1,与 浓 度 分 别 为 2.0、4.0 μmol·L-1的 PI-103 共培养时,SKOV3/DDP 细胞抑制率与对照组比较差异均有统计学意义(P=0.001)。可以看出,PI-103联合DDP给药比单用顺铂对SKOV3/DDP细胞生长抑制作用更明显。
以浓度分别为 0、0.25、0.5、1.0、2.0、4.0 μmol·L-1的PI-103作用于SKOV3/DDP细胞72 h,顺铂IC50值分别为(13.96 ±1.20)、(12.24 ±1.77)、(9.73 ±1.50)、(6.94 ±1.46)、(3.78 ±0.99)及(2.83 ±0.54)μg·ml-1。其中 PI-103 浓度为 0.25μmol·L-1时,顺铂IC50值与对照组比较,差异无统计学意义,其他浓度PI-103作用下顺铂IC50值与对照组比较,其差异有统计学意义(F=35.865,P <0.001)。
实验组与对照组比较,SKOV3/DDP细胞经0.25、0.5、1.0、2.0、4.0 μmol·L-1的 PI-103 作用后对顺铂敏感性分别增加了 12.30%、30.28%、50.30%、72.96%、79.69%。
2.3 单药及两药联合对细胞凋亡率的影响
见图2。
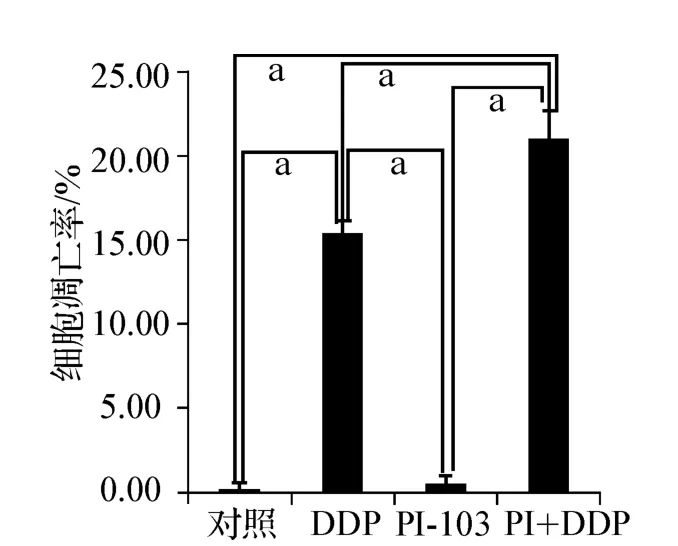
图2 PI-103、DDP单药及联合用药对SKOV3/DDP细胞凋亡的影响(a P <0.001)Fig 2 The effect of PI-103 and DDP alone and in combination on the apoptosis of SKOV3/DDP cell lines(a P <0.001)
PI-103、DDP及两药联合作用SKOV3/DDP细胞24 h后,FCM检测其细胞凋亡的变化,PI-103联合顺铂引起的细胞凋亡改变均明显高于单独用药组,差异有统计学意义(P<0.001)。
2.4 PI-103、DDP 对 SKOV3/DDP 细胞中 Akt、PAkt、rpS6及P-rpS6表达的影响
见图3。

图3 PI-103、DDP单药及联合用药材SKOV3/DDP细胞Akt、p-Akt、rpS6、p-rpS6表达的影响Fig 3 The effect of PI-103 and DDP alone and in combination on the expression of Akt,p-Akt,rpS6,p-rpS6 in SKOV3/DDP cell lines
在SKOV3/DDP细胞中,使用PI-103能够显著降低细胞中p-AKT、p-rpS6蛋白的表达(P<0.001);各组间Akt、rpS6蛋白表达两两比较,差异均无统计学意义(P>0.05);DDP组与对照组比较,各蛋白表达差异无统计学意义(P>0.05);联合用药组与PI-103比较,P-Akt蛋白表达差异有统计学意义(P<0.001),其余蛋白表达差异无统计学意义(P>0.05)。
2.5 PI-103、DDP对SKOV3/DDP细胞中凋亡相关蛋白Bax与Bcl-2表达的影响
见图4。
在SKOV3/DDP细胞中,抗凋亡蛋白Bcl-2在对照组细胞中表达量很高,促凋亡蛋白Bax表达量相对较低。以1 μmol·L-1的 PI-103 处理 SKOV3/DDP 细胞24 h,对Bcl-2和 Bax的表达几乎没有影响(P>0.05);以 12.5 μg·ml-1的 DDP 作用于 SKOV3/DDP细胞24 h,Bcl-2表达下调,Bax达上调;而PI-103与DDP联合作用24 h,Bcl-2表达量进一步下调,Bax表达量显著增加,差异有统计学意义(P<0.05)。
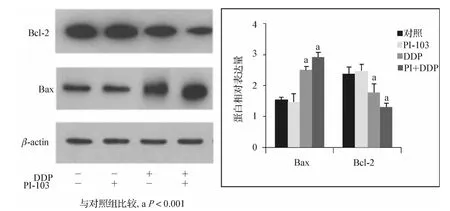
图4 PI-103、DDP单药及联合用药对SKOV3/DDP细胞Bcl-2、Bax表达的影响Fig 4 The effect of PI-103 and DDP alone and incombination on the expression of bcl-2,bax,in SKOV3/DDP cell lines
3 讨 论
目前,铂类化合物仍是卵巢癌化疗的一线药物,然而铂类耐药也是影响卵巢癌化疗效果的主要原因。细胞凋亡是顺铂敏感性的决定性因素,PI3K/Akt/mTOR信号转导通路是重要的抑制凋亡的途径。相关文献表明,该通路与卵巢癌[4]、大肠癌[5]等多种肿瘤的化疗耐药相关,一些研究[4-6]表明,肿瘤细胞中 Akt、mTOR的过表达或磷酸化水平上调与顺铂耐药有关,而PI3K抑制剂或mTOR抑制剂能增加顺铂敏感性,其机制可能为:活化状态的Akt直接使BAD磷酸化,从而使抗凋亡蛋白Bcl-2、Bcl-xL活化抑制细胞凋亡;也抑制线粒体中细胞色素C的释放,维持线粒体的完整性从而抑制细胞死亡;也能磷酸化FOXO转录因子调控肿瘤细胞周期进程;还可抑制Bim的磷酸化,影响促凋亡系统的激活,且rp-S6蛋白的磷酸化参与调控促凋亡与抑凋亡系统的mRNA的翻译如Mcl-1等[2]。Peng等[7]发现,Akt/mTOR通路的激活可以抑制DDP诱导卵巢癌细胞的凋亡作用,引起卵巢癌细胞产生DDP耐药。将RAD001与DNA损伤诱导剂(如DDP)结合,可以通过调控mTOR通路增强肿瘤细胞对于DDP诱导凋亡的敏感性[8]。但也有研究[9]表明,单用 mTOR抑制剂可能反馈性上调了P-AKT(Ser473),导致其作用减弱。Mazzoletti等将mTOR抑制剂和PI3K/mTOR双抑制剂PI-103联合应用于人卵巢癌细胞与前列腺癌细胞,发现PI-103可以阻止由mTOR抑制剂反馈性激活PI3K/Akt途径,更大程度地抑制AKT磷酸化,最终明显减少癌细胞的生长、增殖、侵袭、转移[10]。也有体外实验表明,PI-103还能提高紫杉醇、长春新碱、阿霉素等化疗药物抗肿瘤效果[11]。PI-103是一种能同时抑制P13K/mTOR的双抑制剂,尤其作用于PI3Kα、mTORC1及mTORC2,也作用于70个其他激酶包括Ⅱ、Ⅲ类PI3Ks的多种代表性蛋白激酶,而且PI-103有良好的药物稳定性、毒副作用小。本研究通过应用PI-103对卵巢癌耐药株SKOV3/DDP的抗癌活性及其对顺铂化疗作用的探究,进一步阐述了PI3K/Akt/mTOR信号转导通路与卵巢癌化疗耐药的关系,为改善卵巢癌化疗耐药提供理论依据。
本研究结果表明,PI-103对卵巢癌SKOV3/DDP细胞有明显生长抑制作用,且具有浓度、时间依赖性,增加DDP对细胞生长的抑制作用,说明PI-103在卵巢癌中有抗癌活性,且能提高顺铂化疗敏感性。本研究结果显示,PI-103能明显下调PI3K、mTOR的下游重要靶蛋白Akt、rp-S6的磷酸化水平,尤其是PI-103与DDP联合作用时,能更大程度地抑制磷酸化Akt的表达;而当 DDP 单独作用时,Akt、p-Akt、rpS6、p-rpS6蛋白的表达几乎无改变。同时,本研究也观察到,PI-103单独作用时凋亡相关蛋白Bcl-2和Bax的表达几乎无变化,而DDP单独作用时能使Bcl-2表达下调,Bax达上调,且联合PI-103作用时促凋亡蛋白Bax的表达量进一步上调,而抗凋亡蛋白Bcl-2的表达量明显下调,这说明PI-103可以增加顺铂对凋亡相关蛋白表达的调控,促进SKOV3/DDP细胞的凋亡,最终表现为促进顺铂敏感性。PI-103明显提高顺铂对SKOV3/DDP细胞生长的抑制作用,且能增强顺铂诱导的细胞凋亡效应,提示PI3K/Akt/mTOR信号通路传导的阻滞可以提高卵巢癌细胞对顺铂的敏感性。
综上所述,PI3K/mTOR双抑制剂PI-103能够提高卵巢癌耐顺铂细胞株对顺铂的敏感性,且这种作用主要源于PI-103阻断了PI3K/Akt/mTOR通路信号传导,增加DDP对细胞生长的抑制作用,且加强顺铂对Bax与Bcl-2表达的调控及促凋亡作用,最终增强卵巢癌化疗效果,为逆转卵巢癌化疗耐药提供新的契机,因此,PI3K/mTOR双抑制剂PI-103有望成为逆转化疗耐药的靶向性药物。
[1]PARSONS R.Human cancer,PTEN and the PI-3 kinase pathway[J].Semin Cell Dev Biol,2004,15(2):171-176.
[2]STEELMAN L S,CHAPPELL W H,ABRAMS S L,et al.Roles of the Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging[J].Aging(Albany NY),2011,3(3):192-222.
[3]CORRADETTI M N,GUAN K L.Upstream of the mammalian target of rapamycin:do all roads pass through mTOR?[J].Oncogene,2006,25(48):6347-60.
[4]张栋,孔德璇,和珍珍,等.PI3K/Akt信号转导通路与卵巢癌顺铂耐药相关性的研究[J].天津医药,2011,39(4):361-363.
[5]张劲远,张银旭,张俊华.PI3K-Akt信号通路对人大肠癌hct-8/FU耐药细胞P-GP表达和耐药性的影响[J].东南大学学报:医学版,2013,32(2):169-172.
[6]MABUCHI S,KAWASE C,ALTOMARE D A,et al.mTOR is a promising therapeutic target both in cisplatin-sensitive and cisplatin-resistant clear cell carcinoma of the ovary[J].Clin Cancer Res,2009,15(17):5404-5413.
[7]PENG D J,WANG J,ZHOU J Y,et al.Role of the Akt/mTOR survival pathway in cisplatin resistance in ovarian cancer cells[J].Biochem Biophys Res Commun,2010,394(3):600-605.
[8] HUANG S,HOUGHTON P J.Targeting mTOR signaling for cancer therapy[J].Curr Opin Pharmacol,2003,3(4):371-377.
[9]BEHBAKHT K,SILL M W,DARCY K M,et al.Phase II trial of the mTOR inhibitor,temsirolimus and evaluation of circulating tumor cells and tumor biomarkers in persistent and recurrent epithelial ovarian and primary peritoneal malignancies:A Gynecologic Oncology Group study[J].Gynecol Oncol,2011,123(1):19-26.
[10]MAZZOLETTI M,BORTOLIN F,BRUNELLI L,et al.Combination of PI3K/mTOR inhibitors:Antitumor activity and molecular correlates[J].Cancer Res,2011,71(13):4573-4584.
[11]BENDER A,OPEL D,NAUMANN I,et al.PI3K inhibitors prime neuroblastoma cells for chemotherapy by shifting the balance towards pro-apoptotic Bcl-2 proteins and enhanced mitochondrial apoptosis[J].Oncogene,2011,30(4):494-503.

