蜱传森林脑炎病毒非结构蛋白1原核表达载体的构建
宋天一,李菁华,张 哲,史红艳,孙延波
(吉林大学白求恩医学院病原生物学系,吉林 长春 130021)
* 吉林大学白求恩医学院临床医学七年制2006级
蜱传森林脑炎病毒(Tick-borne encephalitis virus,TBEV)是黄病毒科(Flaviviridae)黄病毒属(Flavivirus)成员,TBEV引起的脑炎又称森林脑炎,主要流行于欧洲和亚洲[1],在我国主要分布于东北地区,在云南、新疆和西藏也有自然疫源地存在的报道[2]。人感染TBEV后可引起发热、头痛、意识障碍、肌肉瘫痪,可发展为致死性脑炎,病死率为5%~20%[3]。TBEV基因组为长约11000bp的单股正链RNA,由单一阅读框架编码3种结构蛋白(C、M和E)和7种非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b和NS5)。其中,NS1为相对分子质量约40000的糖蛋白,由包膜蛋白C末端的信号肽引导分布于内质网腔,NS1在病毒复制时不可缺少,因为NS1参与病毒外源和内源性双链 RNA(dsRNA)的形成[4-5]。此外,病毒感染的患者血清中亦存在NS1蛋白,NS1蛋白可作为血清学诊断的标志。目前已知西尼罗病毒(黄病毒成员)等的NS1蛋白是1种免疫调节因子,与互补调节因子H结合后,可以抑制Toll样受体3(TLR3)信号通路[6]。本实验采用基因重组技术构建含TBEV NS1的原核表达系统,为进一步探讨TBEV的NS1在TLR3信号通路及免疫调节中的作用提供新的思路。
1 材料与方法
1.1 载体和感受态细胞 TBEV NS1基因由北京鼎国生物技术有限公司合成,以pMD19-T-NS1重组质粒保存于DH5α工程菌内。pEASY TM-E1表达载体、T7Promoter Primer、T7Terminator Primer和BL21感受态细胞购自北京全式金公司。
1.2 主要试剂和仪器 限制性内切酶、DNA连接酶kit购自Takara公司;Plasmid Mini Kit、Gel Extraction Kit购自 Tiangen公司;异丙基-β-D-硫代吡喃半乳糖苷(IPTG)、苯甲基磺酰氟(PMSF)和Ampcillin购自北京鼎国生物技术有限公司;NI-NTA resin、鼠抗HIS标签抗体和碱性磷酸酶(AP)标记的羊抗鼠二抗购自北京全式金公司。HZQ-X100振荡培养箱和高速台式离心机(RJ-TGL-16G)购自北京鼎国生物技术有限公司;分光光度计(2800UV/VIS UNIK)购自美国GE公司;数码凝胶图像系统(GIS-2008)购自美国Biometra公司。
1.3 引物设计与合成 根据GenBank中登录的TBEV NS1基因序列(AY182009)设计引物,引物由华大基因公司合成。为构建表达载体,在上、下引物的5′端分别加入EcoRⅠ和XhoⅠ的酶切位点。NS12329:5′-TGCGAATTCGATGTTGGCTGTGCTGTGGA-3′;NS13384:5′-GAACTCGAGTGCCACTACCATTGAGCGAACA-3′(下划线处为酶切位点)。
1.4 目的基因的扩增 利用合成的引物,以质粒pMD19-T-NS1为模板,采用PCR技术扩增目的基因NS1,扩增条件为94℃、3min,94℃、30s,68℃、30s,72℃、60s,30个循环后 ,72℃延伸10min。
1.5 原核表达重组质粒pEASYTM-E1-NS1的构建 将NS1的PCR产物与表达载体pEASY TME1相连(目的片段与质粒载体的比例为7∶1),连接产物转化感受态细胞DH5α。挑取单克隆DH5α于10μL无菌水,取1μL混合于25μL PCR体系中。采用T7Promoter Primer和目的基因反向引物或用目的基因正向引物和T7Terminator Primer鉴定正确表达方向的阳性重组质粒。提取连接正确的阳性重组质粒并进行EcoRⅠ 和XhoⅠ 双酶切鉴定,利用T7Promoter Prime和T7Terminator Primer测序。
1.6 重组蛋白His-NS1的诱导表达与纯化 将测序正确的重组质粒pEASY TM-E1-NS1转化至大肠杆菌BL21感受态细胞,经0.5mmol·L-1于IPTG于37℃诱导表达后,取菌液离心收集菌体沉淀,进行10%SDS-PAGE分析,确定目的蛋白的表达。取上清液500mL行扩大培养,经IPTG诱导表达4h后,4℃、5000r·min-1离心10min,将沉淀重悬后超声破碎,4℃、12000r·min-1离心30min,取适量上清和沉淀进行10%SDS-PAGE分析。超声破碎细菌后将包涵体经1%Triton X-100洗2次,以10mL(8mol·L-1)尿素重悬,室温过夜。用0.45μm滤器过滤除去杂质。采用Ni-NTA树脂层析柱纯化蛋白,将蛋白样品上样于Ni柱,流速60滴·min-1,回收流出液,用5倍体积包涵体溶解液洗柱,3倍体积的20mmol·L-1咪唑洗脱杂蛋白,最后用3倍体积的500mmol·L-1咪唑洗脱目的蛋白。
1.7 重组蛋白His-NS1的 Western blotting分析将纯化后的重组蛋白进行SDS-PAGE电泳,然后将蛋白转移至PVDF膜上、封闭,用鼠抗His标签抗体作为一抗,AP标记的山羊抗鼠IgG作为二抗,BCIP/NBT显色。将经纯化后的蛋白稀释1倍,采用Bradford法测定蛋白浓度。利用标准品绘制标准曲线后,得出待测蛋白的浓度。用超滤管(相对分子质量为10000以下的蛋白被滤除)浓缩蛋白。
2 结 果
2.1 目的基因的扩增 根据TBEV NS1基因PCR产物经1%琼脂糖凝胶电泳分析,获得1条长度约为1056bp的基因片段,与预期片段大小一致。见图1。

图1 TBEV NS1基因PCR扩增结果Fig.1 PCR amplification result of TBEV NS1gene
2.2 原核表达重组质粒pEASYTM-E1-NS1的鉴定 由于表达载体pEASYTM-E1由pET载体改造而成,克隆的PCR产物有正向和反向2种。T7 Promoter Primer和目的基因反向引物通过PCR技术得到长度约为1200bp的基因片段(图2),该片段包括T7Promoter Primer至目的基因起始端的142bp和1056bp的目的基因。说明克隆的目的基因为正向连接。提取阳性重组质粒用EcoRⅠ及XhoⅠ 双酶切得到长度为5715bp的载体条带和长度为1056bp的目的条带(图3),进一步明确目的基因片段成功克隆至pEASYTM-E1表达载体。利用BLAST软件分析重组质粒的序列并与GenBank中相应的核苷酸序列进行比较,结果显示其同源性为100%。
2.3 重组蛋白His-NS1的表达和纯化 含重组质粒的细菌(pEASY TM-E1-NS1)经IPTG 诱导后,将细菌离心、煮沸,进行SDS-PAGE分析,在相对分子质量约40000处出现特征性表达带,而未诱导菌未见该特征性表达带(图4)。为进一步鉴定重组蛋白His-NS1的表达形式,通过超声破碎裂解含重组质粒的细菌,对上清和沉淀进行SDS-PAGE,电泳结果显示重组蛋白 His-NS1主要以包涵体形式存在于细菌中,而细菌培养物的上清中则无重组蛋白His-NS1(图5)。将超声破碎裂解后所得菌体沉淀 (包括包涵体)用含8mol·L-1尿素的裂解液溶解后,利用镍离子亲和层析柱纯化,再利用咪唑洗脱特异结合的蛋白,经10%SDS-PAGE分析表明,纯化的表达产物在相对分子质量约40000处显示出1条杂交蛋白带(图6)。将经纯化的蛋白稀释1倍,采用Bradford法测定蛋白浓度,绘制标准曲线,测得待测蛋白平均吸光度(A)值为0.140,根据标准曲线,得出待测蛋白的浓度约为220mg·L-1。采用超滤管为浓缩蛋白,经PBS重悬,最终获得浓度为5g·L-1的重组蛋白溶液。
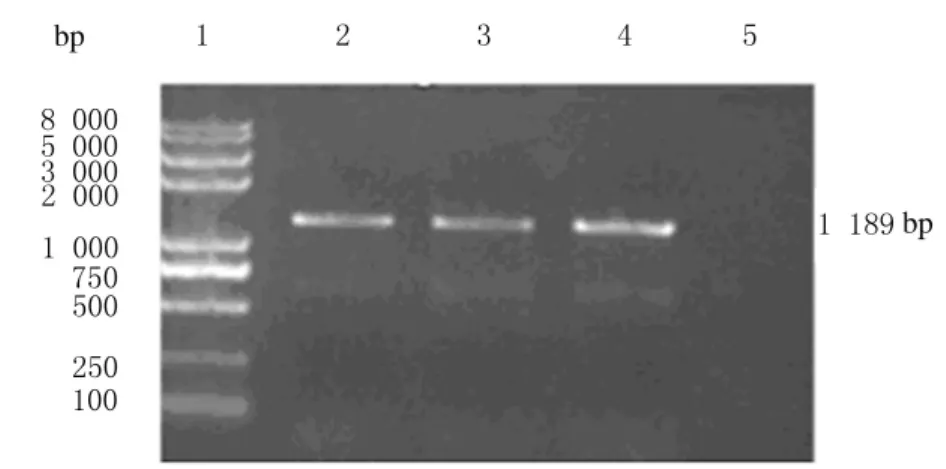
图2 重组质粒pEASYTM-E1-NS1的鉴定Fig.2 Identification of recombinant plasmid pEASYTME1-NS1

图3 重组质粒pEASYTM-E1-NS1的双酶切分析Fig.3 Analysis of recombinant plasmid pEASYTM-E1-NS1 digested by restrictive endonuclease
2.4 重组蛋白His-NS1的 Western blotting分析SDS-PAGE电泳后,将蛋白转移至PVDF膜上,用5%脱脂牛奶封闭,以鼠抗His标签抗体作为一抗,AP标记的山羊抗鼠IgG作为二抗,进行Western blotting分析,在相对分子质量约40000处可见1条蛋白杂交带,表明重组蛋白His-NS1能与特异的抗体反应(图7)。
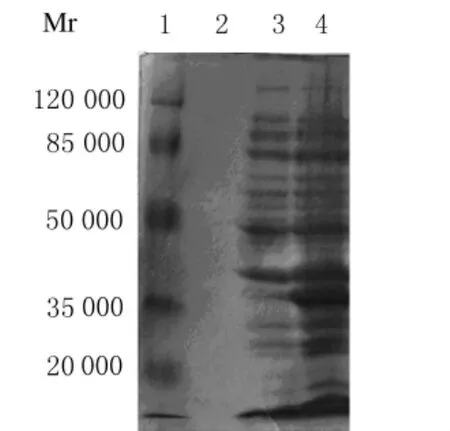
图4 超声裂解前细菌表达产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis of fungus expression product before ultrasound cracking
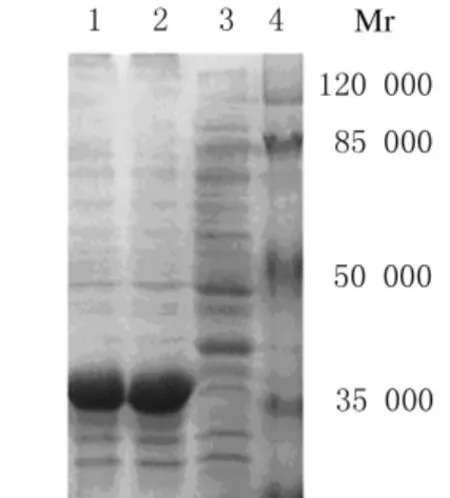
图5 超声裂解后细菌表达产物的SDS-PAGE分析Fig.5 SDS-PAGE analysis of fungus expression product after ultrasound cracking
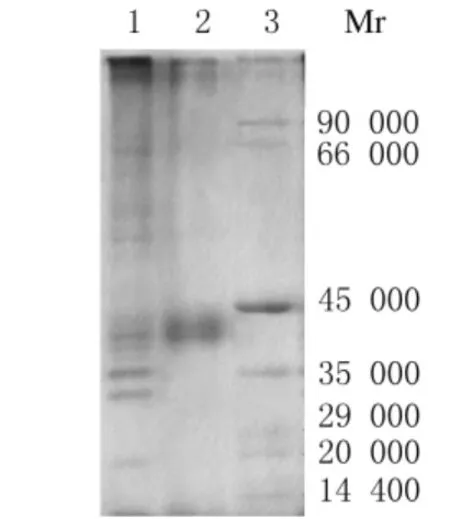
图6 重组蛋白His-NS1的纯化Fig.6 Purification of recombinant protein His-NS1

图7 重组蛋白His-NS1的Western blotting分析Fig.7 Western blotting analysis of recombinant protein His-NS1
3 讨 论
TBEV所引起的脑炎一般呈现2个感染阶段[7],在感染早期患者有发热、四肢无力、肌肉疼痛和伴有皮疹,随着病情的发展出现高热、头痛、恶心呕吐和脑炎或脑膜炎的临床表现,儿童患病的死亡率较高。TBEV和黄病毒的其他成员一样,借助包膜E蛋白感染靶细胞受体,病毒穿入细胞内释放病毒基因组,病毒开始大量复制并在细胞内质网和高尔基体中成熟,最后从细胞内释放并影响和破坏细胞的功能[8]。虽然TBEV感染机体后可诱发体液免疫和细胞免疫,但病毒和抗体结合后通过免疫球蛋白Fc段受体被巨噬细胞吞噬非但不能灭活病毒,且可使病毒在巨噬细胞内长期存在。另一方面,RNA病毒的多聚酶不具有自我修正功能,往往导致病毒E蛋白抗原的变异[9],是病毒形成免疫逃逸的机制之一。现已明确,西尼罗病毒(黄病毒成员)的NS1蛋白能抑制干扰素基因的转录[10],其机制是通过TLR3信号途径阻断β-干扰素的转录活化以及通过IRF3或NF-κB抑制IL-6的转录。登革病毒(黄病毒成员)的非结构蛋白(NS2A、NS2B、NS3、NS4A和NS4B)可以通过JAK/STAT信号途径[11-12]抑制干扰素的合成。而TBEV NS1在TLR3信号通路和干扰素合成抑制方面的研究未见报道。本研究利用基因工程方法构建了NS1基因表达载体pEASYTM-E1-NS1,为研究TBEV NS1的多样生物学功能提供实验基础。
pEASY TM-E1表达载体是由pET载体改造而成,可以在很短的时间内利用TA克隆技术克隆PCR产物,无需中间TA克隆技术环节,因此TBEV NS1的PCR产物直接连接至pEASY TME1表达载体,转染至感受态细胞后可进行目的基因表达。为确认正确表达方向的阳性重组质粒,利用T7Promoter Primer和目的基因反向引物通过PCR方法,同时采用限制性酶切分析阳性重组质粒,确定PCR产物的连接为正向连接。本文作者将含有TBEV NS1的表达载体(pEASY TM-E1)转染至大肠杆菌进行目的基因的表达。尽管基因工程表达系统已经从大肠杆菌扩展至真核细胞(如酵母细胞、昆虫、植物和哺乳动物细胞),但是大肠杆菌仍然是基因表达的有效工具。本研究旨在获得目的蛋白在原核细胞中的高效表达,而目的蛋白的表达受多种因素(诱导时间、诱导剂的浓度和温度等)的影响,本文作者最终确认最佳的表达条件是:IPTG浓度为0.5mmol·L-1,37℃诱导4h。经超声处理后,细菌包涵体通过变性,上清经镍离子亲和层析柱纯化再利用咪唑洗脱特异结合的蛋白,最后采用超滤管(相对分子质量10000以下的蛋白被滤除)浓缩蛋白,经PBS重悬,最终获得浓度为5g·L-1的重组蛋白溶液。高浓度TBEV NS1的获得,为进一步研究其多样的生物学功能奠定了基础。
[1]杨正时﹒TBEV传播的生态链 [J].中国微生态学杂志,2012,24(1):76-79.
[2]王 丹,康晓平,郝淮杰,等.TBEVTBE-E-D3抗原的原核表达纯化及ELISA方法鉴定 [J].生物技术通讯,2011,22(5):636-639.
[3]Poponnikova TV.The clinical picture of tick-born encephalitis in children[J].Int J Med Microbiol,2008,298(1):351-355.
[4]Suss J.Epidemiology and ecology of TBE relevant to the production of effective vaccines[J].Vaccine,2003,21(3):19-35.
[5]Rendi-Wangner P.Advances in vaccination against tick-borne encephalitis[J].Expert Rev Vaccinecs,2008,7(5):589-596.
[6]Wang T,Town T,Alexopoulou L,et al.Toll-like receptor 3mediates West Nile virus entry into the brain causing lethal encephalitis[J].Nat Med,2004,10(12):1366-1377.
[7]Dumpis U,Crook D and Okis J.Tick-born encephalitis[J].Clin Infect Dis,1999,28(4):882-890.
[8]Welsch S,Miller S,Romero-Brey I.Composition and threedimensional architecture of the dengue virus replication and assembly sites[J].Cell Host Microbe,2009,5(4):365-375.
[9]Ye J,Zhu B,Fu ZF,et al.Immune evasion strategies of flaviviruses[J].Vaccine,2013,31(3):461-471.
[10]Wilson JR,de Sessions PF,Leon MA,et al.West Nile virus nonstructural protein 1inhibits TLR3signal transduction[J].J Virol,2008,28(17):8262-8271.
[11]Takaoka A,Yanai H.Interferon signaling network in innate defence[J].Cell Microbiol,2006,8(6):907-922.
[12]Jones M,Davidson A,Hibbert L,et al.Dengue virus inhibits alpha interferon signaling by reduced STAT2 expression[J].J Virol,2005,79(9):5414-5420.

