间充质干细胞干性维持信号通路的研究进展
周 颖,高孟飞,朱慧勇
(1.浙江大学医学院附属第一医院口腔颌面外科,浙江 杭州 310003;2.浙江省慈溪市人民医院口腔科,浙江 慈溪 315300)
间充质干细胞(mesenchymal stem cell,MSC)是具有多向分化潜能的干细胞,能够诱导分化为多种组织,包括骨、软骨、脂肪、肌肉和肌腱等[1]。Owen和Friedenstein[2]最先报道从骨髓中分离得到一种能够分化为多种组织的类纤维细胞——MSC[2]。骨髓是MSC的常见来源,其他来源还包括脂肪、软骨、肌肉、羊水、肝脏、胎盘、脐血和牙髓等[3-4]。国际细胞治疗协会提供了以下的最低标准用于定义人类MSC[5]:①标准培养条件下的塑料贴壁细胞;②表面标志物CD105、CD73和CD90表达阳性,而缺乏CD34、CD45、CD11a、CD19和HLA-DR等造血干细胞的表面标志物的表达;③特定的刺激下,细胞在体外可分化为成骨细胞、脂肪细胞和软骨细胞。MSC干性即多能性,即MSC能够多向分化的能力[6]。MSC干性的维持依赖于细胞的自我更新,即在MSC非分化性增殖的同时抑制细胞的凋亡并保持其多向分化的潜能[7]。MSC的可获得性、可扩张性和可分化性使其在临床治疗和组织工程中具有广泛的应用前景[3]。而MSC的有效应用有赖于了解并认识维持干性的信号通路分子机制。
1 MSC的应用前景
MSC的多向分化潜能和免疫抑制的特性使其在临床上具有良好的应用前景。已有大量研究[4-8]报道了 MSC在组织修复和再生方面的应用。通过扩增培养,MSC可以迁移到受伤的组织并调节炎症反应,通过协同下调炎性细胞因子和促生长因子及上调抗炎因子,从而有利于组织修复。在再生医学方面,MSC在一定诱导条件作用下可以定向分化为中胚层和内、外胚层组织细胞,许多组织工程产品,如人造皮肤、血管、骨、软骨、肌肉、瓣膜、神经、胰岛、肾脏和肝脏等组织器官或细胞将相继问世,被植入患者体内,用以恢复损伤、替代退行性组织器官以及改变遗传缺陷性组织器官的功能[8-10]。此外,MSC具有显著的免疫抑制特性,能够抑制T细胞、NK细胞的功能,并调节树突状细胞的活动[8]。基于其免疫抑制特性,MSC被用于在移植物抗宿主病和自身免疫病的治疗[11-12]。
2 MSC的干性基因
应用全球基因表达分析,Song等[6]通过对比3种间充质谱系(成骨、成软骨和成脂肪)的未分化、分化和转分化的细胞,鉴定出一系列与维持MSC的多能性密切相关的干性相关基因。小干扰RNA基因失活研究[6]表明:肌动蛋白丝相关蛋白(actin filament-associated protein,AFAP)、frizzled 7(FZD7)、dickkopf 3(DKK3)、蛋白酪氨酸磷酸酶受体F(protein tyrosine phosphatase receptor F,PTPRF)和RAB3B5种基因能促进细胞存活并对骨髓MSC的分化有不同的影响[6]。有研究[13-15]还报道:一些胚胎干细胞标记物,如Oct-4、SOX-2、Rex-1和 Nanog与 MSC的自我更新有关联。Liu等[13]研究发现:Nanog和Oct4在 MSC中的过表达能够促进细胞的增殖并增强MSC集落形成,表明Nanog和Oct4的过表达与 MSC的干性维持有关联。Roche等[16]通过特定的培养基在体外培养 MSC发现:MSC中的Oct-4、Rex-1和Gata-4表达增高,认为这种表达增高可能与 MSC向成骨、成软骨分化的效率增高有关联。Bmi-1(B cellspecific MLV intergration site-1)基因是polycom(PcG)家族成员之一,对于维持发育过程中的基因表达模式,维持体细胞和肝细胞的正常生命活动均具有重要调节作用[17]。有研究[17-18]指出:Bmi-1基因可能是影响 MSC增殖能力的一个重要基因,包括骨髓MSC和脐血MSC。王芳等[19]认为:Bmi-1基因正性调控人类胚胎骨髓来源MSC的增生,并防止衰老,当细胞内Bmi-1的转录水平下降时,细胞增生减慢,衰老细胞数量显著增加。
3 MSC干性维持的信号通路机制
3.1 Wnt信号通路 Wnt信号在维持MSC的自我更新及其分化方面具有重要作用[20]。Wnts是高度保守的,富含半胱氨酸的分泌配体,到目前为止,已确定存在人类中的有19个。Wnt信号能够激发至少4种不同的信号通路,最具特色是其经典通路,该通路通过调节β-链蛋白(β-catenin)的稳定,导致下游靶基因的转录[20](图1)。当在无 Wnt配体的情况下,β-catenin在糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)、轴蛋白(Axin)和腺瘤性息肉蛋白(adenomatous polyposis coli,APC)协同作用下,被GSK-3β磷酸化,使β-catenin泛素化后通过蛋白酶体降解。但当Wnt配体与Frizzled(Fz)受体和脂蛋白受体相关蛋白(lipoprotein receptor-related protein,LRP)辅助受体(LRP5/6)结合时,激活了胞质蛋白(disheveled,DVL),抑制了GSK-3β对β-catenin的磷酰化作用,使β-catenin稳定并累积增加,转运入细胞核中与T细胞因子和淋巴增强因子(TCF/LEF)结合,以调节靶基因的转录[20]。
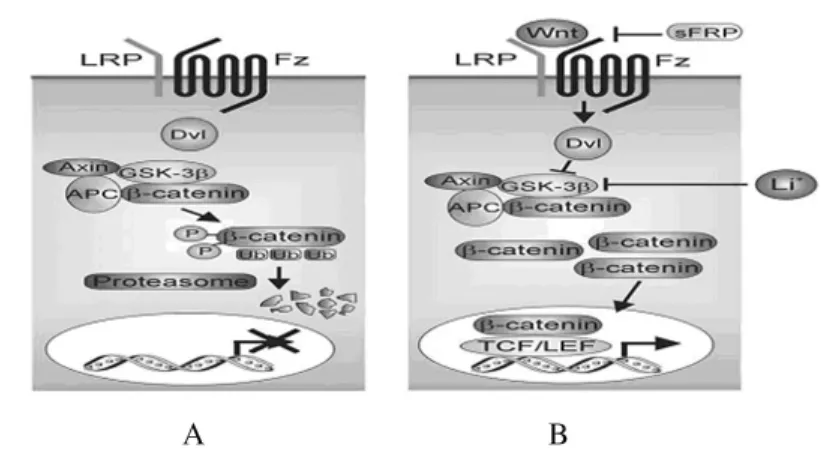
图1 经典Wnt信号通路Fig.1 The classic Wnt signaling pathway
Wnt信号通路可以通过多种方式被抑制。Dikkopf-1(DKK-1)是一种 Wnt抑制剂,其通过与LRP5/6受体形成络合物,从而促进受体的降解[20-21];分泌型卷曲相关蛋白(secreted frizzled-related protein,sFRPs)与 FZ 竞争 Wnt信号配体的结合,阻止其与受体的相互作用抑制Wnt信号[22-23];pyrvinium为强效 Wnt信号抑制剂,其能通过减少细胞质β-catenin,抑制其成骨和成软骨,促进MSC在体外的增殖[24]。然而,基于多种因素的影响,Wnt信号通道对MSC自我更新的作用也众说纷纭。Boland等[25]认为:经典的Wnt信号通路能够维持MSC的非分化性增殖,而非经典的Wnt信号通道能够促进MSC的成骨。但Qiu等[26]发现:在旁分泌或自分泌的方式下,经典 Wnt信号抑制人类骨髓MSC的增殖。De等[27]认为:低水平 Wnt信号通路能促进MSC增殖,但高水平Wnt信号有相反的影响,并导致MSC生长停滞。
3.2 骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路 BMP是干细胞的重要调控者[28-29],BMP作为一种多功能细胞因子,被鉴定为转化生长因子β(transforming growth factor-β,TGF-β)超家族的成员[30]。BMP受体(BMPR)有2种亚型,分别为BMPR-Ⅰ和BMPR-Ⅱ,均为丝氨酸-苏氨酸激酶受体。当 BMP与BMPR-Ⅱ结合时,BMPR-Ⅰ形成活化的四元复合物,然后磷酸化激活细胞内的Smad蛋白,Smad受体与co-SMAD蛋白结合并转位到细胞核中,充当转录因子,与转录共活化剂或抑制剂作用以调节基因表达[1,7,29-30]。
Kolf等[14]认为:在分子水平上,BMP与调节干细胞的分化过程相关。BMP信号通路通过BMP配体诱导或抑制MSC成骨的分化,也能诱导MSC成软骨。Liu等[31]认为:BMP-2能通过特定BMP的R-Smad蛋白与Dishevelled-1的相互作用以拮抗Wnt3a的信号从而抑制小鼠骨髓来源的MSC增殖,可能通过抑制BMP信号通道,提高MSC的自我更新。虽然尚无大量的实验数据证实BMP信号在MSC自我更新方面的作用,但有研究[28]表明BMP有利于小鼠和人胚胎干细胞的自我更新。也有研究[7]显示:一种 Wnt信号抑制剂即分泌型卷曲相关蛋白2(secreted frizzledrelated protein 2,sRP2)可以通过抑制 Wnt和BMP信号转导通路,降低MSC凋亡并抑制MSC成骨和成软骨分化,增加干细胞的自我更新和存活。
3.3 Notch信号通路
Notch信号通路是另一个参与调节细胞命运的重要的途径[32]。Notch本身是一种跨膜受体,当Notch在相邻细胞表面上与膜结合配体Delta或Jagged作用,Notch胞内结构域(Notch intracellular domain,NICD)通过g-分泌从膜上被蛋白水解裂解,然后NICD转位到细胞核中,配合并激活转录因子CSL。CSL招募共激活因子 Mastermind-like(MAML)等,并启动转录的靶基因[1,32]。Notch的蛋白水解裂解是一个多步骤的过程,涉及γ-分泌酶复合物素-1和γ-分泌酶复合物素-2[32]。
有研究[32]表明:Notch在MSC分化世系中发挥重要作用,在小鼠软骨细胞和成骨细胞的细胞系中,高表达Notch配体(Delta-1)或NICD抑制了成骨细胞和软骨细胞的分化,而Notch信号通路在脂肪细胞形成中的作用尤为复杂。微阵列基因表达分析研究显示:在人MSC分化过程中,与Notch信号通路相关的基因表达量会随着分化的进行而改变。Westwood等[32]研究了Notch信号在调节MSC增殖和分化中的作用,结果显示:在增殖的MSC中添加DAPT,能降低MSC的增殖能力并改变其分化潜能。DAPT是一个特定的γ-分泌酶抑制剂,能在体外抑制软骨形成,但能诱导MSC向脂肪细胞的分化。也有学者[1]认为:Notch信号可能会促进成骨分化,但不一定促进骨形成。在NICD过表达的转基因小鼠中,Notch成骨细胞特异性功能的增加会导致骨质异常密集或硬化骨,而通过突变γ-分泌使Notch信号缺失会导致迟发性、与年龄有关的骨质疏松症[1]。这些相互矛盾结果的出现可能是由于调节成骨细胞分化的时间点不同或特定剂量的Notch激活和(或)其与Wnt和BMP信号通路的交互影响。因此Notch信号有可能通过影响MSC的分化而调节MSC自我更新。
3.4 成纤维细胞生长因子(fibroblast growth factor,FGF)对MSC干性的调节 FGF是普遍应用于促进干细胞增殖的生长因子,包括人胚胎干细胞、MSC以及其他特定组织的干细胞[33-34]。在 MSC培养过程中添加FGF能够增加MSC的增殖速度和寿命,同时不改变其分化的潜能[34]。FGF信号在MSC的增殖和分化中起着至关重要的作用,在小鼠骨髓MSC中,FGF-2已被证实为一种强效有丝分裂原[35]。Ng等[3]采用转录组分析发现:TGF-β、血小板源性生长因子(platelet-derived growth factor,PDGF)和FGF介导的信号转导通路在MSC增殖中发挥重要作用。抑制上述任何信号均能降低MSC生长,而这3个因素的组合,能使MSC在体外培养传代至5代以上,表明这些信号转导途径对MSC生长有重要作用。
FGF家族由22个显现为高度同源性的配体组成,有4个已知的 FGF受体[33-35]。有研究[33]显示:FGF受体发起的主要信号转导途径是通过FRS2控制中心激活Ras2α/ERK信号通路,FGF-ERK轴能通过多种模式控制干细胞的干性。Coutu等[35]认为:FGF-2能够通过 PI3K/AKTMDM2通路抑制细胞衰老并促进其增殖以维持MSC干性。MDM2在Ser186细胞中被AKT/PI3磷酸化,导致MDM2的核转位。在细胞核中,pMDM2增加针对p53基因的泛素连接酶活性,使后者被蛋白酶体降解,从而抑制细胞衰老。因此,FGF-2能够保护MSC免于增殖诱导的细胞衰老并无限增殖,FGF-2在MSC的自我更新和干性的维持方面发挥了关键作用[35]。
3.5 Hedgehog(Hh)信号通路 Hh信号通路对胚胎干细胞的分化和生长发育早期的骨骼形成有重要作用,已有研究[1]报道:Hh通过Runx2诱导成骨,且能联合BMP-2对MSC成骨产生协同作用。Plaisant等[36]研究发现:骨髓MSC分化后导致Hh信号下降,刺激Hh信号并未对人MSC的增殖产生影响,而抑制Hh信号能够降低人MSC的增殖和克隆形成(自我更新的一个指标),阐明了Hh与MSC的增殖、自我更新和分化有关联。
当Hh结合到其受体Patched(Ptc)时,就启动了Hh信号。一经结合,Ptc解除了其对跨膜蛋白Smoothened(Smo)的抑制作用。然后Smo进入细胞的初级纤毛(对Hh信号有关键作用的细胞器),激活细胞内的级联而使转录因子Gli2稳定,Gli2进入细胞核诱导Hh目标基因的转录,例如Gli1(一个Hh信号标志)。Gli2是Hh信号的一个关键组分,Gli2的失活能抑制Hh信号通路[1,36]。
3.6 TGF-β信号通道 TGF-β及其家族成员,包括BMP、Nodal和激动素被广泛应用于各种器官的生长和维持,而干细胞在其中起着重要作用。TGF-β家族信号对胚胎干细胞干性的维持和自我更新具有重要作用。已有研究[29]报道:TGF-β1能诱导hMSC增殖。TGF-β1能通过诱导 MSC的Smad3-依赖核积聚β-连环素,而β-连环素是MSC增殖的刺激物。Ng等[3]通过转录组分析提出:TGF-β、PDGF和FGF信号通路对MSC增殖有重要作用。这些信号通路的任一信号的抑制均能降低MSC增殖,而3种因子的结合能使MSC多代传代,提示这些信号通路对MSC的生长有重要作用。
3.7 磷酸酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)信号通路 PI3K是1个包括许多脂质激酶的家族,由1个调节亚基(P85)和1个催化亚基(P110)组成。当相应的配体和膜受体结合后,激活P85募集P110在细胞膜附近使其活化,进而催化膜内表面的磷酸激醇二磷酸(PIP2)生成磷酸激醇三磷酸(PI3P)。PI3P作为第二信使,激活AKT(PI3K的重要下游分子)和磷脂酰肌醇依赖性激酶1(phosphoinositide-dependent kinase 1,PDK1)。AKT是PI3K重要的下游分子,对于调控细胞的大小、生长、增殖、存活和糖代谢均有重要作用。当AKT激活后,磷酸化结节性硬化复合物2(TSC2),从而解除TSC1/2对Rheb的抑制,由Rheb活化雷帕霉素靶蛋白(target of rapamycin,mTOR)。mTOR激活下游靶蛋白,对细胞生长和代谢进行调控。第10号染色体丢失的磷酸酶(phosphatase and tensin homolog deleted on chromosome ten,PTEN)基因位于人染色体杂合体缺失高发区10q2313上,其可通过将PI3P去磷酸化为PIP2实现对PI3K负调节作用[37]。
近来研究[37-38]表明:PI3K通路对于维持胚胎干细胞存活、增殖和维持其分化发挥重要作用。对PI3K信号通路起负调控作用的PTEN缺失时,可导致MSC增殖速度明显加快。除了对胚胎干细胞的增殖作用外,PI3K能促进细胞的自我更新能力以维持胚胎干细胞的未分化状态。此外,有研究[37]显示:通过应用mTOR特异性阻断剂rapamycin阻断该通路在MSC中的活化,观察到MSC的成骨分化明显受到抑制,表明PI3K-AKT-mTOR信号通路的活化在MSC的成骨分化方面发挥重要作用。
综上所述,MSC干性维持的内在分子通路机制仍存在争议,其结果也尚无定论。这些可变性可能源于多种原因,如MSC的来源、相互作用的配体或蛋白质的量、特定的时序和各种信号通道之间的相互影响等。因此,MSC内在的分子机制尚需进一步研究。
[1]Lin GL,Hankenson KD.Integration of BMP,Wnt,and Notch signaling pathways in osteoblast differentiation [J].J Cell Biochem,2011,112(12):3491-3501.
[2]Owen M,Friedenstein AJ.Stromal stem cells:Marrowderived osteogenic precursors[J].Ciba Found Symp,1988,136:42-60.
[3]Ng F,Boucher S,Koh S,et al.PDGF,TGF-βand FGF signaling is important for differentiation and growth of mesenchymal stem cells(MSCs):transcriptional profiling can identify markers and signaling pathways important in differentiation of MSCs into adipogenic,chondrogenic,and osteogenic lineages [J].Blood,2008,112(2):295-307.
[4]Salem HK,Thiemermann C.Mesenchymal stromal cells:Current understanding and clinical status [J].Stem Cells,2010,28(3):585-596.
[5]Horwitz EM,Le Blanc K,Dominici M,et al.Clarification of the nomenclature for MSC:The International Society for Cellular Therapy position statement [J].Cytotherapy,2005,7(5):393-395.
[6]Song L,Webb NE,Song Y,et al.Identification and functional analysis of candidate genes regulating mesenchymal stem cell self-renewal and multipotency [J].Stem Cells,2006,24(7):1707-1718.
[7]Alfaro MP,Vincent A,Saraswati S,et al. sFRP2 suppression of bone morphogenic protein(BMP)and Wnt signaling mediates mesenchymal stem cell(MSC)self-renewal promoting engraftment and myocardial repair [J].J Biol Chem,2010,285(46):35645-35653.
[8]SensebéL,Krampera M,Schrezenmeier H,et al.Mesenchymal stem cells for clinical application [J].Vox Sang,2010,98(2):93-107.
[9]李建鑫,杨 亮,王文良.脂肪间充质干细胞在组织工程中的应用 [J].中国组织工程研究与临床康复,2010,14(7):1274-1277.
[10]陈润良,刘 磊,裴英波.骨髓间充质干细胞在多学科领域的研究 [J].中国组织工程研究与临床康复,2009,13(6):1143-1146.
[11]Trento C,Dazzi F. Mesenchymal stem cells and innate tolerance:biology and clinical applications [J].Swiss Med Wkly,2010,140:13121.
[12]寿培舜,黄 寅,苏娟娟,等.间充质干细胞免疫抑制机制及在疾病中的应用 [J].细胞生物学杂志,2009,31(1):15-20.
[13]Liu TM,Wu YN,Guo XM,et al.Effects of ectopic Nanog and Oct4overexpression on mesenchymal stem cells [J].Stem Cells Dev,2009,18(7):1013-1022.
[14]Kolf CM,Cho E,Tuan RS.Biology of adult mesenchymal stem cells: regulation of niche,self-renewal and differentiation [J].Arthritis Res Ther,2007,9(1):204.
[15]Greco SJ,Liu K,Rameshwar P.Functional similarities among genes regulated by Oct4in human mesenchymal and embryonic stem cells [J].Stem Cells,2007,25(12):3143-3154.
[16]Roche S,Richard MJ,Favrot MC.Oct-4,Rex-1,and Gata-4expression in human MSC increase the differentiation efficiency but not hTERT expression [J].J Cell Biochem,2007,101(2):271-280.
[17]顾建娟,韩素萍,李晓波.Bmi-1基因在脐血间充质干细胞增殖中的作用 [J].临床儿科杂志,2009,27(7):673-677.
[18]刘 娜,李文磊,贾 鹏,等.BMI1基因表达与人骨髓间充质干细胞增殖关系的探讨 [J].南京医科大学学报:自然科学版,2008,28(6):717-721.
[19]王 芳,王 旸,赵春松,等.Bmi-1基因对人胚骨髓间充质细胞增殖和衰老的作用 [J].首都医科大学学报,2011,32(1):60-66.
[20]Etheridge SL,Spencer GJ,Heath DJ,et al.Expression profiling and functional analysis of Wnt signaling mechanisms in mesenchymal stem cells [J].Stem Cells,2004,22(5):849-860.
[21]Glinka A,Wu W,Delius H,et al.Dickkopf-1is a member of a new family of secreted proteins and functions in head induction [J].Nature,1998,391(6665):357-362.
[22]Leyns L,Bouwmeester T,Kim SH,et al.Frzb-1is a secreted antagonist of Wnt signaling expressed in the Spemann organizer[J].Cell,1997,88(6):747-756.
[23]Wang S,Krinks M,Lin K,et al.Frzb,a secreted protein expressed in the Spemann organizer,binds and inhibits Wnt-8 [J].Cell,1997,88(6):757-766.
[24]Saraswati S,Deskins DL,Holt GE,et al.Pyrvinium,a potent small molecule Wnt inhibitor,increases engraftment and inhibits lineage commitment of mesenchymal stem cells(MSCs) [J].Wound Repair Regen,2012,20(2):185-193.
[25]Boland GM,Perkins G,Hall DJ,et al.Wnt 3apromotes proliferation and suppresses osteogenic differentiation of adult human mesenchymal stem cells [J].J Cell Biochem,2004,93(6):1210-1230.
[26]Qiu W,Andersen TE,Bollerslev J,et al.Patients with high bone mass phenotype exhibit enhanced osteoblast differentiation and inhibition of adipogenesis of human mesenchymal stem cells [J].J Bone Miner Res,2007,22(11):1720-1731.
[27]De BJ,Wang HJ,Van BC.Effects of Wnt signaling on proliferation and differentiation of human mesenchymal stem cells [J].Tissue Eng,2004,10(3/4):393-401.
[28]Varga AC,Wrana JL.The disparate role of BMP in stem cell biology [J].Oncogene,2005,24(37):5713-5721.
[29]Watabe T,Miyazono K.Roles of TGF-βfamily signaling in stem cell renewal and differentiation [J].Cell Res,2009,19(1):103-115.
[30]Celeste AJ,Iannazzi JA,Taylor RC,et al.Identification of transforming growth factor beta family members present in bone-inductive protein purified from bovine bone [J].Proc Natl Acad Sci U S A,1990,87(24):9843-9847.
[31]Liu X,Tang Y,Qiu T,et al. A dishevelled-1/Smad1 interaction couples WNT and bone morphogenetic protein signaling pathways in uncommitted bone marrow stromal cells [J].J Biol Chem,2006,281(25):17156-17163.
[32]Westwood C,Clements MO. The biology of human mesenchymal stem cells[J].Stem Cell Repair Regen,2008,3:1-19.
[33]Gotoh N.Control of stemness by fibroblast growth factor signaling in stem cells and cancer stem cells [J].Curr Stem Cell Res Ther,2009,4(1):9-15.
[34]Tsutsumi S,Shimazu A,Miyazaki K,et al.Retention of multilineage differentiation potential of mesenchymal cells during proliferation in response to FGF [J].Biochem BiophysRes Commun,2001,288(2):413-419.
[35]Coutu DL,Francois M,Galipeau J.Inhibition of cellular senescence by developmentally regulated FGF receptors in mesenchymal stem cells [J].Blood,2011,117(25):6801-6812.
[36]Plaisant M,Giorgetti-Peraldi S,Gabrielson M,et al.Inhibition of hedgehog signaling decreases proliferation and clonogenicity of Human mesenchymal stem cells [J].PloS One,2011,6(2):e16798.
[37]孟 艳,米蕊芳,赵春华.PI3K-AKT-mTOR信号通路在细胞分化中的作用 [J].基础医学和临床,2007,27(12):1404-1408.
[38]周睿卿,龚玉萍,邢宏运,等.人胚胎干细胞Pten基因表达及PI3K/Akt/mTOR信号通路下游蛋白的磷酸化 [J].中国组织工程研究与临床康复,2011,15(49):9207-9210.

