NDM1基因常规PCR与荧光定量PCR检测方法的建立及其检测结果比较
陈宣男,全首祯
(1.中国医学科学院阜外心血管病医院临床检验中心,北京 100037;2.空军总医院临床检验中心,北京 100142)
日益严重的抗生素耐药性已经成为临床感染治疗和人类健康所面临的最大挑战[1]。新德里金属-β-内酰胺酶1(new delhi metallo-β-lactamas 1,NDM1)基因编码1种新型金属-β-内酰胺酶,这种酶可以使其宿主菌耐受β-内酰胺酶类[2]、头孢类、碳氢霉烯类和氨基糖苷类抗生素等绝大多数抗生素,人们将携带这种基因的细菌称为“超级细菌”[3]。产NDM1型细菌多为革兰阴性菌,诸如大肠杆菌或者肺炎克雷伯杆菌等。革兰阴性菌具有不能渗透抗生素的物理屏障、可以通过“外排系统”泵出胞内抗生素、与抗生素结合的靶点易发生变异以及能够产生分解抗生素的特异性酶等多重耐药机制[4]。NDM1的基因长度为813bp[5],编 码NDM1酶的基因位于1个长度为140000bp的质粒上。质粒是游离于细菌DNA基因组之外、可移动的遗传原件,能够在不同种属细菌间发生转移,从而导致耐药性在细菌中的扩散[6-7]。携带NDM1质粒的细菌主要是医院感染相关的细菌。另外,NDM1感染患者通过环境传播、医护人员的接触传播均能造成耐药菌的扩散感染[8-9],使院内感染面临前所未有的挑战。本研究旨在建立快速、准确的NDM1常规PCR和荧光定量PCR(FQ-PCR)的临床检测方法,并对两者的特异性、灵敏度和模拟临床样品检测结果进行比较。
1 材料与方法
1.1 菌株和临床标本
鲍曼不动杆菌(含NDM1基因)、感受态大肠杆菌DH5α、金黄色葡萄球菌、绿脓杆菌、肺炎克雷白菌、恶臭假单胞菌、沙门氏菌和福氏痢疾杆菌为本实验室保存或分离,临床模拟样本均为健康体检患者的新鲜血液、粪便、尿液和痰液标本。
1.2 主要试剂及仪器
Trans Taq、2×Easypfu PCR SuperMix DNA聚合酶购自全氏金公司;普通PCR Marker均采用DL 2000,购自TaKaRa公司;1×Taq、2×Taq PCR Mix胶回收试剂盒、质粒提取试剂盒和Real Master Mix(SYBR Green)试剂盒为Tiangen公司产品。Biometra PCR仪、Bio-Rad iQ5FQ-PCR仪均购自Bio-Rad公司。引物设计和测序均由华大基因公司完成。
1.3 常规PCR和FQ-PCR检测方法的建立
1.3.1 常规PCR检测方法 根据NCBI上公布的NDM1基因序列,利用DNAMAN软件设计3对普通PCR引物,扩增NDM1基因,引物序列和PCR反应条件见表1。PCR产物进行1%琼脂糖凝胶电泳检测。
1.3.2 FQ-PCR检测方法 根据 NCBI上公布的NDM1基因序列,利用DNAMAN软件设计3对FQ-PCR引物(普通PCR的引物3F/3R与FQ-PCR的引物Y3F/Y3R为同一对引物)。采用两步法行FQ-PCR扩增。引物序列和PCR反应条件见表1。
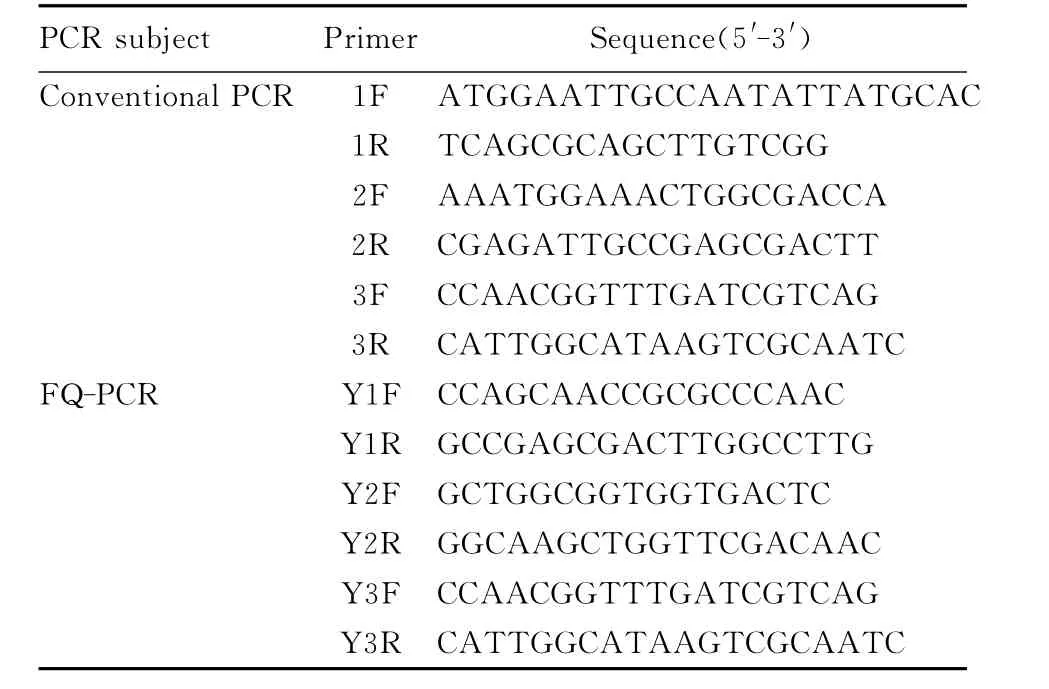
表1 PCR引物序列Tab.1 Sequences of PCR primers
1.4 常规PCR和FQ-PCR特异性实验
特异性实验以鲍曼不动杆菌(含NDM1)菌液为实验样品,大肠杆菌、金黄色葡萄球菌、绿脓杆菌、肺炎克雷白菌、恶臭假单胞菌、沙门氏菌和痢疾杆菌为对照样品,采用最适引物按照最佳条件分别进行常规PCR和FQ-PCR扩增。
1.5 常规PCR和FQ-PCR灵敏性实验
测定鲍曼不动杆菌(含NDM1)菌液在波长为600mn处的吸光度(A600)值,进行10倍系列稀释,以不同稀释度(1.0×108mL-1~1.0×10mL-1)菌液为模板进行常规PCR和FQ-PCR扩增,检测其灵敏度。FQ-PCR扩增绘制标准曲线,确定其检测线性梯度范围。
1.6 临床模拟样本的检测
将临床样本(血液、粪便、尿液和痰液)分成同等重量的2份,其中1份按浓度106mL-1混入鲍曼不动杆菌菌液,并混合均匀作为模拟样本,另1份作为对照。将2组样本作为模版,按最适条件分别进行常规PCR和FQ-PCR,检测临床样本是否对检测结果造成干扰。
2 结 果
2.1 经条件优化后常规PCR检测方法
以鲍曼不动杆菌液为模板,使用设计的3对不同引物分别行PCR扩增NDM1基因,产物进行1%琼脂糖凝胶电泳分析,2对引物均能扩增出不同长度的NDM1基因目的片段,其中引物对3F/3R扩增特异性最好,且扩增片段最短,因而PCR反应所需时间最短,故选定3F/3R作为PCR反应引物对。经条件优化确定常规PCR检测反应体系为:2×Easypfu PCR Super Mix 10μL,dH2O 9.8μL,引物3F/3R各1μL,菌液模板0.2μL,总体积20μL。反应条件为:94℃、5min;94℃、30s,53℃、20s,72℃、20s,30个循环;72℃、5min。见图1。
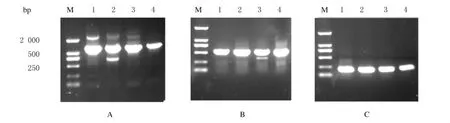
图1 目的基因片段的常规PCR扩增产物电泳图Fig.1 Electrophoregram of amplification product of conventional PCR of target gene fragment
2.2 经条件优化FQ-PCR检测方法
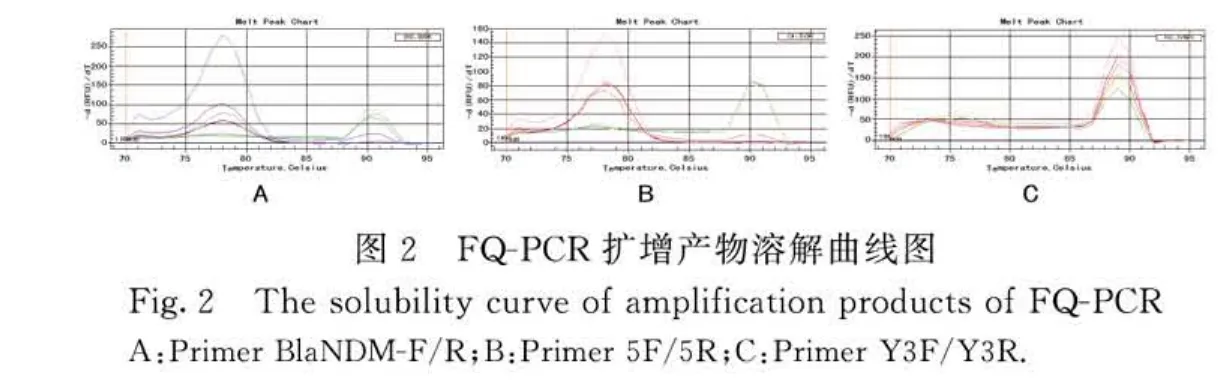
使用设计的3对不同引物,应用两步法分别进行FQ-PCR扩增。扩增产物溶解曲线表明:使用引物对 Y3F/Y3R扩增特异性最好,故选定Y3F/Y3R作为PCR反应引物对。经条件优化确定FQ-PCR反应体系为:dH2O 12.5μL,2.5×Master Mix 10μL,20×SYBR Green 1.25μL,引物Y3F/Y3R各0.5μL,NDM菌液模板0.25μL,总体积25μL。反应条件为:95℃、2min,1个循环;95℃、10s,60℃、20s,40个循环;95℃、1min,1个循环;70℃~95℃、6s,26个循环;25℃、5s,1个循环。见图2(封三)。
2.3 特异性实验
2.3.1 常规PCR 常规PCR特异性实验中只有阳性对照鲍曼不动杆菌(NDM1)菌液样品特异性扩增出目标条带,其他菌液样品均为阴性,表明常规PCR检测方法具有良好的特异性。见图3。
2.3.2 FQ-PCR FQ-PCR 特异性实验中只有阳性对照鲍曼不动杆菌(NDM1)菌液样品特异性扩增出目的条带,其他菌液样品均为阴性,表明FQ-PCR检测方法具有良好的特异性。见图4(封三)。

2.4 灵敏性实验
2.4.1 常规PCR 以10倍系列稀释的鲍曼不动杆菌(NDM1)菌液为模版进行常规PCR,产物经1%琼脂糖凝胶电泳分析,最低检测菌液浓度为1.0×106mL-1。见图5。
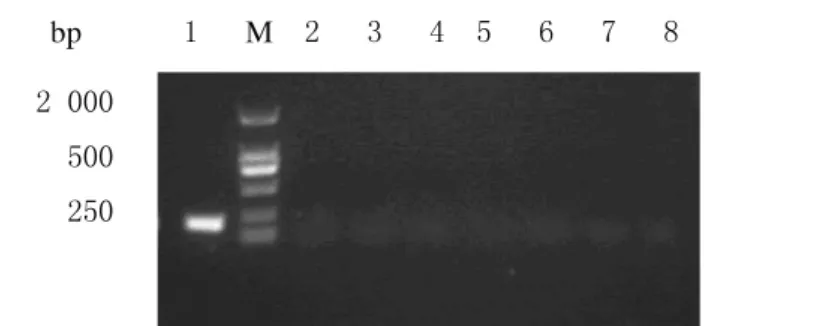
图3 常规PCR的特异性实验电泳图Fig.3 Electrophoregram of specificity testing of conventional PCR
2.4.2 FQ-PCR 以10倍系列稀释的鲍曼不动杆菌(NDM1)菌液为模板进行FQ-PCR扩增,结果显示:该方法能够检测细菌数下限为104mL-1。以Ct值为Y轴,不同菌液浓度对数为X轴绘制标准曲线,Y=4.456X-5.023,R2>0.99,显示在(104~107)mL-1FQ-PCR有良好的线性关系,可对模板进行准确定量。见图6(封三)。
2.5 模拟临床样本检测
分别选择临床样本(血液、粪便、尿液和痰液)各4份,按107mL-1加入鲍曼不动杆菌(NDM1)菌液并混合均匀作为模拟样本,以未加菌液的同样样本作为对照,分别进行常规PCR和FQ-PCR检测,所有对照临床样本均为阴性,而加有鲍曼不动杆菌(NDM1)菌液的样本均为阳性,说明常规PCR和FQ-PCR方法具有临床检测适用性。见图7和表2。
3 讨 论
2010年9月卫生部会同总后卫生部和国家中医药管理局共同组织专家制定的 《产NDM-1泛耐药肠杆菌科细菌感染诊疗指南(试行版)》中指出:产NDM-1细菌的实验室诊断包括表型筛查、表型确认和基因确证3个步骤[4,10-11]。传统的细菌检测主要通过分离培养的方法,该法耗时长、检测步骤多,并受多方面条件因素制约,其灵敏度和特异性易受影响。如今随着分子生物学技术的高速发展,多数医院具备普通PCR或FQ-PCR检测所需设备。FQ-PCR既具备普通PCR的核酸扩增的高效性、高特异性,又同时具备可定量的优势,广泛应用于基因检测[12-13]。
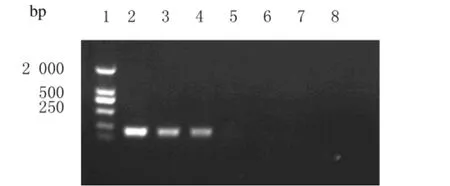
图5 常规PCR的灵敏性实验电泳图Fig.5 Electrophoregram of sensitivity testing of conventional PCR

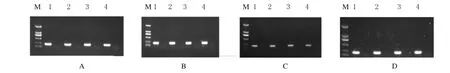
图7 普通PCR检测模拟临床样品电泳图Fig.7 Electrophoregram of simulative clinical samples detected by conventional PCR
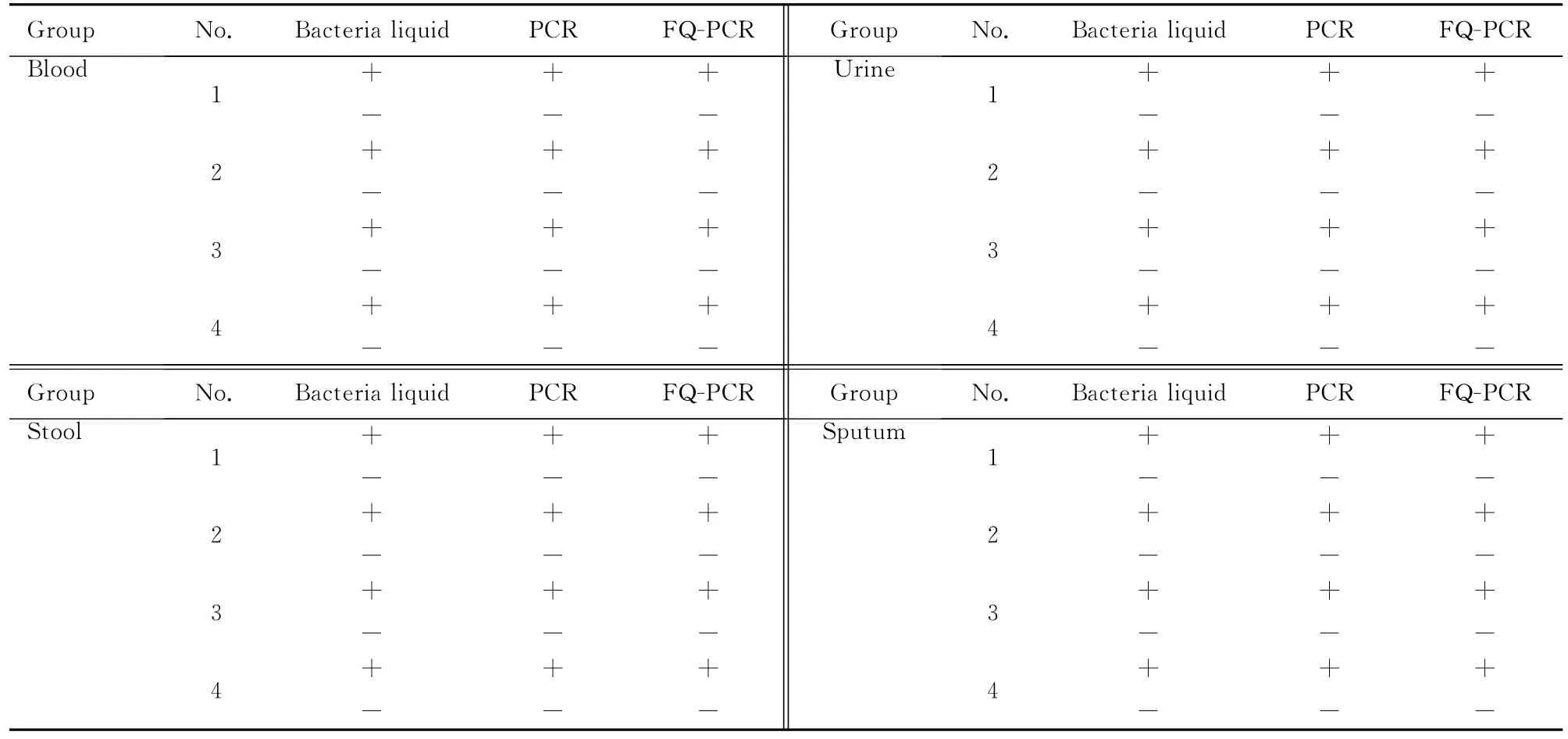
表2 模拟临床样品检测结果Tab.2 The detection results of simulative clinical samples
国内外已有PCR、FQ-PCR[14]和 LAMP等[15]方法检测NDM1的相关报道,本研究首次对普通PCR方法和FQ-PCR方法检测NDM1的灵敏度、特异性和临床模拟样本的检测效果进行比较。针对普通PCR和FQ-PCR设计的多对引物中,引物对3F/3R最短,特异性最好,反应时间也相对最短,适用于日后临床标本的筛查和检测。常规PCR方法和FQ-PCR具有较高的敏感性和良好的特异性,可以满足临床对普通标本的检测。FQ-PCR方法检测细菌数下限为104mL-1,灵敏度是普通PCR方法的100倍,此外,临床FQ-PCR检测可根据Ct值和模板拷贝数之间的线性关系计算样品模板的DNA表达水平。与常规PCR检测方法比较,FQ-PCR方法对实验操作和仪器设备的要求较高,但该方法具有更高的敏感性,并且能够对样品中目的基因进行精确定量,因而更适用于临床NDM1感染和环境监控的早期判断。对模拟样本的检测主要为判断临床标本的复杂环境是否会对检测结果造成干扰,本研究结果显示:只要达到最低检测浓度,2种方法均能特异性地检测出目标细菌。
[1]Huttner B,Harbarth S.'Antibiotics are not automatic anymore'-the french national campaign to cut antibiotic overuse[J].PLoS Med,2009,6(6):e1000080.
[2]Yong D,Toleman MA,Giske CG,et al.Characterization of a new metallo-lactamase gene,blaNDM-1,and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14from India[J].Antimicrob Agents Chemother,2009,53(12):5046-5054.
[3]Donald G,Mcneil J. Antibiotic-resistant bacteria moving fromsouth Asia to US[N].New York Times,2010-08-11.
[4]Kumarasamy KK,Toleman MA,Walsh TR,at al.Emergence of a new antibiotic resistance m echanism in India,Pakistan,and the UK:a molecular,biological,and epidemiological study[J].Lancet Infect Dis,2010,10(9):597-602.
[5]Deshpande P,Rodrigues C,Shetty A,et al.New Delhi metallo-blactamase(NDM-1)in enterobacteriaceae:treatment options with earbapenems compromised[J].Associat Physic India,2010,58:147-150.
[6]Health Protection Agency. Multi-resistant hospital bacteria linked to India and Pakistan[N].Health Protection Report,2009-07-03.
[7]Murphy TA,Simm AM,Toleman MA,et al.Biochemical characterization of the acquired metallo-13-lactamase SPM-1 from pseudomonas aeruginosa [J]. Antimicrob Agents Chemother,2003,47(2):582-587.
[8]王 蕊,赵怡鸿,黄云昆,等.重症监护病房耐甲氧西林金黄色葡萄球菌感染调查[J].中华医院感染学杂志,2008,18(2):183-185.
[9]Shelke N.NDM1-origin,symtoms and cure for NDM1[EB/OL].India Study Channel,http://www.Indiastudychanne1. com/resources/124111-NDM-Origin-Symtoms-Cure-for-NDM.aspx.2010-08-13.
[10]卫生部,总后卫生部,国家中医药管理局.产NDM-1泛耐药肠杆菌科细菌感染诊疗指南(试行版)[S].2010.卫办医改发[2010]161号.
[11]Bush K.Jacoby GA.Updated functional classification of beta lactamases[J].Antimi Crob Agents Chemother,2010,54(3):969-997.
[12]Loeffer J,Henke N,Hebart H,et al.Quantification of fungalDNA by using fluorescence resonance energy transfer and light cycler system [J].Clin Microb Lett,2000,38(2):586-590.
[13]Bieche I,Nogues C,Paradis V,et al. Quantitation of hTERT gene expression in sporadic breast tumors with a realtime reverse transcription-polymerase chain reaction assay[J].Clin Cancer Res,2000,6(2):452-459.
[14]杜昕颖,汪舟佳,王玉飞,等.泛耐药细菌 NDM-1基因Taqman PCR快速检测方法的建立[J].中国生物工程杂志,2011,31(6):81-85.
[15]张苑怡,武 娜,朱宝利,等.快速检测NDM-1基因的环介导恒温扩增技术的建立与评价[J].生物工程学报,2011,27(8):1232-1238.

