Nrf2/NQO1信号通路在胃癌干细胞氧化应激反应中的作用机制
陈 浩,许 浪
(1.湖北省荆州市中心医院胃肠外科,湖北 荆州 434100;2.武汉科技大学医学院病理学教研室,湖北 武汉 430065)
Nrf2/NQO1信号通路在胃癌干细胞氧化应激反应中的作用机制
陈 浩1,许 浪2
(1.湖北省荆州市中心医院胃肠外科,湖北 荆州 434100;2.武汉科技大学医学院病理学教研室,湖北 武汉 430065)
目的:观察核因子E2相关因子2(Nrf2)、醌氧化还原酶(NQO1)在胃癌干细胞和正常胃黏膜组织中的表达,探讨Nrf2/NQO1信号通路在胃癌干细胞氧化应激反应中的作用机制。方法:采用肿瘤球悬浮分选法从60例胃癌组织标本中分选胃癌干细胞,干细胞随机分为干细胞初分组和激活组。30例正常胃黏膜组织作为对照。采用Western blotting法检测各组Nrf2、NQO1蛋白表达水平和超氧化物歧化酶(SOD)、丙二醛(MDA)活性。结果:与正常对照组比较,干细胞初分组和激活组Nrf2、NQO1的表达水平升高(P<0.05),SOD活性显著降低,MDA活性则显著升高(P<0.05);与干细胞初分组比较,激活组Nrf2、NQO1的表达水平显著升高(P<0.05),SOD活性显著增强,MDA活性显著下降(P<0.05)。结论:激活Nrf2/NQO1通路可以调节胃黏膜组织中SOD和MDA的活性,增强细胞对氧化应激的耐受性,发挥保护细胞的作用。
Nrf2/NQO1信号通路;氧化应激;胃癌干细胞;超氧化物歧化酶;丙二醛
胃癌是消化系常见的恶性肿瘤之一,其发病机制十分复杂。国外研究[1]表明:肿瘤干细胞与肿瘤的发生发展有密切关系,对肿瘤的转移、复发和预后也起到决定性作用。研究[2]表明:胃癌发生部位与胃癌干细胞定居部位一致,且具有许多共同特性,提示胃癌可能是一种干细胞疾病。无论是正常细胞还是肿瘤细胞都趋于维持还原稳态以保证自身的生长和增殖,而调节抗氧化应激反应的重要转录因子核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)在这种稳态的维持中起关键作用。研究[3]表明:Nrf2可保护肺脏、肝脏、消化道、神经系统和心血管系统等多种器官或组织。醌氧化还原酶(NADPH quinine oxidoreductase,NQO1)是Nrf2的下游抗氧化酶基因,与内源或外源物质代谢与转运相关。本研究通过观察胃癌干细胞组织Nrf2/NQO1信号通路中Nrf2、NQO1的表达及其二相解毒酶基因超氧化物歧化酶(superoxide dismutase,SOD) 和 丙 二 醛(malondialdehyde,MDA)活性变化,探讨该信号通路在胃癌干细胞氧化应激反应中的作用机制。
1 资料与方法
1.1 一般资料 60例标本组织来源于2008年3月—2011年10月本院行胃肠外科手术切除且经病理诊断证实为胃癌的标本,其中男性35例,女性25例,年龄38~75岁,平均年龄(51.6±2.4)岁。依据 WHO诊断标准由本院病理科进行病理诊断。30例正常胃黏膜组织来自2007年8月—2011年5月本院胃镜室活检标本,其中男性18例,女性12例,年龄40~73岁,平均年龄(53.1±2.6)岁。标本取出后均立即经10%甲醛固定,常规石蜡包埋后封存。所有患者材料均经家属同意,并有知情同意书。获本院道德及伦理委员会批准。
1.2 主要试剂 1640培养基、Ⅰ型胶原酶、标准FBS和EDTA由北京中杉金桥公司提供;胰蛋白酶、新生牛血清、40μm筛网均由武汉御和生物有限公司提供;碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)和CD44鼠抗人单克隆抗体均由德国Merck公司提供;Nrf2、NQO1和兔多克隆抗体由上海研晶生物试剂有限公司提供;姜黄素由美国Gibco公司提供;Western blotting显色剂由法国Pierce公司提供;SOD、MDA检测试剂盒由南京建成生物技术有限公司提供。
1.3 胃癌干细胞的原代培养、分化及鉴定 无菌条件下取肿瘤标本,常规二甲苯脱蜡梯度酒精至水洗,剔除血管和坏死组织,以PBS冲洗后,无血清1640培养液中锐性分离,以0.25%胰蛋白酶消化,10%胎牛血清终止消化,筛网过滤。离心后去上清,以含10%FBS的1640培养液重悬细胞,置于5%CO2、37℃孵箱中培养,次日换液。待细胞长满瓶底时传代、培养。收集胃癌悬浮细胞并充分混悬,加入CD44+抗体包被的超微磁珠混匀,安装分离柱至磁场,以2mL缓冲液冲出阳性结合细胞,离 心 接 种 到 含 EGF(20×10-12g·L-1)、bFGF(20×10-12g·L-1)、LIF(10×10-12g·L-1)和b27(1×)的无血清1640培养液中,置于37℃、5%CO2培养箱中培养。在培养基中克隆球细胞贴壁分化增殖,将CD44+标记为胃癌干细胞,对克隆球细胞行免疫荧光染色鉴定,染色阳性即为胃癌干细胞,将分离的干细胞制备成细胞悬液。
1.4 实验分组 将分离所得的胃癌干细胞悬液随机均分成干细胞初分组(胃癌干细胞悬液加入营养液继续培养)和激活组[胃癌干细胞悬液加入50μmol·L-1姜黄素(Nrf2激活剂)激活 Nrf2通路,继续培养]。正常胃黏膜组织置于匀浆器中手工匀浆,制备10%正常胃黏膜组织匀浆,离心,取上清液,制备正常胃黏膜组织细胞悬液,加入营养液继续培养,作为正常对照组。
1.5 Western blotting法检测Nrf2和NQO1蛋白的表达水平 取上述各组细胞悬液加入裂解液提取蛋白,将提取的样本蛋白变性后,行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至PVDF膜上,用新鲜配制的含5%脱脂奶粉的TBST溶液封闭1h,然后将PVDF膜浸没在Nrf2抗体(1∶500)、NQO1抗体(1∶500)溶液中,置于4℃冰箱中过夜,次日再将PVDF膜冲洗后浸没在兔多克隆抗体(1∶1 000)溶液中,室温孵育2h,采用BCL显色法检测PVDF膜上蛋白表达水平。1.6 SOD和MDA活性检测 取各组细胞悬液,2 000r·min-1离心15min,取上清液,参照试剂盒说明书检测SOD和MDA活性。
1.7 统计学分析 采用SPSS 15.0统计软件进行数据分析。Nrf2、NQO1表达水平和SOD、MDA活性以±s表示,组间比较采用单因素方差分析。
2 结 果
2.1 Nrf2和NQO1蛋白在胃癌干细胞及正常胃黏膜组织中的表达水平 干细胞初分组及激活组Nrf2和NQO1蛋白表达水平均显著高于正常对照组(P<0.05),干细胞激活组Nrf2和NQO1蛋白表达水平高于干细胞初分组(P<0.01)。见表1和图1。
表1 各组Nrf2和NQO1蛋白的表达水平Tab.1 Expression levels of Nrf2and NQO1proteins in various groups [n=30,±s,ρB/(mg·L-1)]
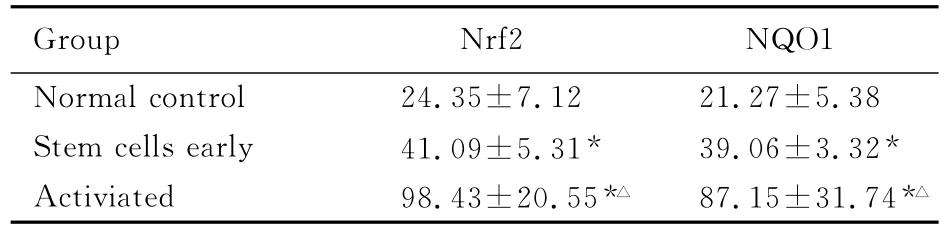
表1 各组Nrf2和NQO1蛋白的表达水平Tab.1 Expression levels of Nrf2and NQO1proteins in various groups [n=30,±s,ρB/(mg·L-1)]
*P<0.05 vs normal control group;△P<0.01 vs stem cells early group.
Group Nrf2 NQO1 Normal control 24.35±7.12 21.27±5.38 Stem cells early 41.09±5.31* 39.06±3.32*Activiated 98.43±20.55*△ 87.15±31.74*△

图1 Nrf2和NQO1蛋白在各组胃癌干细胞及正常胃黏膜组织中表达电泳图Fig.1 Electrophoregram of expressions of Nrf2and NQO1 proteins in gastric cancer stem cells and normal gastric mucosa tissue in various groups
2.2 SOD和MDA在胃癌干细胞及正常胃黏膜组织的活性 干细胞初分组SOD活性显著低于正常对照组 (P<0.05),经姜黄素激活后,SOD活性显著增强 (P<0.05),与正常对照组比较差异无统计学意义 (P>0.05);干细胞初分组 MDA活性显著高于正常对照组 (P<0.05),但激活组MDA活性显著降低 (P<0.05),与正常对照组比较差异无统计学意义 (P>0.05)。见表2。
表2 SOD和MDA在胃癌干细胞及正常胃黏膜组织中的活性Tab.2 Activities of SOD and MDA in gastric cancer stem cells and normal gastric mucosa tissue (n=30,±s)
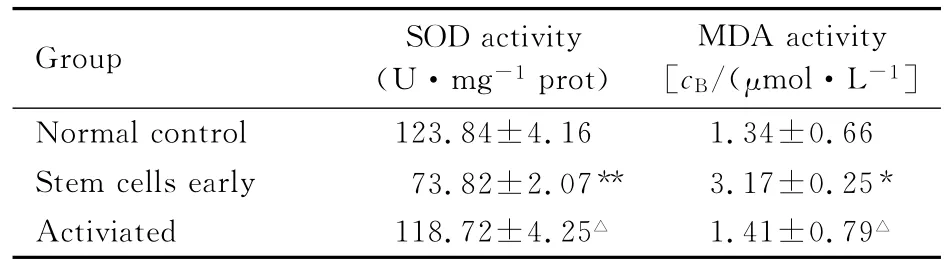
表2 SOD和MDA在胃癌干细胞及正常胃黏膜组织中的活性Tab.2 Activities of SOD and MDA in gastric cancer stem cells and normal gastric mucosa tissue (n=30,±s)
.*P<0.05,**P<0.01 vs normal control group;△P<0.01 vs stem cells early group.
Group SOD activity(U·mg-1 prot)MDA activity[cB/(μmol·L-1]Normal control 123.84±4.16 1.34±0.66 Stem cells early 73.82±2.07** 3.17±0.25*Activiated 118.72±4.25△ 1.41±0.79△
3 讨 论
肿瘤细胞在生长过程中持续经历着各种应激因素,使机体产生内源性应答反应即氧化应激,轻度氧化应激往往引起促进细胞存活、增殖、分化等适应性变化,重度氧化应激则造成细胞增殖阻滞、衰老、凋亡和坏死等损伤性变化[4]。氧化应激导致抗氧化类物质随之升高,破坏了机体内氧化和抗氧化的平衡,致使组织细胞中自由基产生增多,从而导致了包括肿瘤在内的一些疾病的发生[5]。因此氧自由基及其促氧自由基生成的相关酶类的增加在肿瘤的发生和发展过程中起着一定作用[6-7]。MDA活性高低可反映脂质过氧化程度,而SOD的活性度则反映了细胞内主要抗氧化能力[8]。有文献[9]报道:癌症患者血浆中SOD的活性较健康人降低。涂宏蕾等[10]研究显示:胃癌患者血浆中 MDA表达水平明显升高。Nrf2是细胞防御氧化应激的重要转录因子,生理状态下,Nrf2与胞浆蛋白伴侣分子Keap1偶联,锚合于胞质,处于活性相对抑制状态。在细胞处于氧化应激状态或有其他亲核剂信号刺激时,Nrf2可与Keap1发生解偶联,从而被激活转入细胞核内,与抗氧化反应元件(antioxidant response element,ARE)结合,调节下游抗氧化酶基因NQO1的表达,从而增强细胞对氧化应激的耐受性[11]。研究[12]发现:抑制 Nrf2向细胞核易位会加重氧化应激,导致非诺贝特介导的肝癌的形成。Nrf2缺陷鼠比野生鼠更易形成肺转移癌结节[13]。Nrf2激活剂——人工合成的咪唑啉三萜系衍生物能在肝、肺、肾、肠、脑、心脏、胸腺和唾液腺中,通过提高NQO1表达而对细胞起保护作用[14]。莱菔硫烷、姜黄素和奥替普拉等化合物均可诱导Nrf2下游基因NQO1、谷胱甘肽转移酶(GST)和γ-谷氨酰半胱氨酸酶催化亚单位(GCLC)等基因表达,进而对幽门螺杆菌引起胃癌起到化学保护作用,减少肿瘤形成[15]。在缺血再灌注模型中,Nrf2激活剂CDDO-Me可以显著增加抗氧化剂基因的表达[16]。
本研究结果显示:Nrf2和NQO1蛋白在胃癌干细胞初分组中的表达水平高于正常对照组,提示由于胃癌发生了氧化应激反应,胃癌干细胞内Nrf2被激活,上调下游基因NQO1的表达,对细胞产生一定的保护作用;但与正常对照组比较,干细胞初分组的SOD的活性显著降低,MDA异常升高,说明胃癌干细胞的SOD活性降低,产生了大量MDA,NQO1对细胞的保护作用不足以对抗该严重的过氧化损伤。而经过Nrf2激活剂姜黄素干预胃癌干细胞后,Nrf2和NQO1蛋白表达增强,同时干细胞激活组SOD的活性显著增强,MDA显著下降,减轻了干细胞的氧化损伤。由此推测,Nrf2/NQO1信号通路在胃癌干细胞氧化应激反应中发挥了重要作用,激活该通路,可以诱导Nrf2的高表达,进而促进NQO1的表达,增强细胞对氧化应激的耐受性,起到保护细胞的作用。本研究结果为胃癌的干细胞治疗提供了新思路。
[1]张明鸣,夏 霖.胃癌肿瘤干细胞研究现状及相关问题[J].华西医学,2012,27(3):452-455.
[2]刘龚玫子,周 錞,谢 川,等.胃癌干细胞的研究进展[J].世界华人消化杂志,2012,20(7):574-579.
[3]马建国, 李厚金, 邓 蓉, 等. 干 扰 Nrf2 可 增 强HirsutanolsA对肿瘤细胞增殖的抑制作用[J].南方医科大学学报,2012,32(8):1093-1097.
[4]Wang Y,Yang J,Yi J.Redox sensing by proteins:oxidative modifications on cysteines and the consequent events[J].Antioxid Redox Signal,2012,16(7):649-657.
[5]张海燕.Nrf2对蛋白酶体抑制剂诱导甲状腺癌细胞凋亡影响的观察[J].中华肿瘤防治杂志,2012,19(5):749-752.
[6]Tzung HC,Hsiou YD,Leong PC,et al.Novel phenolic glucoside,origanoside,protects against oxidative damage and modulates antioxidant enzyme activity[J].Food Res Int,2011,6(44):1496-1503.
[7]Satyakumar V,Pralhad SP.Liv.52attenuate copper induced toxicity by inhibiting glutathione depletion and increased antioxidant enzyme activity in HepG2cells[J].Food Chem Toxicol,2010,48(7):1863-1868.
[8]林雪梅,赵 敬,喻姗姗,等.二烯丙基硫醚对大鼠脑缺血再灌注损伤后Nrf2、NQO1表达的影响[J].中风与神经疾病杂志,2011,28(2):100-103.
[9]Wang YX,Wang RW,Wang JB,et al.Effect of self-control exercise on erythrocyte antioxidants and plasma malondialdehyde in cancer patients[J].China Sport Sci,2010,30(10):36-40.
[10]涂宏蕾,魏永长,孙海兵,等.胃癌患者血浆氧化抗氧化状态及组织8-羟基鸟嘌呤糖苷酶mRNA表达水平[J].细胞与分子免疫杂志,2011,27(7):793-794.
[11]倪 静,秦丽娟.肺癌组织中Nrf2、Keap1和NQO1蛋白的表达[J].郑州大学学报:医学版,2012,47(4):456-459.
[12]Nishimura J,Dewa Y,Okamura T,et al.Role of Nrf2and oxidative stress on fenofibrate-induced hepatocarcinogenesis in rats[J].Toxicol Sci,2008,106(2):339-349.
[13]Satoh H,Moriguchi T,Taguchi K,et al.Nrf2-deficiency creates a responsive microenvironment for metastasis to the lung[J].Carcinogenesis,2010,31(10):1833-1843.
[14]Yanaka A.Sulforaphane enhances protection and repair of gastric mucosa against oxidative stressinvitro,and demonstrates anti-inflammatory effects on Helicobacter pyloriinfected gastric mucosae in mice and human subjects[J].Curr Pharm Des,2011,17(16):1532-1540.
[15]金 玫,李 鹏,刘江伟.姜黄素与消化系统肿瘤的研究进展[J].现代生物医学进展,2011,11(23):4589-4591.
[16]Wei Y,Gong J,Yoshida T,et al.Nrf2has a protective role against neuronal and capillary degeneration in retinal ischemiareperfusion injury[J].Free Radic Biol Med,2011,51(1):216-224.
Mechanism of Nrf2/NQO1signal pathway in oxidative stress of gastric cancer stem cells
CHEN Hao1,XU Lang2
(1.Department of Gastrointestinal Surgery,Central Hospital,Jingzhou City,Hubei Province,Jingzhou 434100,China;2.Department of Pathology,School of Medical Science,University of Science and Technology,Wuhan 430065,China)
Objective To observe the expressions of nuclear factor E2-related factor 2(Nrf2)and NADPH quinine oxidoreductase(NQO1)in gastric cancer stem cells and normal gastric mucosa tissue,and to investigate the mechanism of Nrf2/NQO1signal pathway in oxidative stress of gastric cancer stem cells.Methods Tumor spheroids suspended separation method was used to select stem cells in 60gastric cancer tissue specimens.The stem cells were randomly divided into stem cells early group and activiated group.30cases of normal gastric mucosa tissues were regarded as normal control group.Western blotting method was applied to detect the expressions of Nrf2and NQO1protein in various groups.The activities of superoxide dismutase(SOD)and malondialdehyde(MDA)were observed.Results Compared with normal control group,the expression levels of Nrf2and NQO1in stem cells early group and activated group were increased(P<0.05),and the activity of SOD was decreased while the activity of MDA was increased significantly(P<0.05).Compared with stem cells early group,the expression levels of Nrf2and NQO1in activated group were remarkably increased(P<0.05),and the activity of SOD was increased while the activity of MDA was decreased significantly(P<0.05).Conclusion Activating Nrf2/NQO1 signal pathway can adjust the activities of SOD and MDA in gastric mucosa tissue to enhance the tolerance of gastric mucosal cells against oxidative stress in order to protect the cells.
Nrf2/NQO1signal pathway;oxidative stress;gastric cancer stem cells;superoxide dismutase;malondialdehyde
R318.04
A
1671-587Ⅹ(2013)03-0463-04
10.7694/jldxyxb20130308
2012-12-30
国家 “973”项目资助课题 (2011CB964700-G)
陈 浩 (1980-),男,湖北省仙桃市人,主治医师,医学硕士,主要从事胃肠外科的基础与临床研究。
许 浪 (Tel:027-68893395,E-mail:643025@qq.com)

