血管内皮钙黏蛋白在非小细胞肺癌血管生成中的作用
陶 韬,陈 虹,顾雪霜,周俊豪,彭单伊,张丽君(重庆医科大学附属第一医院呼吸内科,重庆 400016)
血管生成是肿瘤生长、浸润和转移的必要条件,抗血管生成疗法成为治疗肿瘤的新策略。目前已发现许多因子参与血管的生成与调控,其中血管内皮钙黏蛋白(vascular endothelial-cadherin,VE-cadherin)是特异性表达于血管内皮细胞的一类细胞黏附分子,在血管形成过程中必不可少[1]。VE-cadherin与多种恶性肿瘤血管生成相关,但在非小细胞肺癌(non-small cell lung cancer,NSCLC)中的研究尚少。本课题组前期研究[2]显示:VE-cadherin在NSCLC组织中的表达明显高于正常组织,且在癌细胞中大量表达,但其是直接对癌细胞起作用还是对血管内皮细胞起作用尚不清楚。本研究采用RNA干扰技术,沉默肺癌细胞中VE-cadherin的表达,并观察VE-cadherin对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的影响,为NSCLC的抗血管生成治疗提供新的实验依据。
1 材料与方法
1.1 细胞株、主要试剂及仪器 人肺癌细胞株A549由本实验室保存,HUVECs购自中南大学湘雅医学院。DMEM培养基、RPMI-1640培养基和胎牛血清均购自Gibco公司;TRIzol试剂、Primscript RT reagent Kit试剂盒、SYBR Premix Ex Taq荧光定量PCR试剂盒均购于TaKaRa公司;兔抗VE-cadherin购自Abcam公司;MTS试剂购自Promega公司;Matrigel胶购自BD公司;Lipofectamin RNAi MAX Reagent购自Invitrogen公司;AnnexinⅤ-FITC凋亡检测试剂盒购自Sigma公司;细胞周期检测试剂盒购自南京凯基生物科技发展有限公司;人VE-cadherin-双抗夹心ELISA试剂盒购自上海沪尚生物工程有限公司;Western blotting相关试剂购自碧云天公司;RNA干扰序列[3]:正义链,5′-GGAACCAGAUGCACAUUGAUU-3′;反义链,5′-UCAAUGUGCAUCUGGUUCCUU-3′;NC-siRNA 由上海吉玛制药技术有限公司合成;VE-cadherin引物:上游,5′-TTTCCAGCAGCCTTTCTACCA-3′; 下游,5′-GGAAGAACTGGCCCTTGTCA-3′,扩增产物长度为145bp;GAPDH引物:上游,5′-ACCTGACCTGCCGTCTAGAA-3′;下游,5′-TCCACCACCCTGTTGCTGTA-3′,扩增产物长度为227bp,由上海生工生物工程技术服务有限公司合成。
1.2 细胞培养和转染 人肺癌细胞株A549用含10%FBS的DMEM培养基,置于37℃、5%CO2条件下培养,转染前l d换新鲜培养液。采用RNAi MAX脂质体转染反转录法,细胞分为空白对照组、干扰组和阴性对照组,各组细胞均加500μL Optimer和5μL RNAi MAX,干扰组细胞另加入1.5μL VE-cadherin-siRNA ,阴性对照组细胞另加入1.5μL NC-siRNA,混匀,室温静止20min后,每孔接种2×104细胞于6孔板中,6h后换液。HUVECs分为干扰组和阴性对照组,用含10%FBS的RPMI-1640培养基,置于37℃、5%CO2条件下培养。
1.3 实时定量PCR法检测 VE-cadherin mRNA表达水平 转染48h后,采用TRIzol法提取RNA,将逆转录产物cDNA稀释20倍,逆转录体系及条件、扩增体系均按说明书进行,扩增条件:95℃预变性5min后,95℃、10s,55℃、30s,共40个循环,65℃、5s。独立重复实验3次。
1.4 Western blotting法检测VE-cadherin蛋白表达水平 转染72h后,常规方法提取细胞总蛋白,取蛋白提取物40μg进行SDS-PAGE电泳。在250mA电流下,转膜100min,封闭1h,兔抗VE-cadherin(1∶1000稀释)4℃过夜,TBST 洗5min×5次,与二抗在室温下反应1h,TBST洗5min×5次,ECL法显影。同时,以GAPDH(1∶800稀释)为对照。独立重复实验3次。
1.5 新型四唑氮盐(MTS)比色法检测VE-cadherin作用后A549细胞增殖情况 转染12h后重悬细胞,调整细胞密度为2×104mL-1,每孔100μL接种于96孔板,以此时为0h,分别于0、24、48和72h加入10μL MTS,孵育1h,酶标仪测定各孔于490nm处的光密度(A490)值,每个时间点每组设5个复孔。独立重复实验3次。
1.6 流式细胞术检测VE-cadherin作用后A549细胞周期和凋亡率 转染48h后,收集细胞,采用流式细胞术检测VE-cadherin对A549细胞周期、凋亡的影响,操作步骤按照试剂盒说明书进行。独立重复实验3次。
1.7 ELISA法检测各组 A549细胞上清液VE-cadherin表达水平 细胞转染72h后取上清液,采用人VE-cadherin-双抗夹心ELISA检测试剂盒进行检测,操作按说明书进行。检测各组上清液的A490值,根据标准曲线得出VE-cadherin表达水平。独立重复实验3次。
1.8 MTS比色法检测VE-cadherin作用后HUVECs增殖情况 重悬HUVECs至密度为1×104mL-1,每孔100μL接种于96孔板,6h后干扰组和阴性对照组分别加上清液100μL,以此时为0h,分别于0、24、48和72h加入20μL MTS,酶标仪测定各孔A490值,每个时间点每组设5个复孔。细胞增殖抑制率=(1-干扰组A490值/阴性对照组A490值)×100%。独立重复实验3次。
1.9 流式细胞术检测VE-cadherin作用后HUVECs周期和凋亡率 将8000个/孔HUVECs接种于6孔板,第2天用PBS洗2遍,1∶1加入含10%FBS的RPMI-1640培养基和收集的上清液共2mL。48h后采用流式细胞术检测VE-cadherin对HUVECs周期和凋亡的影响,操作步骤按照试剂盒说明书进行。独立重复实验3次。
1.10 小管形成实验 将Matrigel胶在4℃溶解过夜,用无血清的DMEM培养液稀释Matrigel(1∶1)后,50μL铺于预冷的96孔板中,聚合1h;消化 HUVECs,1000r·min-1离心5min,将干扰组、阴性对照组上清液分别重悬细胞并调整密度至8×105mL-1,50μL种板,6h后200倍倒置显微镜下观察并照相。每组5个随机视野计数小管形成数,取平均值。独立重复实验3次。
1.11 统计学分析 采用SPSS 17.0统计软件对数据进行分析,VE-cadherin的表达水平、细胞A490值、各细胞周期细胞所占比例、细胞凋亡率和小管形成数均以表示,组间比较采用单因素方差分析。
2 结 果
2.1 各组细胞VE-cadherin的表达水平 干扰组细胞VE-cadherin mRNA表达水平(0.299±0.039)明显低于空白对照组(1.137±0.082)和阴性对照组(1.001±0.076)(P<0.05),干扰组较空白对照组和阴性对照组表达水平下调约70%;Western blotting法检测,干扰组细胞的蛋白表达水平(0.297±0.045)明显低于空白对照组(0.833±0.119)和阴性对照组(0.794±0.095)(P<0.05)(图1),而空白对照组和阴性对照组VE-cadherin mRNA和蛋白表达水平差异无统计学意义(P>0.05)。
2.2 VE-cadherin基因沉默后A549细胞增殖情况在0、24、48和72h各组细胞间的A490值比较差异无统计学意义(P>0.05)。见表1。
2.3 VE-cadherin基因沉默后A549细胞周期和细胞凋亡 转染48h后,空白对照组、干扰组和阴性对照组A549细胞在G0/G1、G2/M和S期所占百分比比较差异无统计学意义(P>0.05),见表2。3组 A549细胞凋亡率分别为(11.99±4.77)%、(13.71±4.79)%和(12.02±4.25)%,组间比较差异无统计学意义(P>0.05)。
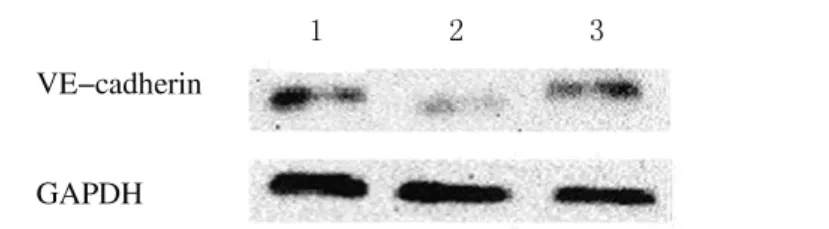
图1 各组A549细胞中VE-cadherin蛋白的表达电泳图Fig.1 Electrophoregram of expressions of VE-cadherin of A549cells in various groups Lane 1:Blank control group;Lane 2:Interference group;Lane 3:Negative control group.
2.4 A549细胞上清液中VE-cadherin的表达水平转染72h后,干扰组上清液中VE-cadherin的表达水平 [(2.89±0.07)μg·L-1]明显低于空白对照组 [(11.43±0.09)μg·L-1]和阴性对照组[(11.15±0.04)μg·L-1](P<0.05),而空白对照组和阴性对照组比较差异无统计学意义(P>0.05)。
2.5 VE-cadherin作用后HUVECs增殖情况 干扰组与阴性对照组上清液比较,A490值在24、48和72h明显降低,差异有统计学意义(P<0.05),见表3。干扰组24、48和72h细胞增殖抑制率分别为29.2%、33.8%和30.1%。
表1 MTS法检测VE-cadherin作用后A549细胞的A490值Tab.1 A490values of A549cells after treated with VE-cadherin detected by MTS method ()
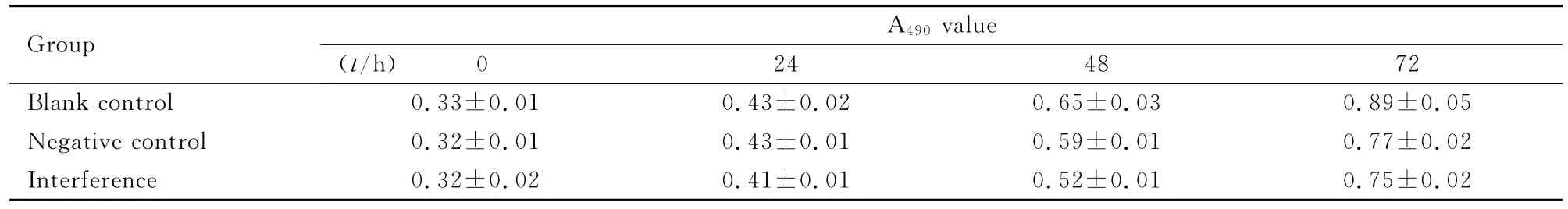
表1 MTS法检测VE-cadherin作用后A549细胞的A490值Tab.1 A490values of A549cells after treated with VE-cadherin detected by MTS method ()
0.89±0.05 Negative control 0.32±0.01 0.43±0.01 0.59±0.01 0.77±0.02 Interference 0.32±0.02 0.41±0.01 0.52±0.010 24 48 72 Blank control 0.33±0.01 0.43±0.02 0.65±0.03 Group A490value(t/h)0.75±0.02
表2 VE-cadherin作用后各组A549细胞周期的变化Tab.2 Changes of cell cycles of A549cells after treated with VE-cadherin in various groups [η/()%]

表2 VE-cadherin作用后各组A549细胞周期的变化Tab.2 Changes of cell cycles of A549cells after treated with VE-cadherin in various groups [η/()%]
09 Negative control 58.33±6.19 9.64±3.52 32.03±3.18 Interference 60.72±4.17 7.89±1.62 31.39±3.M S Blank control 59.30±3.97 8.11±2.11 32.50±2.Group Percentage of A549cells G0/G1 G2/45
表3 VE-cadherin作用后HUVECs增殖的改变Tab.3 Changes of proliferation of HUVECs after treated with VE-cadherin ()

表3 VE-cadherin作用后HUVECs增殖的改变Tab.3 Changes of proliferation of HUVECs after treated with VE-cadherin ()
* P<0.05compared with negative control group.
Group A490 0.91±0.92 Interference 0.27±0.02 0.37±0.04* 0.54±0.04* 0.64±0.030 24 48 72 Negative control 0.26±0.02 0.52±0.02 0.82±0.01 value(t/h)*
2.6 VE-cadherin作用后HUVECs周期和凋亡率 VE-cadherin作用48h后,干扰组与阴性对照组各细胞周期(G0/G1、G2/M 和S)HUVECs所占百分比比较差异无统计学意义(P>0.05)。干扰组和阴性对照组上清液中HUVECs凋亡率分别为(27.12±5.22)%和(13.43±3.50)%,组间比较差异有统计学意义(P<0.05)。见表4和图2。
2.7 VE-cadherin作用后HUVECs小管形成数将干扰组和阴性对照组上清液分别重悬HUVECs,6h后观察小管形成情况,干扰组细胞聚集减少,完整管腔数目明显减少,干扰组和阴性对照组小管形成数量分别为1.53±0.31和14.53±1.51,组间比较差异有统计学意义(P<0.05)。见图3。
表4 VE-cadherin作用后HUVECs周期的变化Tab.4 Changes of cell cycles of HUVECs after treated with VE-cadherin [η/()%]

表4 VE-cadherin作用后HUVECs周期的变化Tab.4 Changes of cell cycles of HUVECs after treated with VE-cadherin [η/()%]
Group Percentag.04 Interference 42.54±2.52 9.49±3.10 47.98±2.M S Negative control 41.94±2.48 11.53±4.66 46.53±4 e of HUVECs G0/G1 G2/42
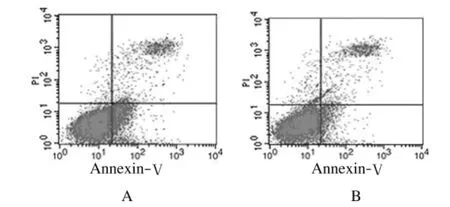
图2 VE-cadherin作用后HUVECs凋亡的改变Fig.2 Changes of the apoptosis of HUVECs after treated with VE-cadherin
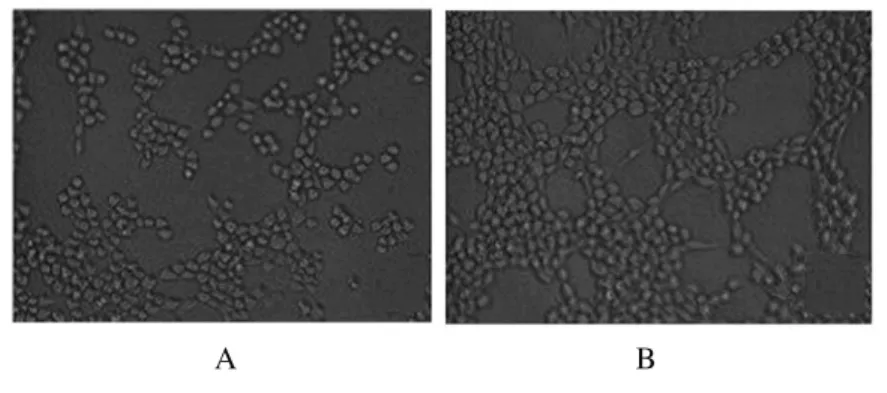
图3 VE-cadherin作用后HUVECs的小管形成Fig.3 Tubule formation of HUVECs after treated with VE-cadherin
3 讨 论
血管生成在肿瘤的生长、侵袭和转移中发挥着至关重要的作用,丰富的血管可以不断地向肿瘤组织提供氧气和营养,并排出肿瘤细胞的代谢产物;同时其远处转移也必须以血管新生为前提和必要条件。目前新的观点认为:血管生成抑制剂还可使肿瘤血管正常化,即使异常的血管在结构和功能上趋于正常。而肿瘤血管和微环境异常是肿瘤化疗和放疗耐受的主要原因,即使用血管生成抑制剂可以提高传统化疗和放疗的疗效。
VE-cadherin是特异性表达于血管内皮细胞的一类细胞黏附分子,定位于内皮细胞与内皮细胞连接处,在维持和控制内皮细胞连接方面起重要作用,且在血管形成过程中必不可少[1]。VE-cadherin氨基端与相邻血管内皮细胞上相同的VE-cadherin同嗜黏附,其羧基末端与2个胞内蛋白β-catenin和γ-catenin相连,2个胞内蛋白属于Armadillo家族,其通过α-catenin将 VE-cadherin与肌动蛋白细胞骨架相连,保证了血管的完整性。新近的研究[4-9]显示:VE-cadherin与肾母细胞瘤、骨肉瘤、恶性黑色素瘤、结肠癌和卡波氏肉瘤等多种恶性肿瘤血管生成关系密切,是乳腺癌转移新的生物标志物。但目前国内外,VE-cadherin与肺癌的关系鲜见报道,仅Dome等[10]研究显示:与健康者比较,NSCLC患者外周血中 VE-cadherin mRNA表达水平并未显著增加。Liao等[11]应用VE-cadherin的抗体阻断VE-cadherin介导的同嗜黏附作用,可以抑制裸鼠皮下种植的Lewis肺癌细胞和人A431上皮癌细胞的生长和转移。然而,肺癌是最常见的恶性肿瘤,全球发病率和死亡率居癌症首位,临床多数肺癌发现时已属中、晚期,其5年生存率不到15%,而其中75%~80%为NSCLC。现有资料未能全面阐述NSCLC血管生成的机制,故有必要寻找新的与NSCLC血管生成相关的基因以进一步完善其发病机制。
本研究前期研究显示:VE-cadherin在NSCLC组织中的表达明显高于正常组织[2],且在癌细胞中大量表达,这促使本文作者猜想VE-cadherin可能参与了NSCLC的发生发展,但是直接对癌细胞起作用还是对血管内皮细胞起作用尚不清楚。本研究利用RNA干扰技术,有效抑制了VE-cadherin在A549细胞中的表达,尚未发现其对A549细胞增殖、周期和凋亡有影响,干扰组细胞上清液中VE-cadherin表达水平明显低于空白对照组和阴性对照组,而空白对照组和阴性对照组比较差异无统计学意义,故后续实验仅研究干扰组和阴性对照组。本研究结果显示:干扰组和阴性对照组上清液对HUVECs增殖、凋亡率和周期变化无影响,表明VE-cadherin对HUVECs有促增殖和抗凋亡作用;本研究结果显示:干扰组HUVECs聚集及形成完整管腔数明显减少,表明VE-cadherin在完整血管管腔的形成过程中起重要作用。以上结果表明:癌细胞为了生长大量合成并分泌VE-cadherin,VE-cadherin促进血管生成,反过来又促进肿瘤生长,这为NSCLC的抗血管生成治疗提供了新的靶点。
VEGF是目前已知的活性最强、特异性最高的内皮细胞促有丝分裂细胞因子,其他的血管生成因子也通过VEGF而起作用。VEGF可促使Rac1依赖性活性氧(ROS)的生成,导致 VE-cadherin Y658和Y731磷酸化,进一步导致细胞间连接的分离和单分子层渗透性增加[12]。Gavard等[13]认为:VEGF通过Src依赖的VaV2磷酸化激活小GTP酶Rac,Rac又促进由PAK介导的VE-cadherin S665磷酸化,引起β-arrestin募集到VE-cadherin上,导致 VE-cadherin内化。血管内皮-蛋白酪氨酸磷酸酶(VE-PTP)加强了VE-cadherin介导的细胞间黏附,VE-cadherin/VE-PTP复合体的分离是白细胞渗出和VEGF诱导的血管渗透性增加所必须的[14]。VEGF诱导VE-cadherin正向连接在鼠肺或睾提肌血管内皮细胞重新排列,这依赖于TSAD,其在内皮细胞连接处与 VE-cadherin、VEGFR2和c-Src形成复合体[15]。总之,VE-cadherin酪氨酸和丝氨酸磷酸化直接影响了VE-cadherin的稳定,从而影响其内皮渗透性,但其具体机制还有待进一步研究。
综上所述,VE-cadherin通过促进血管生成来参与NSCLC的发生发展,有望成为NSCLC抗血管生成治疗的新靶点。因此,本文作者设想通过抑制VE-cadherin的异常表达,进一步抑制NSCLC的生长、浸润和转移,从而改善患者的预后,为NSCLC的靶向治疗提供一个新的靶点。
[1]Vestweber D.VE-cadherin:the major endothelial adhesion molecule controlling cellular junctions and blood vessel formation [J].Arterioscler Thromb Vasc Biol,2008,28(2):223-232.
[2]陶 娟.非小细胞肺癌中VE-cadherin和E-cadherin的表达及意义 [D].重庆:重庆医科大学,2010.
[3]Ha CH,Bennett AM,Jin ZG.A novel role of vascular endothelial cadherin in modulating c-Src activation anddownstream signaling of vascular endothelial growth factor [J].J Biol Chem,2008,283(11):7261-7270.
[4]Kirschner KM,Sciesielski LK,Scholz H.Wilms’tumour protein Wt1stimulates transcription of the gene encoding vascular endothelial cadherin [J].Pflugers Arch,2010,460(6):1051-1061.
[5]Zhang LZ,Mei J,Qian ZK,et al.The role of VE-cadherin in osteosarcoma cells[J].Pathol Oncol Res,2010,16(1):111-117.
[6]Khanna P,Yunkunis T,Muddana HS,et al.p38MAP kinase is necessary for melanoma-mediated regulation of VE-cadherin disassembly [J].Am J Physiol Cell Physiol,2010,298(5):1140-1150.
[7]Li H,Shi X,Liu J,et al.The soluble fragment of VE-cadherin inhibits angiognesis by reducing endothelial cell proliferation and tube capillary formation [J].Cancer Gene Ther,2010,17(10):700-707.
[8]Guilluy C,Zhang Z,Bhende PM,et al.Latent KSHV infection increases the vascular permeability of human endothelial cells [J].Blood,2011,118(19):5344-5354.
[9]Fry SA,Sinclair J,Timms JF,et al. A targeted glycoproteomic approach identifies cadherin-5as a novel biomarker of metastatic breast cancer [J].Cancer Lett,2013,328(2):335-344.
[10]Dome B,Timar J,Dobos J,et al.Identification and clinical significance of circulating endothelial progenitor cells in human non-small cell lung cancer [J]. Cancer Res,2006,66(14):7341-7347.
[11]Liao F,Li Y,O’Connor W,et al.Monoclonal antibody to vascular endothelial cadherin is a potent inhibitor of angiogenesis,tumor growth,and metastasis [J].Cancer Res,2000,60(24):6805-6810.
[12]Monaghan-Benson E,Burridge K.The regulation of vascular endothelial growth factor-induced microvascular permeability requires Rac and reactive oxygen species [J].J Biol Chem,2009,284(38):25602-25611.
[13]Gavard J,Gutkind JS. VEGF controls endothelial-cell permeability by promoting the beta-arrestin-dependent endocytosis of VE-cadherin [J]. Nat Cell Biol,2006,8(11):1223-1234.
[14]Broermann A,Winderlich M,Block H,et al.Dissociation of VE-PTP from VE-cadherin is required for leukocyte extravasation and for VEGF-induced vascular permeability in vivo [J].J Exp Med,2011,208(12):2393-2401.
[15]Sun Z,Li X,Massena S,et al.VEGFR2induces c-Src signaling and vascular permeability in vivo via the adaptor protein TSAd [J].J Exp Med,2012,209(7):1363-1377.

