幽门螺杆菌双基因多表位重组原核表达工程菌的构建及其表达特性的研究
杨靖,潘兴,欧琴,周法庭,李建春,祝捷,周永君,李明远,王保宁△
(1.四川大学华西基础医学与法医学院微生物学教研室,成都 610041;2.四川万可泰生物技术有限责任公司,成都 610041;3.湖北医药学院微生物学教研室,十堰 442000)
幽门螺杆菌(H.pylori)已被WHO定为第I类生物致癌因子,有大量研究[1,2]证实幽门螺杆菌感染与急慢性胃炎、胃十二指肠溃疡、胃癌及胃粘膜相关淋巴瘤(MALT)等疾病密切相关。幽门螺杆菌感染多发生于发展中国家和第三世界,据胡伏莲等[3]报道,我国20个省市幽门螺杆菌的感染率为42%~90%[3]。幽门螺杆菌感染会加重其他细菌和病毒肠道疾病[4]。目前临床上常采用三联或者四联方法治疗幽门螺杆菌感染,但治疗方法复杂,存在病人依从性差和费用昂贵等问题,使幽门螺杆菌易产生耐药性[5,6],难以达到根治目的。减毒或灭活幽门螺杆菌疫苗虽成功诱导机体黏膜免疫,但易产生发热、呕吐、腹泻等不良反应[7],重组幽门螺杆菌疫苗由于具有免疫效果好、危险性低、免疫持久等优势,显示出良好的研究前景。
随着对幽门螺杆菌发病机制的深入了解,已证实尿素酶、空泡毒素、粘附素和细胞毒性相关蛋白等对幽门螺杆菌的生长起重要作用[8],其中尿素酶对于幽门螺杆菌的生存和侵袭尤为关键[9]。1990年Pallen等就提出以尿素酶作为抗原研制疫苗,随后Tomb等对幽门螺杆菌基因进行测序,发现至少7个幽门螺杆菌基因参与编码催化活性的尿素酶,其中ureA、ureB编码一个分子量大小约为550kDa多聚脱辅基酶蛋白,ureE、ureF、ureG、ureH、ureI编码镍离子结合到多聚脱辅基酶蛋白有关的辅助蛋白[10]。尿素酶蛋白在幽门螺杆菌中含量丰富,占菌体可溶性蛋白含量的6%,常分布于细胞表面。
ureB与尿素酶活性相关,是幽门螺杆菌在胃抵抗胃酸,分解尿素产生氨云的关键基因,也是定植的关键基因之一。ureB蛋白能诱导机体产生保护性免疫,常被作为疫苗候选基因[11]。ureI为质子控尿素通道蛋白,该通道在中性pH时关闭,而pH为5.0时完全开放。尿素通过此通道进入胞浆,被尿素酶分解中和周围H+,即使胃内pH低于2.0,幽门螺杆菌周围的pH也可保持在6.1左右,一般认为ureI是幽门螺杆菌在人胃内定植的必需基因[12]。ureI虽不参与尿酶的生物合成,但参与幽门螺杆菌H+控尿素通道的过程,调控细胞内尿素酶的代谢,对幽门螺杆菌在人和动物体内生存起重要作用[13,14]。
本研究从ureI和ureB基因中筛选T细胞和B细胞优势表位基因序列,串联成600bp的含ureI和ureB双基因的新序列,构建原核重组表达质粒和原核表达工程菌,研究工程菌的微生物学特性和表达重组蛋白(rIB)的免疫反应性,了解该重组蛋白与幽门螺杆菌悉尼株(H.Pylori SS1)抗原蛋白的相关性。
1 材料和方法
1.1 材料
原核表达重组质粒pET28a(+)(卡那霉素抗性)购于 Novagen;BL21(DE3)为 Novagen产品。胶回收试剂盒、质粒提取试剂盒购自Omega公司。Premix Taq酶、T4连接酶、限制性内切酶EcoR I、Xho I、DNA Marker均购自Takara公司。PVDF膜及HRP标记的羊抗鸡IgG购自Earth公司。H.pylori SS1菌株、鸡抗SS1特异抗体由四川万可泰生物技术有限责任公司提供。
1.2 方法
1.2.1 幽门螺杆菌IB基因序列 依据GenBank中ureI和ureB DNA序列,经生物信息学分析,从ureI和ureB基因中筛选富含人T细胞和B细胞表位的核苷酸序列,串联成含ureB和ureI基因的新幽门螺杆菌ureI-B基因。在线预测网站网址如下:www.imtech.res.in/raghava/propred,www.epipredict.de/index.html。根据 T、B细胞表位预测截取ureB和ureI的7个T、B细胞表位串联做融合表达,预测无信号肽序列。全序列长558bp[15],序列如下:ggattaacca aagtcgatcc taaaagcacc aaaaaaggtt tggattggcg tccgtattct tggtataaaa aaatgtatgg ccctaccaca ggcgataaag tgcgtttgaa aaaatctgca atcaatcatg cgttagacgt tgcggacaaa tacgatgtgc aagtcgctat ccacacagac actaaaaaaa gcattaaagaagatgtccag ttcgctgatt cacgtatccg ccctcaaacc attgcggctg aagacacttt gcatgacatg gggattttct caatcaccag ttctgactct caagcgatgg gtcgtgtggg tgaagttatc actcgtactt ggcaaacagc tgacaaaaac aaaaaagaat ttggccgctt gaaagaagaa aaaggcgata acgacaactt caaaaaaccg gttaaaaatt gccgtaacat cactaaaaaa gacatgcaat tcaatgacac taccgctcac attgaagtca atcctgaaac ttaccatgtg ttcgtggatg gcaaagaagt cacttctaaa ccagctaata aagtgagc设计合成片段:每个抗原片段中间加两个赖氨酸KK。5'段引入EcoR I酶切点,3'端引入Xho I酶切点,由北京金维智生物技术公司合成。用DNAMAN 6.0软件预测:MW=21kD,PI=9.8。1.2.2 IB原核表达工程菌构建和鉴定 参照分子克隆实验,将IB基因克隆入原核表达载体pET28a(+)中,再将pET28a(+)/IB原核表达质粒转化到大肠杆菌BL21(DE3)。筛选出含pET28a(+)/IB质粒的大肠杆菌,转入含卡那霉素的LB培养基中。培养过夜,次日收集约3mL上述菌液抽提质粒,EcoR I、XhoI双酶切,1%琼脂糖电泳观察结果,并进行DNA测序确认。
1.2.3 IB原核表达质粒稳定性研究 用摇瓶模拟发酵过程,在非抗性培养基中传代30代后,收集菌液,将菌液适当稀释后,接种到不含卡那霉素抗性的LB培养皿,37℃培养过夜。挑取100个菌落,接种到含卡那霉素抗性的LB培养皿,37℃培养过夜,统计菌落数,计算质粒保有率PR=K+/K-,K+ 指在含卡那霉素抗性培养基中生长的CFU/mL;K-指在不含卡那霉素抗性培养基中生长的CFU/mL[16]。1.2.4 工程菌诱导表达分析 将培养至对数生长期的大肠杆菌pET28a(+)/IB按0.1%(V/V)的比例接种到LB培养基中,37℃培养3h左右,液体A600≈0.8时,加入1mmol/L的IPTG,22℃诱导4h后,4℃10 000r/min离心10min,分别收集沉淀和上清,沉淀经PBS洗涤后用超声缓冲液重悬菌体,超声破碎(200W、20min、28次,间隔20min),4℃、10 000r/min离心20min,分别收集裂解上清与沉淀。沉淀用包涵体鉴定液(100mm/L TriCl,50 mmol/L EDTA,50mmol/L NaCl,pH 8.0)处理后,10g/L的SDS凝胶电泳分析。
1.2.5 重组IB蛋白的纯化和免疫反应分析 超声破碎上清透析处理后,参照GE公司His Trap TM HP镍纯化柱说明书对表达的重组融合蛋白进行纯化,用一步法亲和纯化目标蛋白,280mmol/L咪唑洗脱,0.01mol/L PBS透析;Lorry法测蛋白含量,SDS-PAGE和Gel-Pro Analyzer 4分析。纯化蛋白SDS-PAGE电泳分离后,200mA恒流1h湿转至PVDF膜 。含10mL/L牛血清的0.01mol/L PBS 4℃ 封闭过夜。用鸡抗Hp ss1特异抗体IgY(1∶4 000),兔抗鸡IgY的酶标抗体(特异兔IgG-HRP,1∶1000)分别做一抗和二抗,37℃反应1h,用PBST(含2mL/L Tween20的0.01mol/L PBS)洗涤3次,ECL试剂显色。用不含目的基因的空质粒大肠杆菌工程菌BL21DE3的诱导物做对照,研究工程菌产物中重组蛋白的免疫反应原性。
2 结果
2.1 IB原核表达工程菌构建和鉴定
EcoR I/Xho I双酶切后,在1.0%琼脂糖电泳上出现一条约为600bp的片段,与预期结果一致(见图1)。原核表达质粒pET28a(+)/IB送金唯智公司测序,结果显示插入基因序列正确,无突变,阅读框架未发生改变。
2.2 IB原核表达工程菌稳定性
工程菌传代30代,其质粒保有率均>91%,说明重组工程菌中质粒稳定,丢失<10%(见图2)。

图1 pET28a(+)/IB中重组质粒酶切分析
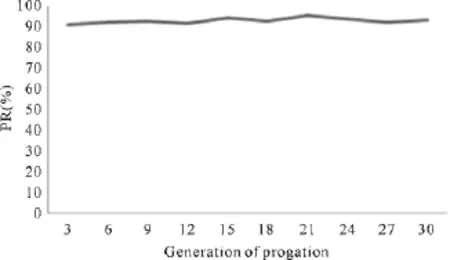
图2 pET28a(+)/IB中重组质粒保有率
2.3 工程菌诱导表达情况
工程菌经IPTG诱导后在约28kD处出现一条蛋白条带,与理论预测值相符(见图3)。
2.4 重组IB蛋白的纯化和免疫反应分析
经IPTG诱导,目标蛋白经His Trap TM HP一步法亲和纯化后,以抗H.pylori SS1为特异抗体,Western blot实验结果也在28kD左右出现特异反应条带,其分子量大小与理论值相符(见图4)。
3 讨论
利用原核表达系统可以使细菌细胞表达所需要的真核生物蛋白质,该系统包括原核表达质粒和表达宿主菌。本实验选用的pET28a(+)质粒是pET质粒中的一员,pET质粒是目前在大肠杆菌中克隆表达重组蛋白功能最强大的质粒。目的基因被克隆到pET质粒载体上后,受噬菌体T7强转录及翻译信号控制,其表达由宿主细胞提供的T7RNA聚合酶诱导。T7RNA聚合酶诱导机制十分有效并具有选择性:充分诱导时,几乎所有的细胞资源都用于表达目的蛋白,诱导表达后几小时,目的蛋白的量通常可占菌体总蛋白的50%以上。

3 pET28a(+)/IB诱导前后SDS电泳
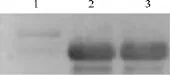
图4 rIB蛋白纯化前后的Western Blot实验
宿主菌大肠杆菌Transetta(DE3)可补充大肠杆菌缺乏的6种稀有密码子(AUA、AGG、AGA、CUA、CCC、GGA)对应的tRNA,提高外源基因在原核系统中的表达水平,而且Transetta(DE3)具有氯霉素(CamR)抗性,这就避免了转化过程中可能带来的操作污染。大肠杆菌Transetta(DE3)是噬菌体DE3的溶原菌,噬菌体DE3带有lacI基因、lacUV5启动子及T7RNA聚合酶基因。宿主菌形成溶原状态后,在培养基中加入IPTG,受诱导的lacUV5启动子可指导T7RNA聚合酶基因转录,开始生产T7RNA聚合酶,继而质粒上的目的DNA开始转录。通过小培养优化IPTG的最佳诱导浓度和诱导时间以达到完全诱导,可以使目的蛋白达到最大量和最佳溶解性。
本研究成功构建原核表达质粒pET28a(+)/IB,并在大肠杆菌Transetta(DE3)表达出His标签的His-IB重组融合蛋白(rIB)。将目标序列测序结果递交NCBI进行BLAST比对,结果与较为常见的标准菌株 H.pylori SS1、H.Pylori 26695、H.pylori J99和H.pylori G27菌株的UreB一致性分别为100%、97%、100%、99%,与这些菌株中ureI基因一致性均为100%。证实来源于幽门螺杆菌ureI和ureB基因的重组基因ureI-B属于高保守序列。经对IPTG表达条件的优化,表达的rIB经纯化后纯度达90%,Western blot实验结果证实可与抗H.pylori SS1特异抗体结合,说明其具有良好的免疫原性。
重组质粒pET28a(+)/IB长期稳定表达是疫苗成功的关键之一。原核表达工程菌IB连续传代30代未见质粒丢失,重组蛋白表达稳定,这为表达工程菌IB作为H.pylori的治疗和预防性疫苗开发奠定了基础。
[1]McNamara D,EI-Omar E.Helicobacter pylori infection and the pathogenesis of gastric cancer:aparadigm for hostbacterial interactions[J].Dig Liver Dis,2008,40(7):504-509.
[2]Kusters JG,Van Vliet AH,Kuipers EJ.Pathogenesis of Helicobacter pylori infection[J].Clini Microbiol Rev,2006,19(3):449-490.
[3]胡伏莲,周殿元.中国幽门螺杆菌耐药研究状况[J].胃肠病学和肝病学杂志,2008,17(7):517-518.
[4]Passro DJ,Taylor DN,Meza R,et al.Acute Helicobacter pylori infection is followed by an increase in diarrheal disease among Peruvian children[J].Pediatrics,2001,108(5):E87.
[5]Gisbert J.The recurrence of Helicobacter pylori infection:incidence and variables influencing it.A critical review [J].Am J Gastroenterol,2005,100(9):2083-2099.
[6]Wang WH,Wong BC,Mukhopadhyay AK,et al.High prevalence of Helicobacter pylori infection with dual resistance to metronidazole and clarithromycin in Hong Kong[J].Aliment Pharmacol Ther,2000,14(7):901-910.
[7]Losonsky GA,Kofloff KL,Walker RI.B cell responses in gastrical antrum and duodenum following oral inactivated Helicobacter pylori whole cell(HWC)vaccine and LT(R192G)in prior seronegative individuals[J].Vaccine,2003,21(5-6):562-565.
[8]黄雪芳,徐三平.幽门螺杆菌研究的新进展[J].临床消化病杂志,2012,24(6):370-371.
[9]Stingl K, Altendorf K,Bakker EP. Acid survival of Helicobacter pylori:how does urease activity trigger cytoplasmic pH homeostasis[J].Trends Microbiol,2002,10(2):70-74.
[10]周殿元,胡伏莲.幽门螺杆菌基础与临床[M].3版.北京:中国科学技术出版社,2009:118-124.
[11]吴超,邹全明,张卫军,等.中国人幽门螺杆菌尿素酶B亚单位的基因克隆及序列分析[J].免疫学杂志,2000,16(5):328-330.
[12]Strugatsky D,McNulty R,Munson K,et al.Structure of the proton-gated urea channel from the gastric pathogen Helicobacter pylori[J].Nature,2013,493(7431):255-258.
[13]Scott DR,Marcus EA,Weeks DL,et al.Expression of the Helicobacter pylori ureI gene is required for acidic pH activation of cytoplasmic urease[J].Infect Immun,2000,68(2):470-477.
[14]Mollenhauer R,Hanauer G,Sachs G,et al.Expression of UreI is required for intragastric transit and coloni-zation of gerbile gastric mucosa by Helicobacter pylori [J].Res Microbiol,2002,153:659-666.
[15]王保宁,喻堃,李明远,等.一种多靶点重组基因及其蛋白在防治幽门螺杆菌感染中的应用[P].中国:201010274782.X,2011-01-26.
[16]国家药典委员会.中华人民共和国药典:第3部[M].北京:中国医药科技出版社,2010:附录64-65.

