天然抗冻多肽的制备、分离及细菌低温保护活性研究
赵珺,汪少芸,李晓坤
(福州大学生物科学与工程学院,福建福州 350116)
0 引言
生活在低温环境中的许多生物要避免体液结冰,长期的进化过程使其体内出现了一种广泛且多样化的新物质——抗冻蛋白(antifreeze proteins,AFPs),它是一类在结冰或亚结冰条件下,能改变冰晶生长特性和抑制冰晶重结晶从而保护生物有机体免受冰冻伤害的蛋白质,广泛存在于生物体中[1].从二十世纪60年代抗冻蛋白被发现以来,引起许多实验室的研究兴趣[2].
研究表明,抗冻蛋白的抗冻活性片断只存在于局部的特异多肽链结构域,并不是整体蛋白质在起作用,而目前的研究却主要集中在从极地鱼类、陆地昆虫、植物和细菌等生物体中分离纯化,并且利用转基因技术提高产量,这样得到的抗冻蛋白不仅数量微少而且应用到食品中有一定的安全顾虑,因此,获得安全的、结构紧凑的特异性高活性抗冻多肽就成为抗冻蛋白迫切的研究方向[3-4].利用鲨鱼皮明胶酶解得到抗冻多肽混合液,经过分离纯化,获得基于食品源的高效特异性抗冻多肽并对其抗冻活性进行表征.选用的材料简单易得,得到的食品源抗冻多肽安全、无色无味、而且水解液可重复制备.
1 材料与方法
1.1 材料
鲨鱼皮,福州永辉超市;复合蛋白酶、碱性蛋白酶、中性蛋白酶,诺维信(中国)生物技术有限公司;酸性蛋白酶,福建福大百特生物公司;大肠杆菌,由本校微生物实验室提供;
氢氧化钠、浓盐酸、氯化钠、无水乙醇、磷酸氢二钠、磷酸二氢钠等,分析纯,汕头市西陇化工厂有限公司;牛肉膏、蛋白胨,国药集团化学试剂有限公司;Sephadex G-50常压凝胶色谱柱、SP-Sephadex C-25阳离子交换树脂,美国Amersham Pharmacia公司
1.2 主要仪器设备
752 型紫外可见分光光度计,上海光谱仪器有限公司;J-25I型高速离心机,美国BECKMAN公司;循环水式多用真空泵,郑州长城科工贸有限公司;N-1001型旋转蒸发仪,日本东京理化器械株式会社;FE20型pH计,梅特勒-托利多仪器(上海)有限公司;FD-3冷冻干燥机,北京博医康实验仪器有限公司;PYX-PHS-X型恒温培养箱,上海精宏实验设备公司;1285超净工作台,美国Thermo Forma公司;DSX-280B型不锈钢手提式灭菌器,上海申安医疗器械厂;HHS恒温水浴锅,厦门医疗仪器厂.
1.3 实验方法
1.3.1 鲨鱼皮明胶的制备
1.3.1.1 前处理
将鲨鱼皮中残余的鲨鱼肉及脂肪去除干净,用自来水清洗干净,沥干后切成大小1 cm2左右的小块.
1.3.1.2 提胶
将上述经前处理过的鱼皮用0.1 mol·L-1的NaOH溶液(W/V=1∶6)4℃下浸泡24 h,每12 h换一次浸泡液.然后用蒸馏水洗至中性.将鲨鱼皮块沥干后加入0.03%的HCl溶液(W/V=1∶6)4℃浸泡4 h,使鲨鱼皮充分溶胀,然后再用蒸馏水洗至中性.最后,加入蒸馏水(W/V=1∶6)于60℃水浴中提胶5 h,过滤,上清液即为明胶溶液.
1.3.1.3 真空浓缩及冷冻干燥
将上述明胶溶液利用旋转蒸发仪在50℃下进行真空浓缩后冷冻干燥,即得到明胶干品.
1.3.2 蛋白酶活力的测定
蛋白酶活力的测定参照专业标准SB/T10317-1999[5].
1.3.3 明胶酶解液的制备
取7.5 g明胶,用蒸馏水溶解并定容至250 mL.用适当浓度的NaOH溶液或HCl溶液调节明胶溶液的pH值至酶最适反应pH,然后在酶的最适反应温度下水浴保温10 min.以3 000 U·g-1加酶量根据酶活计算出蛋白酶使用量,加酶,混匀,开始反应并计时,酶解过程中用磁力搅拌器不断搅动,并用2 mol·L-1NaOH 溶液或 HCl溶液调 pH.酶解时间共为6 h小时,分别在酶解0.5、1.0、2.0、3.0、4.0、5.0、6.0 h时取样,在沸水浴中灭酶10 min以终止水解反应,然后迅速冷却至室温,置于离心机中,以4 000 r·min-1离心15 min,取上清液,即为明胶酶解产物.
1.3.4 细菌低温保护活性
细菌低温保护活性参考文献[6].将大肠杆菌以1∶100的比例从种子液接种到液体培养基中,待其浓度达到OD600=0.8左右时稀释菌液104倍,取900 μL样品加入到1.5 mL无菌离心管中,再加入100 μL稀释好的菌液,混匀后取100 μL涂布,每个样品做两个平行,37℃倒置培养20 h,菌落计数并计算存活率.剩余部分在-20℃下放置24 h后,按照如前步骤涂布、培养、计数.
1.3.5 抗冻多肽的分离纯化
1.3.5.1 凝胶过滤色谱
所用凝胶色谱柱规格为Φ2.6 cm×100 cm,使凝胶充分溶胀后在柱内装一定体积的去离子水,然后将凝胶与去离子水一起边搅拌边倒入保持垂直的凝胶柱中,使凝胶慢慢沉降,从而装填成均匀、无气泡、无裂缝的凝胶色谱柱.装好的凝胶柱用去离子水充分平衡后即可上样.上样完毕,开动样品分部收集器,收集样品.用可见紫外分光光度计进行检测.
1.3.5.2 离子交换色谱
所用的离子交换色谱柱规格为Φ1.6 cm×20.0 cm,其溶胀、装柱、平衡、上样过程与凝胶柱基本相同,不同的是其洗脱过程采用盐离子浓度线性梯度洗脱.
2 结果与讨论
2.1 酶活力测定
2.1.1 酪氨酸标准曲线的制作
以酪氨酸浓度为横坐标,吸光值为纵坐标,绘制标准曲线如图1.
2.1.2 蛋白酶酶活
四种蛋白酶在各自最适反应条件下的酶活力如表1所示.其中碱性蛋白酶的活性最高,复合蛋白酶的活性最低.
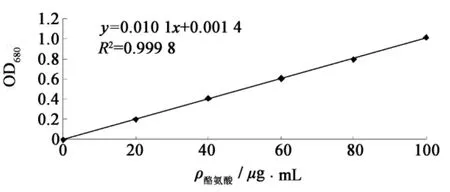
图1 酪氨酸标准曲线Fig.1 Tyrosine standard curve
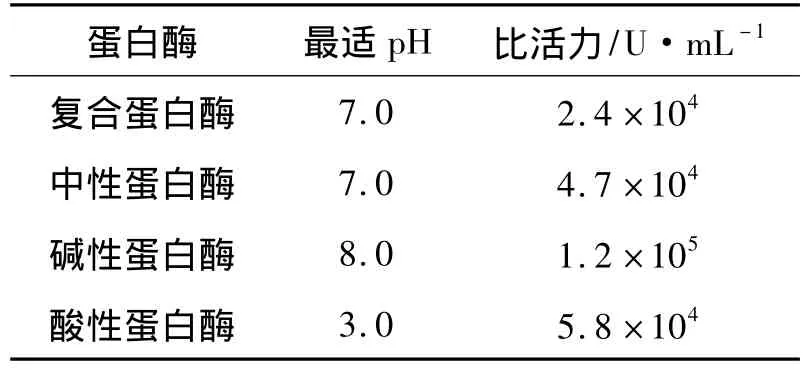
表1 四种酶的酶活力Tab.1 Activity of the four enzymes
2.2 蛋白酶种类及酶解时间筛选
蛋白酶对水解底物的作用位点具有特异性,同一种底物在不同蛋白酶的作用下结果是不同的;同一种酶经过不同时间水解出来的产物也不同.将碱性蛋白酶、酸性蛋白酶、复合蛋白酶及中性蛋白酶酶解0.5、1.0、2.0、3.0、4.0、5.0、6.0 h 的酶解产物(30 mg·mL-1)分别进行细菌低温保护实验,不同蛋白酶及酶解时间的产物经过24 h低温处理后大肠杆菌的存活率越高,说明样品对细菌的低温保护活性越强,抗冻活性越高,结果如图2所示.
由图2可以看出,酸性蛋白酶酶解产物的细菌低温保护活性普遍比其他三种酶的保护活性高,这可能是由于蛋白酶的酶切位点不同引起的,胶原蛋白经过酸性蛋白酶酶切后所暴露出来的基团会更有利于其发挥抗冻活性.由图2可知,酸性蛋白酶酶解1h所得的产物细菌存活率最高即抗冻活性最高,达到71.8%.因此,后续实验选取酸性蛋白酶酶解1 h的酶解产物进行分离.
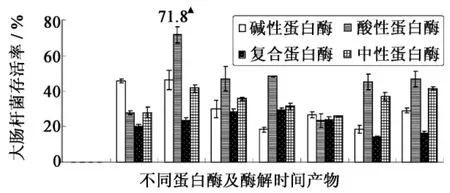
图2 不同酶解产物(30 mg·mL-1)的细菌低温保护活性Fig.2 Hypothermia protection activity of hydrolysates(30 mg·mL-1)using different proteases
2.3 抗冻多肽的分离
2.3.1 常压凝胶过滤层析(Sephadex G-50)
选取酸性蛋白酶酶解1 h得到的酶解多肽产物进行第一步分离.如图3所示,经过Sephadex G-50常压凝胶过滤色谱柱得到两个明显的峰,将其命名为S1与S2,S1在洗脱峰中优先出现,说明S1组分的分子量大于S2组分的分子量.收集两个组分,在浓度为1.25 mg·mL-1时进行细菌低温保护实验,测细菌的存活率,筛选抗冻活性较高部分进行下一步分离.结果见图4和图5.
图4为低温处理前后加有空白对照、S1组分和S2组分的细菌生长情况,由图4可知,未经过低温处理时,空白对照组和实验组对应的平板都长出较多的大肠杆菌菌落,经过24 h低温处理后,空白对照组平板的菌落数显著下降,而实验组仍有部分大肠杆菌菌落长出,这表明实验组S1、S2组分在低温下对细菌有保护作用.
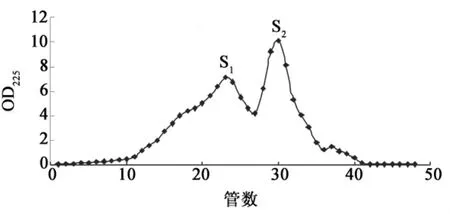
图3 明胶水解产物的Sephadex G-50色谱图Fig.3 Elution profles of gelatin hydrolysate on Sephadex G-50 column

图4 低温处理前后加有空白对照、S1组分和S2组分(1.25 mg·mL-1)的细菌生长情况Fig.4 Growth of bacteria before and after cold treatment with the addition of S1and S2(1.25 mg·mL -1)
图5为空白对照、S1组分和S2组分的细菌低温保护活性.大肠杆菌存活率越高,也就说明抗冻活性越高.由图可知加无菌水的空白对照组的大肠杆菌经过-20℃ 24 h的低温处理后存活率仅为0.6%,而加了S1、S2组分(1.25 mg·mL-1)的大肠杆菌的存活率分别为47.7%和15.8%.这表明S1和S2组分在低温下对大肠杆菌都有一定的保护作用,而且分子量较大的S1组分的抗冻活性大于分子量较小的S2组分的抗冻活性.

图5 空白对照、S1组分和S2组分(1.25 mg·mL-1)的细菌低温保护活性Fig.5 Hypothermia protection activity of control,S1and S2(1.25 mg·mL-1)
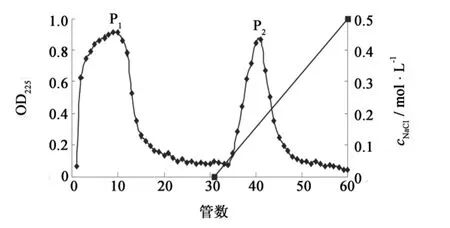
图6 S1组分的SP-Sephadex C-25离子交换色谱图Fig.6 Elution profle of fraction S1on SP - Sephadex C-25 column
2.3.2 常压离子交换色谱(SP-Sephadex C-25)
将经过Sephadex G-50柱分离得到的有较高抗冻活性的S1组分用SP-Sephadex C-25色谱进行进一步的分离.由图6可知,经过SP-Sephadex C-25色谱柱将S1组分分成了两个部分,将其命名为P1和P2,其中P1是未吸附组分,P2是吸附组分.在pH6.0的条件下,P1组分带负电,偏酸性,pI<6.0,无法与阳离子交换柱中的阳离子进行交换而优先被洗脱下来,而P2组分带正电,偏碱性,pI>6.0,能与阳离子交换柱中的阳离子进行交换而吸附在上面,只有经过高盐离子洗脱才能被洗脱下来.收集P1、P2组分,在浓度为500 μg·mL-1时进行细菌低温保护实验,筛选抗冻活性较高部分.结果见图7和图8.
图7为低温处理前后加有空白对照、P1组分和P2组分的细菌生长情况.由图可知,在未经过低温处理时,空白对照组和实验组对应的平板都长出了较多的大肠杆菌菌落,经过24 h低温处理后,空白对照组平板未长出大肠杆菌菌落,这说明低温处理已经将大肠杆菌完全杀死,而实验组仍有部分大肠杆菌菌落长出,这表明实验组P1、P2组分在低温下对细菌有保护作用.

图7 低温处理前后加有空白对照、P1组分和P2组分(500 μg·mL-1)的细菌生长情况Fig.7 Growth of bacteria before and after cold treatment with the addition of P1and P2(500 μg·mL -1)
图8为空白对照、P1组分和P2组分的细菌低温保护活性.大肠杆菌的存活率的大小可以反映出P1、P2组分的细菌低温保护活性大小,也就是抗冻活性的大小.由图可知,加无菌水的空白对照组的大肠杆菌经过-20℃ 24 h的低温处理后存活率为0.0%,而添加了P1、P2组分(500 μg·mL-1)的实验组大肠杆菌的存活率分别为20.4%和80.8%,这就表明P1和P2组分在低温下对大肠杆菌都有一定的保护作用,而且带正电荷偏碱性的P2组分的抗冻活性大于带负电荷偏酸性的P1组分的抗冻活性.
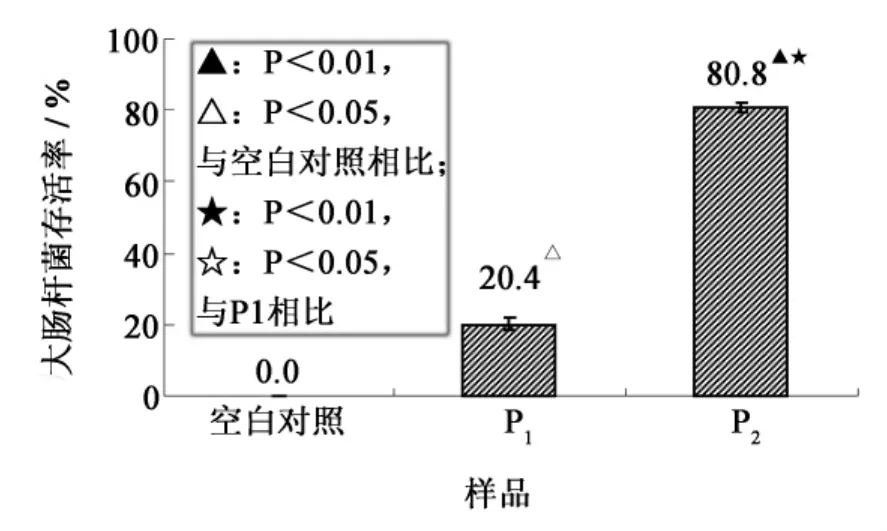
图8 空白对照、P1组分和P2组分(500 μg·mL-1)的细菌低温保护活性Fig.8 Hypothermia protection activity of control,P1and P2(500 μg·mL -1)
3 结论
用热水抽提法提取了鲨鱼皮明胶并应用于后续制备抗冻多肽的材料.以酶解产物的细菌低温保护活性为指标,从复合蛋白酶、酸性蛋白酶、碱性蛋白酶和中性蛋白酶中筛选得到了酶解鲨鱼皮明胶的最适蛋白酶种类及酶解时间,即酸性蛋白酶酶解1 h,酶解条件为:酶解温度50℃、pH 3.0、酶/底物3 000 U·g-1、底物浓度3%.通过Sephadex G-50常压凝胶过滤色谱及SP-Sephadex C-25色谱部分分离得到了细菌低温保护活性较高的抗冻多肽混合物P2,该混合物是酸性蛋白酶酶解1h酶解产物中分子量较大的一部分并且其pI>6.0,在细菌低温保护活性测定实验中,该混合物与空白对照及P1组分相比表现出了对大肠杆菌非常显著的保护活性(P<0.01).因此,在今后的研究中,我们将利用更多的分离手段得到抗冻活性更高,更纯的抗冻多肽.
[1]王书平,孔祥会.鱼类抗冻蛋白研究[J].安徽农业科学,2010,38(15):7 888-7 890.
[2]汪少芸,赵珺,吴金鸿,等.抗冻蛋白的研究进展及其在食品工业中的应用[J].北京工商大学学报,2011,29(4):50-57.
[3]Wang Shao- yun,Agyare K,Damodaran S.Optimization of hydrolysis conditions and fractionation of peptide cryoprotectants from gelatin hydrolysate[J].Food Chemistry,2009(115):620 -630.
[4]Wang Shao-yun,Damodaran S.Ice-structuring peptides derived from bovine collagen[J].Journal of Agricultural and Food Chemistry,2009,57(12),5 501-5 509.
[5]SB/T10317-1999蛋白酶活力测定法[S].北京:中国标准出版社,1999.
[6]Zhang Dang-quan,Liu Bing,Feng Dong-ru,et al.Expression,purification,and antifreeze activity of carrot antifreeze protein and its mutants[J].Protein Expression and Purification,2004,35(2):257 -263.

