一株产高温纤维素酶曲霉菌的发酵条件及培养基优化
杨 捷,严 芬,叶秀云,李仁宽,刘志坚,吕文静,林 娟
(1.福州大学生物科学与工程学院,福建福州 350116;2.福州大学酶高效表达国家工程实验室,福建福州 350002)
植物纤维是地球上最丰富且廉价的可再生资源[1].纤维素酶是能够降解纤维素生成小分子糖的一组复合酶,具有安全性和高效性,在生物能源、食品、饲料、纺织、洗涤等很多领域有着重要而广泛的应用.纤维素酶复合酶系由三类不同催化反应功能的酶组成:内切葡聚糖苷酶(endo-1,4-β-D-glucanase,EC 3.2.1.4),外切葡聚糖苷酶(exo-1,4-β -D-glucanase,EC 3.2.1.19)和 β -葡萄糖苷酶(β -1,4-glucosidase,EC 3.2.1.21).其中,内切葡聚糖苷酶因可水解羧甲基纤维素(carboxymethylcellulose,CMC)又被称为 CMC 酶(carboxymethyl cellulase,CMCase)[2-3].
目前,研究较多的纤维素酶生产微生物有木霉、曲霉等,而里氏木霉(Trichoderma reesei)来源的纤维素酶是商业化最广的产品.当前,我国纤维素酶的生产及应用虽处于快速前进阶段,但生产厂家少,规模小,远不能达到社会需求,且纤维素酶产品存在酶活低、成本高、对高温及酸碱等极端环境耐受性不佳等问题,限制了其应用.因此,通过筛选、诱变、改造等手段得到能够高效表达性质优良的纤维素酶的菌种成为研究热点[3].另外,通过培养基及工艺条件的优化可直接、快速、显著地提高菌种产酶能力和降低生产成本,对经济可行的微生物发酵过程不可或缺[4].特别是利用富含木质纤维素的稻草秸秆等农业废弃物为原料进行生产,不仅可有效利用资源,还可有效缓解因焚烧等而产生的环境污染问题[5].
由于纤维素降解菌和其产生的纤维素酶在具体的使用过程中需耐受一定的高温条件,而耐高温纤维素酶可较好地解决酶在高温下变性的问题,而且相对于中温酶,酶促反应速度快,还可解决工业生产能耗大的问题,因此,耐高温纤维素酶降解菌株的选育显得尤为重要.本课题组在前期工作中选育得到一株产高温纤维素酶的曲霉菌株F4,其CMC酶的最适反应温度为70℃;在70℃下保温4 h,仍能保持约90%的酶活力,具有很好的热稳定性.而且,F4菌株的CMC酶的最适反应pH范围为4.0~4.8,在pH 3.0~7.0之间稳定性较好[6].本研究进一步对这株曲霉菌的产酶培养基和发酵条件进行优化,以进一步提高其纤维素酶活力.
1 材料与方法
1.1 材料
1.1.1 菌株
曲霉菌株F4为课题组从稻草秸秆堆肥中筛选获得.
1.1.2 培养基
纤维素培养基:(NH4)2SO42 g·L-1,KH2PO41 g·L-1,MgSO4·7H2O 0.5 g·L-1,NaCl 1 g·L-1,CMC 15 g·L-1,pH 6.0,分装100 mL/250 mL.固体培养基添加20 g琼脂,121℃蒸汽灭菌20 min.所用化学试剂均为分析纯.
PDA培养基:马铃薯200 g,去皮,切成块煮沸30 min,然后用纱布过滤,加蔗糖20 g,溶化后补水至1 000 mL,自然pH.固体培养基加入琼脂20 g.
1.2 CMC 酶活力的测定[7]
将发酵液7 000 r·min-1离心10 min,吸取上清液作为粗酶液.取0.5 mL粗酶稀释液于具塞比色管中,加入1.5 mL 1%CMC(0.1 mol·L-1柠檬酸缓冲液,pH4.8),于50℃水浴精确反应30 min后取出,立即用沸水浴灭活,按DNS比色法测定还原糖含量.以灭活的酶液作为空白.在上述反应条件下,酶液每分钟水解底物生成1 μmol葡萄糖的能力定义为1个酶活力单位(U).每组数据均平行测定3次.
1.3 液体培养基的优化
以纤维素培养基为基础,逐一对培养基中的碳源、氮源、无机盐、表面活性剂、pH进行优化研究.
碳源对产酶的影响:分别以30 g·L-1的CMC、滤纸以及粉碎过的蔗渣(30~120目)和稻草(30~120目)作为单一碳源,加入2 g·L-1(NH4)2SO4、10 g·L-1NaCl、10 g·L-1KH2PO4和 5 g·L-1MgSO4·7H2O,pH5.0~6.0,配制成产酶液体培养基.按每瓶1.2×107个孢子接种量接种,于37℃,120 r·min-1摇床培养5 d后测定粗酶液中的CMC酶活力,确定最佳碳源.选择最佳碳源后,分别以20、30、40、50、60 g·L-1的碳源量进行实验,确定最佳碳源添加量.
氮源对产酶的影响:在碳源优化的基础上,测定2 g·L-1的尿素、(NH4)2SO4、NH4NO3、NaNO3对产酶的影响(pH5.0 ~6.0).选择最佳氮源后,分别以10、1.5、2、2.5、3、3.5、4 g·L-1的氮源量进行实验,确定最佳氮源添加量.
无机盐对产酶的影响:通过L9(34)正交实验设计产酶培养基中NaCl、KH2PO4、MgSO4和CaCl2四种无机盐配比[8](pH5.0 ~6.0),正交试验因素水平见表1.
培养基初始pH值对产酶的影响:在碳源、氮源和无机盐优化的基础上,分别将产酶液体培养基的初始 pH 调至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,确定培养基最佳初始 pH.
添加表面活性剂对菌株产酶的影响:在培养基中分别添加0.05%、0.10%、0.15%、0.20%、0.25%和0.30%的甘油或吐温-80,研究对F4菌株产酶的影响.
1.4 发酵条件的优化
接种量的优化:挑取两环经PDA平板培养基活化的F4菌株,接种于装有100 mL PDA液体培养基的250 mL的三角瓶中,于37℃、150 r·min-1的摇床上培养24 h,得到种子液.在装有100 mL稻草养基的250 mL三角瓶中,分别接入2、4、6、8和10 mL的种子液,37℃、150 r·min-1发酵6 d,研究接种量对菌株产纤维素酶的影响.
发酵温度的优化:比较F4菌株在30、37、40、45、50℃下的产酶能力,确定最适发酵温度.
装液量的优化:于250 mL锥形瓶中分别装入20、40、60、80和100 mL发酵培养基,考察不同的装液量对菌株产酶的影响.
摇床转速的优化:在上述条件优化的基础上,将菌液分别置于90、120、150、180及210 r·min-1五个转速下发酵6 d,比较产酶效果.
菌株产酶曲线的测定:将菌株在上述确立的最优条件下发酵,每24 h取样一次,测定酶活,绘制产酶曲线.
2 结果与讨论
2.1 F4菌株产酶液体培养基的优化
2.1.1 碳源种类对产酶的影响
以纤维素培养基为基础培养基,考察了5种碳源对F4菌株产纤维素酶的诱导效果.以稻草作为唯一碳源时产酶量最高,CMC酶活力达到了2.90 U·mL-1;CMC、麸皮和蔗渣的效果其次,而滤纸的效果最差(图1).稻草和蔗渣虽同属于天然纤维素,二者在纤维素组成上相似[9],但可能因为蔗渣还含有蔗糖、果糖及葡萄糖等易利用碳源,对纤维素酶的合成具有阻遏作用,因此菌株利用蔗渣产酶的效果不及稻草.另外,麸皮的成分较复杂,含有淀粉等其它碳源[10],其利用优先于纤维素,且分解产生的还原糖对于纤维素酶合成也起到阻遏作用.
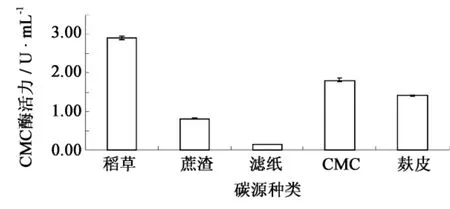
图1 不同碳源对F4菌株产纤维素酶的影响Fig.1 Effect of carbon sources on cellulase production by strain F4
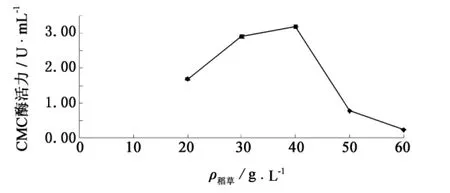
图2 稻草添加量对F4菌株产纤维素酶的影响Fig.2 Effect of rice straw additions on cellulase production by strain F4
在选择稻草作为最佳碳源后,考察不同稻草添加量对纤维素酶合成的影响.由图2可知,随着稻草添加量的增加,F4菌株的产酶能力不断增强,当稻草添加量为40 g·L-1时,CMC酶活力达到最高(3.19 U·mL-1);之后,随着稻草添加量的继续增加,产酶能力迅速下降.经观察发现,当稻草添加量为20~40 g·L-1时,发酵液菌体呈絮状,稻草呈现粉末状;而当稻草添加量为50、60 g·L-1时,发酵液菌丝球很多,极为粘稠.因此,确定稻草添加量为40 g·L-1.
2.1.2 氮源种类对产酶的影响
有机氮源诸如蛋白胨、牛肉膏等虽然营养丰富[11],但成本较高,所以主要考察3种无机氮源和一种简单有机氮源对于菌株产酶的影响(图3).在碳源优化的基础上,硫酸铵作为氮源时产酶量最高,CMC酶活达到3.20 U·mL-1,其次是硝酸铵和硝酸钠,尿素效果最差.因此选取硫酸铵作为氮源.进一步比较硫酸铵不同添加量对菌株产酶的影响(图4).随着硫酸铵浓度的增加,纤维素酶产量不断增加.当硫酸铵添加量为3.5 g·L-1时CMC酶活力达到最高,为3.35 U·mL-1.当硫酸铵浓度为4 g·L-1时酶活力又迅速下降,这可能是因为氮源量大,菌体生长过于旺盛,不利于纤维素酶的合成.因此,选取硫酸铵的最适添加量为 3.5 g·L-1.
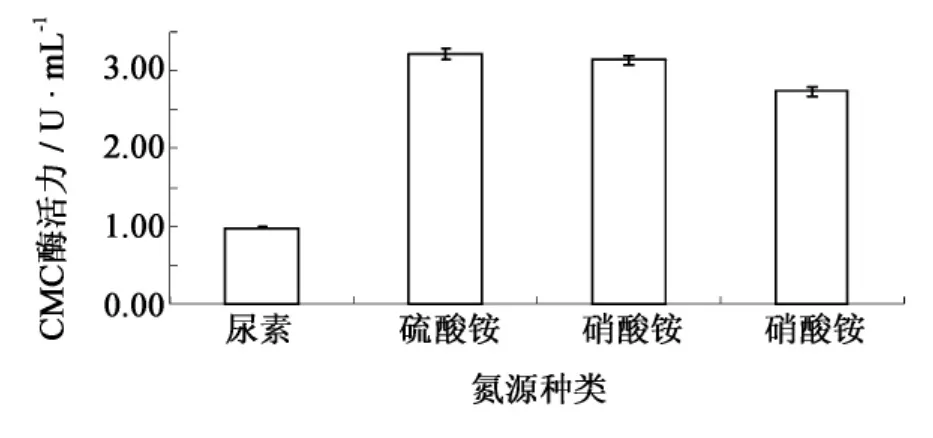
图3 不同氮源对F4菌株产纤维素酶的影响Fig.3 Effect of nitrogen sources on cellulase production by strain F4
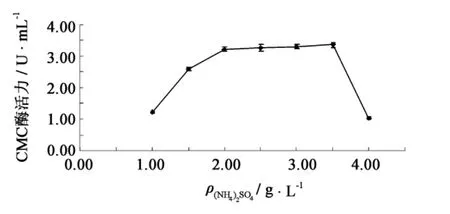
图4 硫酸铵添加量对F4菌株产纤维素酶的影响Fig.4 Effect of(NH4)2SO4concentrations on cellulase production by strain F4
2.1.3 无机盐对产酶的影响
由于稻草属于天然纤维素,其成分中已含有微生物所需的许多微量元素,因此本实验只选取4种大量元素考察其对纤维素酶合成的影响.选取氯化钠、磷酸二氢钾、硫酸镁、氯化钙作为因素,设计正交试验L9(34)进行无机盐配比优化试验(表1).
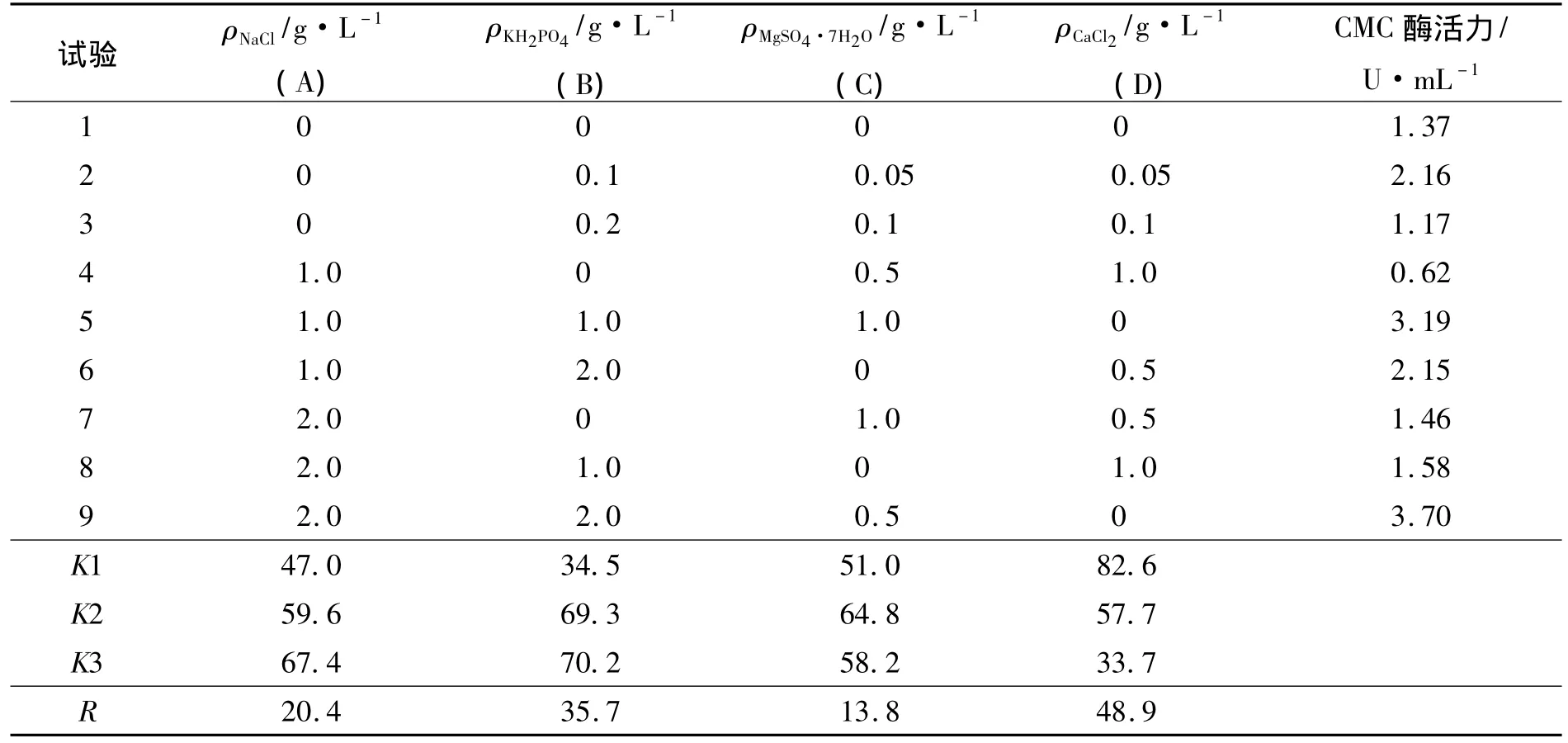
表1 无机盐对F4菌株产纤维素酶的影响Tab.1 Effect of salts on cellulase production by strain F4
由极差R可知,影响纤维素酶合成的无机盐主次顺序为D>B>A>C,最优组合为D1B3A3C2,即NaCl 2 g·L-1、KH2PO42 g·L-1、MgSO4·7H2O 0.5 g·L-1.氯化钙对于纤维素酶的合成有抑制作用,所以培养基中不宜添加氯化钙;磷酸二氢钾和氯化钠对于纤维素酶的合成具有促进作用,而硫酸镁对于纤维素酶合成的影响最小,但过高或过低都不利于纤维素酶的合成.
2.1.4 培养基初始pH值对产酶的影响
培养基初始pH值对F4菌株产酶的影响见图5.在4.0~5.5范围内随着pH值的升高,纤维素酶产量逐渐升高,当pH达到5.5时CMC酶活最高(3.77 U·mL-1);初始pH超过6.0以后,纤维素酶合成逐渐下降.由此可知,该菌株适宜生长的pH为酸性,而其纤维素酶系的最适pH和稳定pH也在酸性范围内,因此选定培养基的初始pH为5.5.
2.1.5 表面活性剂对产酶的影响
表面活性剂可以改变细胞表面的疏水性和极性等,使细胞膜更具有通透性,提高菌体胞外酶的分泌和酶与底物的接触,从而提高微生物产酶量[12].本实验考察了甘油和吐温-80对菌株发酵产酶的影响(表2).相比之下,甘油对F4菌株的产酶有较好的促进作用.当甘油的添加量为0.20%时,发酵液中CMC酶活较对照组提高了约20%;当甘油的添加量高于0.20%或吐温-80的添加量高于0.15%时,纤维素酶活力呈现下降趋势.因此,确定培养基中甘油的添加量为0.20%.
通过培养基的优化实验,最终确定培养基配方为:稻草40 g·L-1,(NH4)2SO43.5 g·L-1,NaCl 2.0 g·L-1,KH2PO42.0 g·L-1,MgSO4·7H2O 0.5 g·L-1,甘油 0.20%,pH 5.5.在此条件下 F4菌株的CMC酶活为4.07 U·mL-1,与优化前在纤维素培养基中发酵得到的CMC酶活(0.23 U·mL-1)相比,提高了16.7倍.
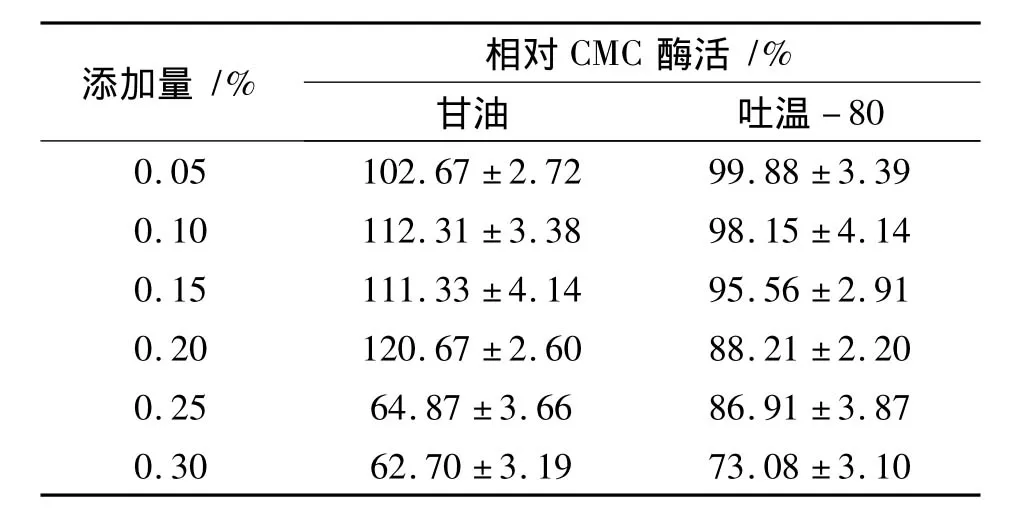
表2 表面活性剂对F4菌株产纤维素酶的影响Tab.2 Effect of surfactants on cellulase production by strain F4
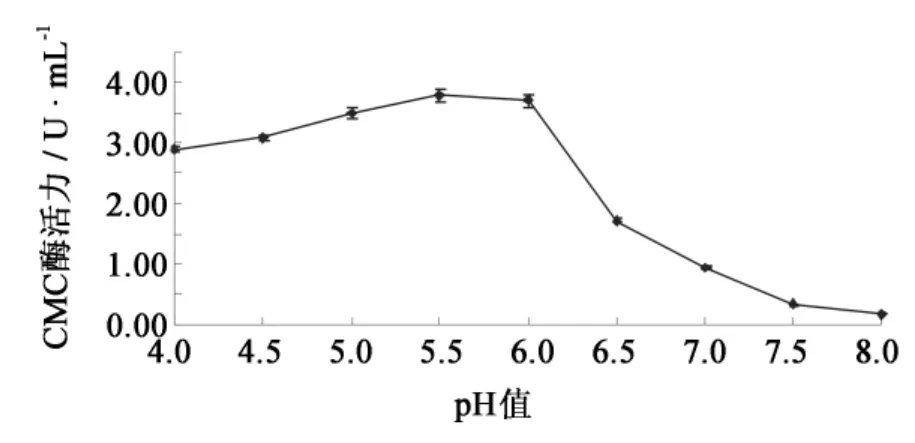
图5 培养基初始pH对F4菌株产纤维素酶的影响Fig.5 Effect of initial culture pH on cellulase production by strain F4
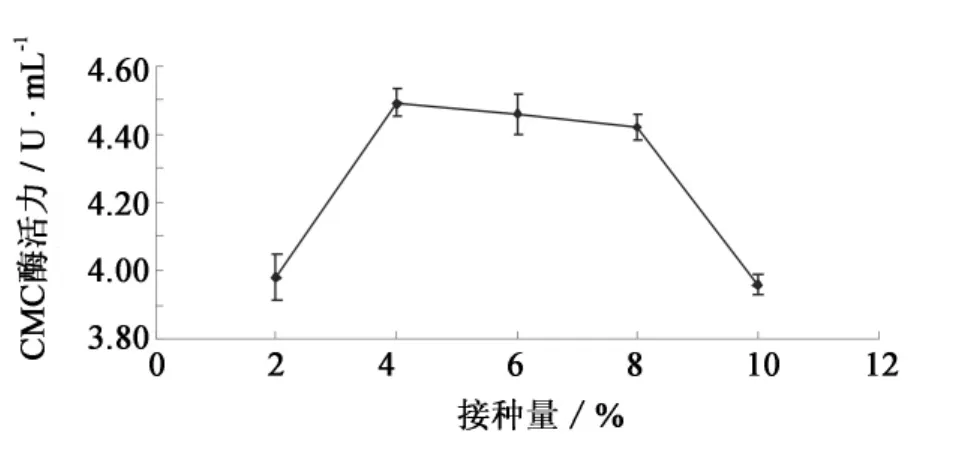
图6 接种量对F4菌株产纤维素酶的影响Fig.6 Effect of inoculation volume on cellulase production by strain F4
2.2 F4菌株发酵产酶条件的优化
2.2.1 接种量对F4菌株产酶的影响
当接种量为4%时,产生的CMC酶活力最高(图6).接种量较大(10%)时,菌株生长繁殖过快,反而影响了产酶代谢的进行,因此确定接种量为4%.
2.2.2 温度对F4菌株产酶的影响
为使菌体快速生长,代谢产物顺利合成,在30~50℃之间选取5个不同的温度进行F4菌株的产酶实验(图7).在37和40℃进行发酵都可得到较高的CMC酶活力,确定发酵温度为37℃.
2.2.3 装液量对F4菌株产酶的影响
图8表明,80 mL/250 mL的装液量最适合CMC酶的合成.随着装液量的增加,酶活力呈现下降的趋势.可能的原因是,随着装液量的增加,液体培养基中的溶解氧会逐渐降低,影响了菌体的生长和CMC酶的合成.
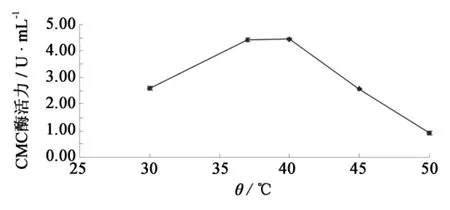
图7 温度对F4菌株产纤维素酶的影响Fig.7 Effect of temperature on cellulase production by strain F4
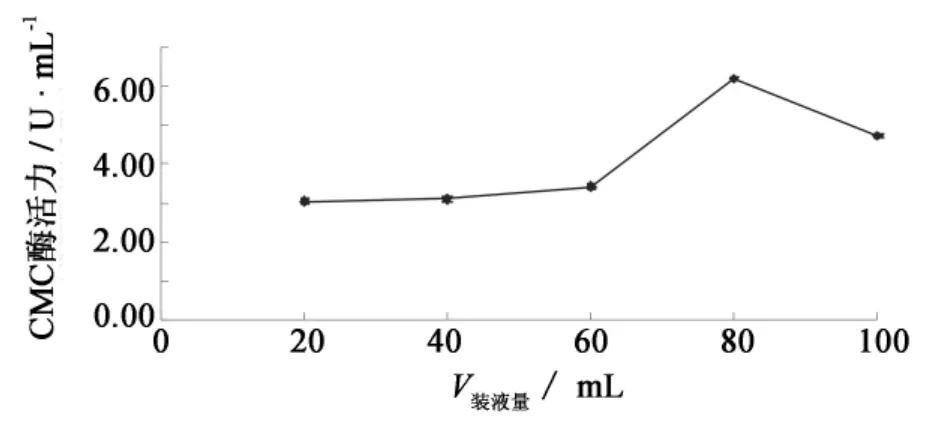
图8 装液量对F4菌株产纤维素酶的影响Fig.8 Effect of medium volume on cellulase production by strain F4
2.2.4 摇床转速对F4菌株产酶的影响
由图9可知,当摇床转速达到150 r·min-1时,CMC酶活力达到了较高水平;继续增加转速,酶活力变化不大;当转速低于150 r·min-1时,CMC酶活力明显降低.F4菌株为好氧菌,转速过低不利于菌体生长,因而影响了菌株的产酶能力;当溶氧已达到菌体生长、产酶所需要的量时,继续增大转速对菌株产酶能力的提高并不明显,因此,确定转速为150 r·min-1.
2.3 F4菌株产酶曲线的测定
在优化后的培养基和工艺条件下进行产酶实验,绘制产酶曲线(图10).随着发酵时间的延长,发酵液中的CMC酶活力逐渐增高并在第8 d达到最高(12.26 U·mL-1).与工艺条件优化前相比(4.07 U·mL-1),菌株产CMC酶的能力提高了201%.
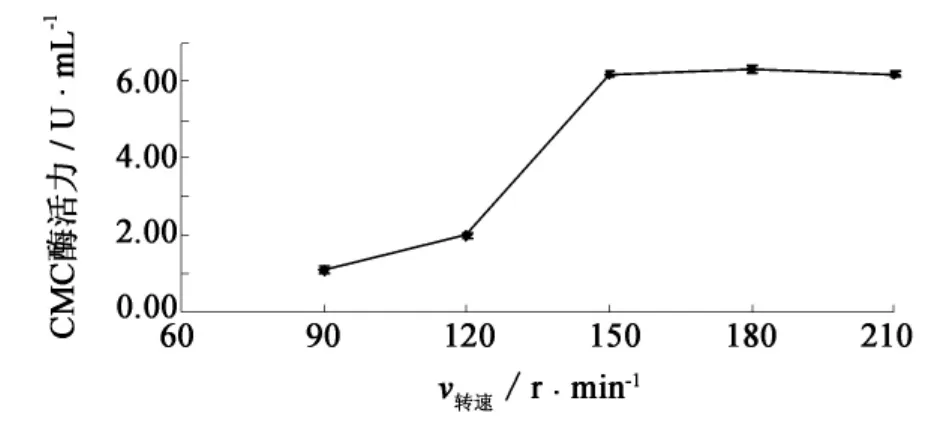
图9 摇床转速对F4菌株产纤维素酶的影响Fig.9 Effect of shaking speed on cellulase production by strain F4
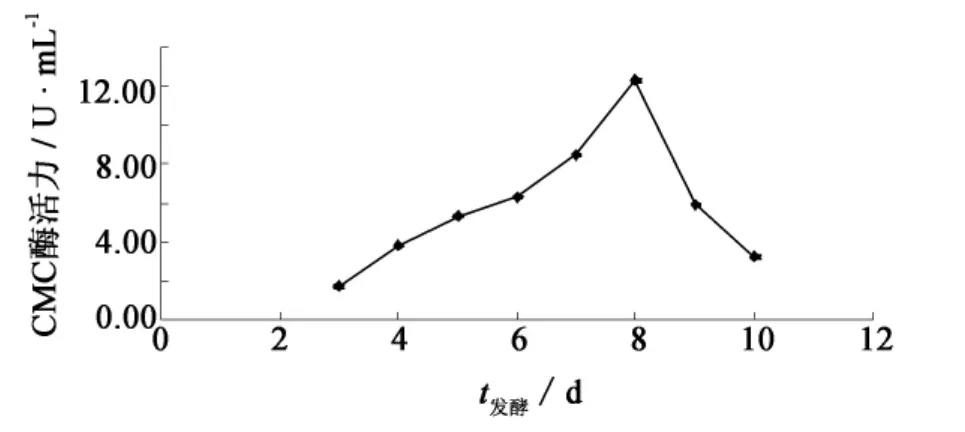
图10 F4菌株的产纤维素酶曲线Fig.10 Effect of incubation time on cellulase production by strain F4
3 结论
通过对培养基和发酵条件的优化,使得曲霉F4菌株产耐高温CMC酶的能力得到了较大幅度的提高,比优化前提高了201%;另外,利用稻草作为碳源,不仅有助于变废为宝、减轻环境污染,还可降低生产成本,为纤维素酶的工业化生产和应用打下基础.优化后稻草发酵培养基配方为:稻草粉40 g·L-1,(NH4)2SO43.5 g·L-1,NaCl 2.0 g·L-1,KH2PO42.0 g·L-1,MgSO4·7H2O 0.5 g·L-1,甘油 0.20%,pH5.5;产酶条件为:接种量4%,温度37℃,摇床转速150 r·min-1,装液量80 mL/250 mL,发酵时间8 d.
[1]邹仪明.植物纤维素化学[M].2版.北京:中国轻工业出版社,1995:152-154.
[2]Kubicek C P,Messner R,Gruber F,et al.The Trichoderma cellulase regulatory puzzle:from the interior life of a secretary fungus[J].Enzyme and Microbial Technology,1993,15(2):90-99.
[3]Zhang Y H Percival,Himmel M E,Mielenz J R.Outlook for cellulase improvement:screening and selection strategies[J].Biotechnology Advances,2006,24(5):452-481.
[4]Lynd LR,Weimer P J,Zyl W H V,et al.Microbial cellulose utilization:fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews,2002,66(3):506-577.
[5]Abdulla H M.Enhancement of rice straw composting by lignocellulolytic actinomycete strains[J].International Journal of Agriculture& Biology,2007,9(1):106-109.
[6]刘志坚.产纤维素酶耐高温菌株的选育研究[D].福州:福州大学,2009.
[7]李日强,辛小芸.天然秸秆纤维素分解菌的分离选育[J].上海环境科学,2002,21:8-11.
[8]Liu Jian,Yang Ji-chu.Cellulase production by Trichoderma koningii AS3.4262 in solid-state fermentation using lignocellulosic waste from the vinegar industry[J].Food Technology and Biotechnology,2007,45(4):420-425.
[9]张潇,朱冬青,王丹,等.粗糙脉抱菌(Neurospora crassa)木聚糖酶的合成及性质研究[J].纤维素科学与技术,2002,10(4):20-26.
[10]Cummings J H,Hill M J,Jenkins D J,et al.Changes in fecal composition and colonic function due to cereal fiber[J].American Journal of Clinical Nutrition,1976,29(12):1 468-1 473.
[11]肖冬光.微生物工程原理[M].北京:中国轻工业出版社,2004:70-80.
[12]Kosaric N.Biosurfactants:production,properties,applications[M].New York:Marcel Dekker,1993.

