毛细管电泳法用于胡芦巴中活性物质的分离和测定
黄端华,张银平,刘 薇,张 兰
(1.福建船政交通职业学院安全技术与环境工程系,福建福州 350007;2.福州大学化学化工学院食品安全分析与检测技术教育部重点实验室,福建福州 350002)
0 引言
胡芦巴是豆科一年生草本植物,药用部位是成熟后的胡芦巴干种子,有祛风、温肾、祛寒、抗糖尿病、降低胆固醇等功效,该药材能治疗腹胁胀满、支气管炎、寒疝、肾脏冷虚.中药胡芦巴中富含生物碱、黄酮和皂苷等成分,其中胡芦巴碱(TR)、槲皮素(QU)和柚皮素(NA)等为主要有效成分[1].图1为TR、QU和NA的分子结构图.葫芦巴碱具有止咳、退热、降血糖、降胆固醇等作用[2];柚皮素能治疗细菌感染,具有镇静、利胆等作用;槲皮素是较常见的黄酮类物质,具有平喘、降血压和止咳等作用.我国胡芦巴主要分布在四川、河南、安徽等地区,因产地或采摘季节不同,各产区胡芦巴中主要成分的含量存在较大差异.人们对医药使用要求逐渐提高,中药成分的含量、药理及结构分析日益受到重视,因此准确快速测定胡芦巴药材中的有效成分含量对葫芦巴质量控制及确保临床疗效有重要的指导意义.
目前,已有报道采用高效液相色谱法单独测定胡芦巴种子中TR的含量[3-4]及研究TR在大鼠体内的代谢分析[5].HPLC作为一种常规的分析方法操作较繁琐且易造成环境污染,而近年来,毛细管电泳法因其高效、快速、操作简便和分离模式多等优点,已有大量的文献报道采用CE法测定天然药物中的有效成分,Wang Hai-yan等[6]采用毛细管电泳场放大样品堆积测定苦参中的生物碱,Yin Xiao-fang等[7]采用MSS-CE法分析中成药中的的士宁和马钱子碱,Gan Zhi-bin等[8]采用CE法分析槐米和秦皮中的生物活性成分.对葫芦巴干种子中多种有效成分的提取并进行质量分析还未有文献报道.本研究采用毛细管电泳法同时分离和检测TR、QU和NA三种组分,在实验过程中,发现采用普通区带电泳法同时分离和检测这3种物质时只出现两个峰,其中一个被有机溶剂的倒峰重叠,难以被检出.本研究通过反复试验,选择了合适的添加剂和最优的电泳介质,成功解决了该问题,并实现葫芦巴中TR、QU和NA在高效毛细管电泳仪中的同时分离和检测.
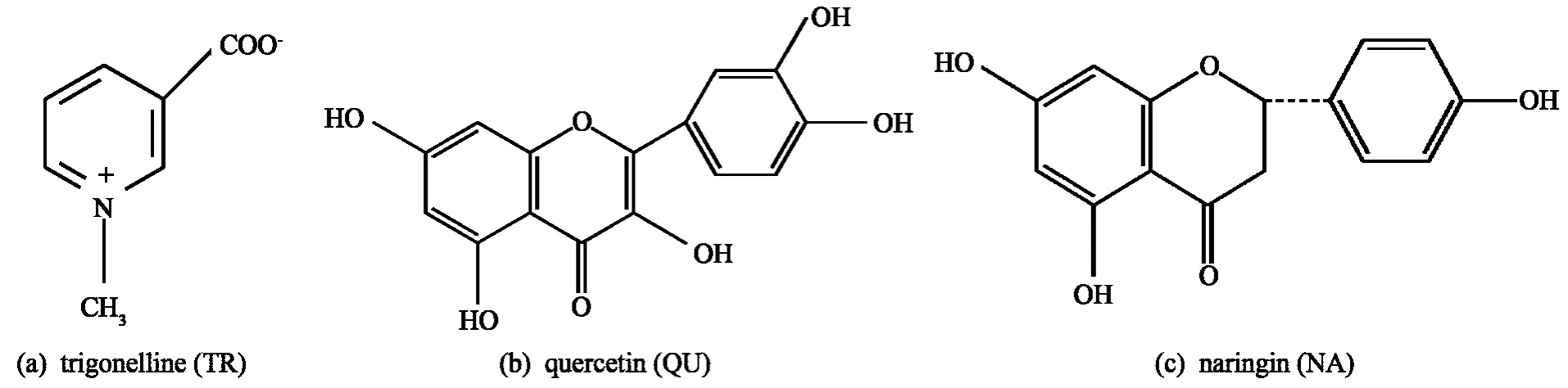
图1 TR,QU和NA的结构式Fig.1 Structures of TR,QU and NA
1 实验部分
1.1 实验仪器
高效毛细管电泳仪(俄罗斯LUMEX公司,105型),包括可变波长紫外检测器(190~400 nm);M1cw15工作站(俄罗斯LUMEX公司);未涂层熔融石英毛细管,70 cm×75 μm(id),有效长度60 cm,购自河北永年县锐丰色谱器件有限公司;紫外-可见分光光度计,双光束(760CRT).
1.2 实验试剂
胡芦巴种子药材购自福州药店,TR、NA和QU的标准品(中国药品生物制品检定所).硼酸、硼砂、磷酸二氢钾(KDP)、DMF、甲醇和曲拉通X-100均为AR级,购自中国医药集团上海化学试剂公司,水为二次蒸馏水.
1.3 实验方法
1)胡芦巴药材成分的提取及制备.准确称取2.990 g的胡芦巴种子,加入5 mL水和0.07 569 g NaCl浸泡24 h.采用超声波仪处理30 min后,过滤获得透明液体,并准确定容至5 mL.取300 μL样品,添加100 μL 甲醇和 600 μL 水,用0.22 μm 的滤膜过滤.
2)对照品溶液的配制.精确称取0.300 mg TR、QU和NA,加入体积比为2∶1的甲醇和水溶液,利用超声处理使组分充分溶解,分别配制成浓度为1 000 μg·mL-1的溶液.
3)运行液的配制.分别精确称取3.814和1.362 g的硼砂和磷酸二氢钾(KDP),定容于100 mL的容量瓶,配制成浓度为0.1 mol·L-1硼砂(Na2B4O7·10H2O)和 0.1 mol·L-1的磷酸二氢钾(KDP)母液.将稀释成10 mmol·L-1的KH2PO4(KDP)溶液分别与10 mmol·L-1Na2B4O7的溶液根据配制表的比例进行混合,配得pH为5.80~9.20的一系列KDP-Na2B4O7缓冲液.分析所用样品及运行缓冲液在使用前均经0.22 μm的滤膜过滤,并作超声脱气处理.
2 结果与讨论
2.1 检测波长的选择
根据TR、QU和NA 3组分的分子结构,经紫外分光光度计在190~400 nm范围内扫描,得知TR、QU和NA在200~240 nm范围内均有较好的紫外吸收,如图2所示.再经毛细管电泳分析试验3种混合成分在204~244 nm之间5个波长下的出峰情况,选定检测波长为224 nm.
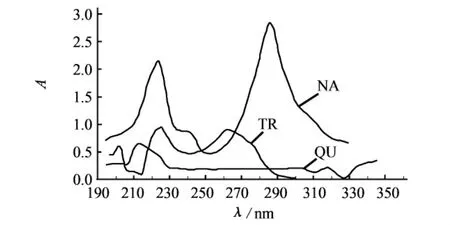
图2 TR、QU、NA的吸收谱图Fig.2 The wavelength spectrogram of TR,QU and NA
2.2 电泳介质的选择
分别以20 mmol·L-1pH 7.0磷酸盐体系、20 mmol·L-1pH 9.0 硼酸盐体系、10 mmol·L-1pH 3.0 柠檬酸体系及30 mmol·L-1pH 9.0 KDP - 硼砂缓冲体系为运行缓冲液,考察了不同的缓冲体系对出峰情况和分离效果的影响.结果表明,在硼酸-硼砂、柠檬酸盐和磷酸氢二钾-磷酸二氢钾缓冲介质中柚皮素与槲皮素无法出峰或难以分离;只有在KDP-硼砂缓冲液中能观察到其中的两个组分,且两组分电泳峰尖锐、峰形对称,因此选择KDP-硼砂溶液作为电泳介质.
2.3 运行液KDP-硼砂浓度的选择
试验了缓冲液浓度为3~15 mmol·L-1的6个点,反映缓冲溶液浓度对分析物分离效果的影响,结果见图3.由图3可知,随着浓度的增加,迁移时间也延长,但分离度得到了提高,浓度为10 mmol·L-1的缓冲溶液能够使样品在较短的时间内得到较好的分离,因此选择浓度为10 mmol·L-1.
2.4 KDP-硼砂运行液酸度的优化
考察了pH值在7.2~9.0时,添加体积分数为0.25%DMF、0.25%曲拉通的10 mmol·L-1KDP-硼砂缓冲液对TR、NA、QU分离效果的影响.缓冲溶液的pH值在电泳分离中起着重要作用,它将影响电渗流,影响分析物的迁移时间.图4表明,随着pH值的增大,3种组分呈现良好的分离趋势.pH为7.8时,3种组分迁移时间较短又能得到完全分离,选定pH为7.8.
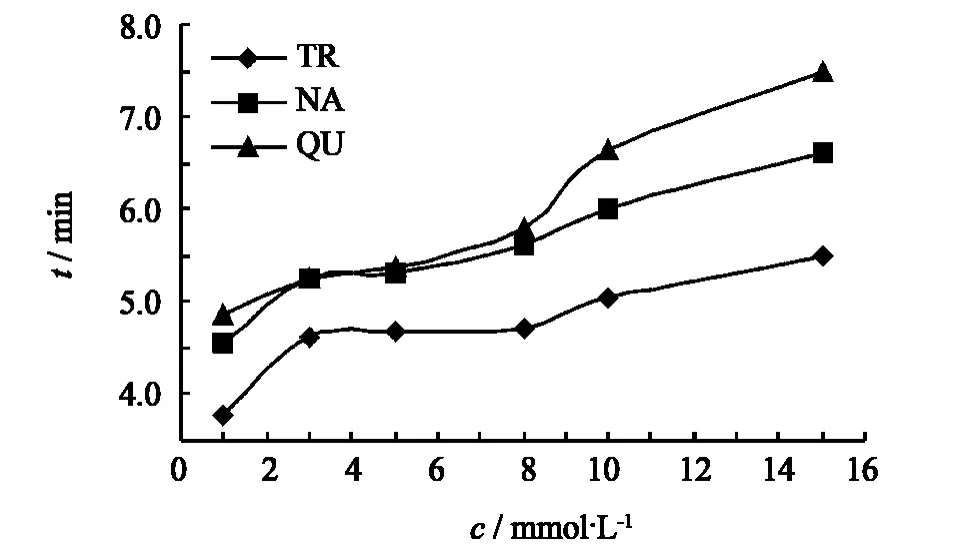
图3 KDP-硼砂体系浓度与分析时间曲线图Fig.3 Effect of concentration on migration time
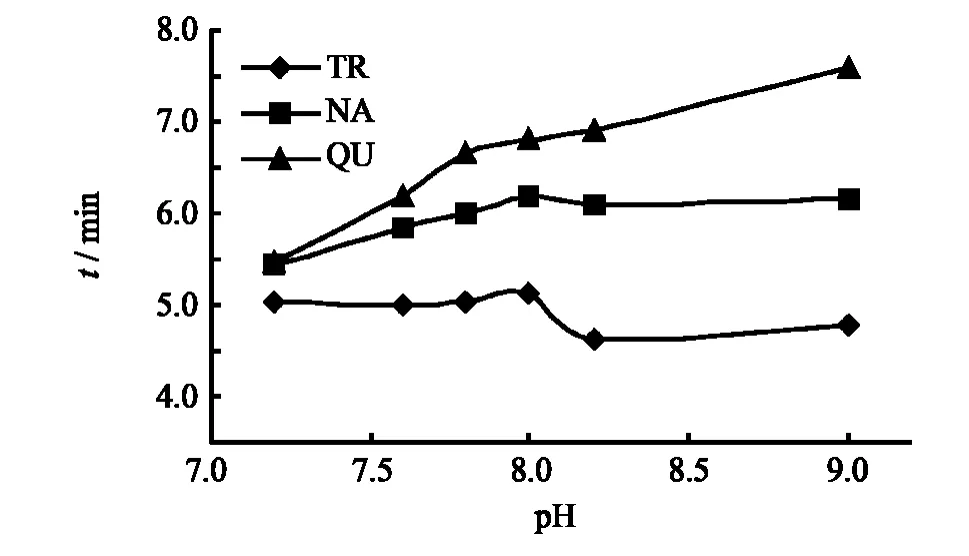
图4 pH对分析时间的影响Fig.4 Effect of pH on migration time
2.5 电泳介质中添加剂的选择及优化
实验显示,选择合适的分离缓冲溶液体系可使3种组分达到一定的分离度,但溶剂的倒峰与葫芦巴碱重合使其无法检出.有文献报道在缓冲液体系中适当引入一定量的有机溶剂或表面活性剂等添加剂可有效地改善样品的迁移时间和分离效果[9],进而提高分离选择性.实验考察了有机溶剂甲醇、乙醇、乙腈、DMF和表面活性剂SDS、triton X-100、吐温80、CTMB对分离效果的影响.结果发现,在同时添加曲拉通和DMF对溶剂与TR的分离有明显效果,能改善TR和溶剂的分离.通过实验考察triton X-100与DMF体积浓度的大小对甲醇和葫芦巴碱分离的影响.
2.5.1 Triton X -100 浓度的选择
在KDP-硼砂运行液中,3种组分能得到较好的分离,但TR在没有添加Triton X-100和DMF的情况下因受溶剂影响,TR峰与溶剂倒峰相重合.在实验过程中得知,曲拉通的加入减小了溶剂的影响.在电泳介质中添加表面活性剂曲拉通,能够降低电渗流,使各组分的迁移时间产生差异.配制含曲通浓度为0.05%、0.10%、0.15%和0.25%的电泳缓冲液,得到TR与溶剂的分离电泳谱图,见图5.图5表明,曲拉通加入量的增加使得TR受到的影响逐渐减小,TR的峰从未能检出到峰高逐渐增大,甲醇的倒峰与TR的分离也逐渐明显;图5(d)中,TR的检出不受溶剂影响,增加浓度后TR的峰高与图5(d)大致相同,为缩短分析时间,选择曲拉通体积分数为图5(d)所对应的0.25%.文中添加的曲拉通浓度未达到临界胶束浓度(cmc为0.18 mmol·L-1),仅作为添加剂使用,Trition X-100是一种非电解质高分子添加剂,它能增加缓冲液黏度,可能形成分子团或特殊的局部结构,抑制或消除电渗,从而影响样品的迁移过程,改善分离[10].
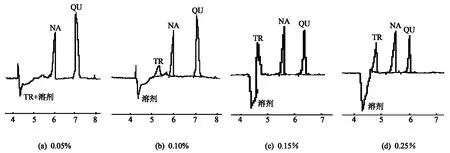
图5 不同体积浓度triton X-100的影响Fig.5 The effect of triton concentration on resolution
2.5.2 DMF 浓度的影响
经过试验,在电泳介质中仅加入DMF或仅加入曲拉通,或者其他的添加剂,均无法实现TR与溶剂的分离,只有当DMF与曲拉通进行混合使用,两种添加剂的共同作用才使溶剂的干扰减小.在电泳介质中DMF与曲拉通的共同作用表现出高的粘度,TR是带电的两性物质,溶剂为中性,两者的迁移速率在添加剂作用下产生了差异.图6是DMF浓度对分离的影响.结果显示,图6(c)体积分数为0.25%的TR的检出不受溶剂干扰,分离效果最好,迁移时间最短.
2.6 最佳分离条件
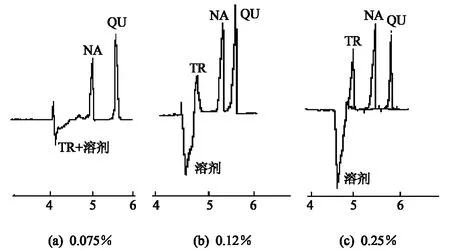
图6 DMF浓度的选择Fig.6 Effect of DMF concentration on resolution
选择最佳分离条件为:缓冲溶液为浓度为10 mmol·L-1、pH 为7.8 的 KDP - 硼砂体系,添加表面活性剂0.25%triton X-100及有机溶剂0.25%DMF,运行电压为20 kV,进样压力3.0 kPa,进样时间10 s,紫外吸收波长224 nm.图7是在最优分离条件下对对照品混合液进行电泳分离的CE谱图.
2.7 工作曲线和检出限
分别配制TR、QU和NA对照品混合样,浓度在1.0×10-6~2 ×10-4g·mL-1.在最佳的电泳条件下对标准混合液进行电泳分析,考察峰面积(Y)与对照品质量浓度(X)的线性关系.计算得到3种有效成分的回归方程、r2、检出限和线性范围,列于表1.由表1可以看出,各分析物标准曲线的r2均大于0.999;以信噪比为3确定3种组分的检出限为 0.2 ~1.0 μg·mL-1.
文献报道采用高效液相色谱测定胡芦巴中葫芦巴碱[4]和槲皮素[11]的线性范围分别是3.75 ~37.5 μg·mL-1和 0.184 ~3.68 μg·mL-1,而本实验测定葫芦巴碱的线性范围是 3.0 ~200.0 μg·mL-1,检测限 0.7 μg·mL-1,测定槲皮素的线性范围 5.0 ~150.0 μg·mL-1.通过比较表明,所建立的方法线性范围宽,检测限低.
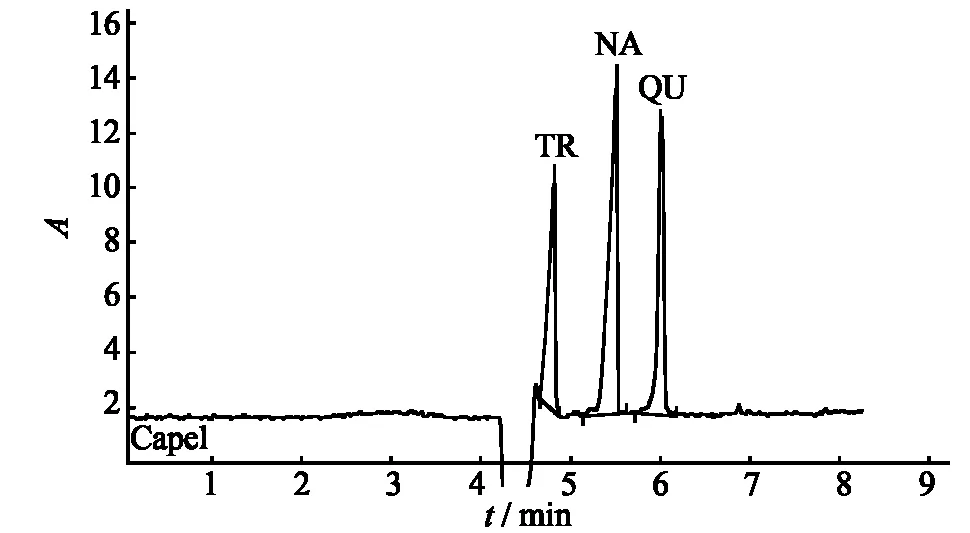
图7 3种成分对照品的CE谱图Fig.7 The electrophorograms of mixed standards

表1 线性关系和检测限Tab.1 The regression equations and the detection limits
配制浓度为120 mmol·L-1的TR,50 mmol·L-1的QU 和90 mmol·L-1的NA 混合标准样,在最优条件下进行测定,重复分析5次,计算得到峰面积及迁移时间的RSD,列于表2.由表2可以看出,迁移时间的相对标准偏差(RSDs,n=5)在1.5%以内;峰面积的RSDs(n=6)在5%以内.
2.8 样品测定及加标回收实验
在最优条件下,采用工作曲线法定量分析提取后的胡芦巴样品,测得其中葫芦巴碱、槲皮素和柚皮素的含量结果为28.6、2.7、45.6 μg·g-1,详见表3.胡芦巴实际样品的电泳谱图见图8.从图8中可知,样品中的有效成分在最佳条件下均实现了分离.
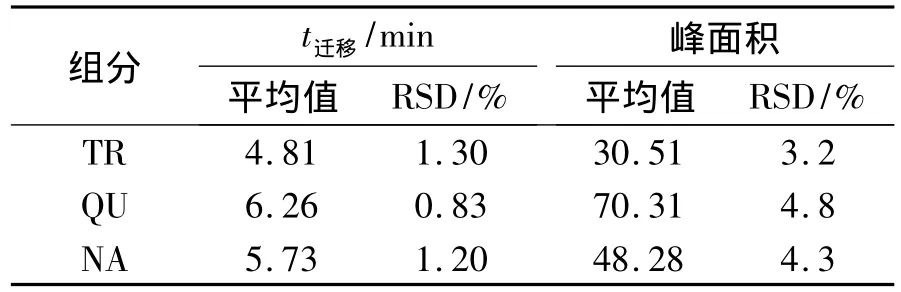
表2 峰面积及迁移时间的精密度Tab.2 The repeatability of peak area and migration time(n=5)
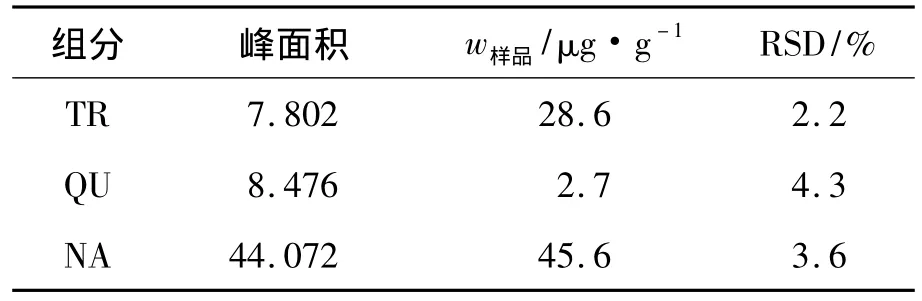
表3 胡芦巴干种子样品中组分的含量Tab.3 Content of analytes in fenugreek samples(n=5)
分别向胡芦巴样品提取液中准确地添加两种质量浓度的葫芦巴碱、柚皮素及槲皮素的对照品混合液,使得所添加浓度为20.00和40.00 μg·mL-1,每个添加水平重复测定5次,计算出回收率和精密度,列于表4.从表4可以看出,TR、NA和QU的平均回收率分别为95.5% ~111.2%,RSD为2.2% ~3.8%.回收率与精密度基本满足胡芦巴中3种有效成分的检测要求.
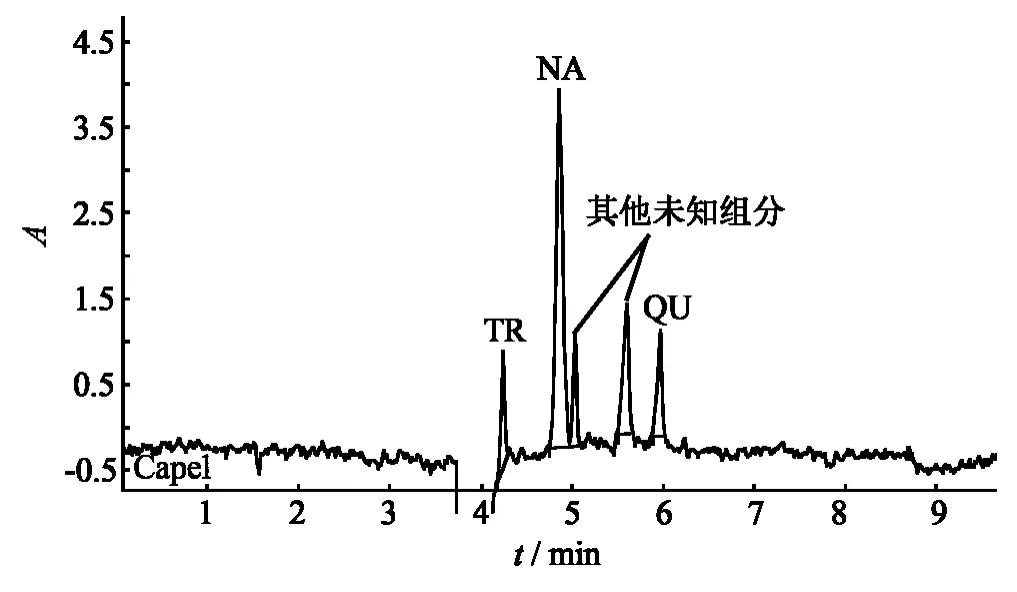
图8 葫芦巴种子样品CE谱图Fig.8 The electrophorograms of real sample
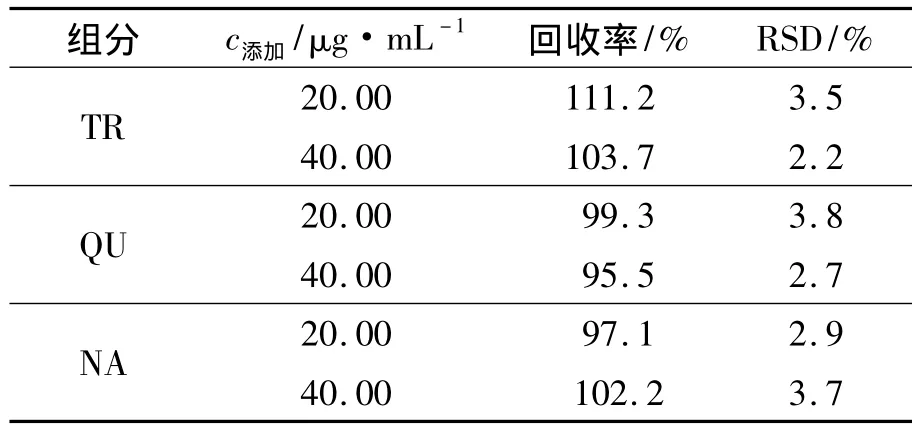
表4 添加不同质量浓度组分的回收率Tab.4 Recoveries for the analytes at different spiked levels(n=5)
[1]周淑晶.中药葫芦巴的化学成分研究进展[J].中药研究与信息,2000,2(5):19-22.
[2]史江华,李多伟,逄敏杰,等.葫芦巴研究新进展[J].西北药学杂志,2007,22(3):153-155.
[3]刘广学,尚明英,李辉,等.胡芦巴药材中胡芦巴碱的提取方法及其含量测定[J].中国药品标准,2005,6(4):11-14.
[4]吴延丽,李微,林锋,等.大庆产胡芦巴种子中生物碱及总黄酮成分的研究[J].哈尔滨医科大学学报,2007,41(4):385-387.
[5]陈勇,沈少林,陈怀侠,等.HPLC-MSn法鉴定葫芦巴碱及其在大鼠体内的主要代谢产物[J].药学学报,2006,41(3):216-220.
[6]Wang Hai-yan,Lu Yu - chao,Chen Jie,et al.Subcritical water extraction of alkaloids in Sophora flavescens ait and determination by capillary electrophoresis with field - amplified sample stacking[J].Journal of Pharmaceutical and Biomedical Analysis,2012,58:146 -151.
[7]Yin Xiao-fang,Li Zhi,Zhang Shuai-hua,et al.Determination of strychnine and brucine in traditional Chinese medicine preparations by capillary zone electrophoresis with micelle to solvent stacking[J].Chinese Chemical Letters,2011,22:330 -333.
[8]Gan Zhi-bin,Chen Qi-wen,Fu Yue-jiao,et al.Determination of bioactive constituents in flos sophorae immaturus and cortex fraxini by capillary electrophoresis in combination with far infrared - assisted solvent extraction[J].Food Chemistry,2012,130:1 122-1 126.
[9]Dimitrova Pepa,Bart Hans-Jorg.Non-ionic surfactant modified ligand exchange chromatography using copper(II)complex of N,N -dimethyl-l-phenylalanine as the chiral additive for enantioselective amino acids separation[J].Analytica Chimica Acta,2010,663:109-116.
[10]陈义.毛细管电泳技术及应用[M].2版.北京:化学工业出版社,2005:49.
[11]鲁鑫焱,张超,赵怀清,等.不同产地胡芦巴中总黄酮和槲皮素的含量测定[J].沈阳药科大学学报,2004,21(6):430-433.

