葡萄糖氧化酶-Nafion-钛酸盐纳米带修饰电极的电化学性能研究
刘州洲,宋英攀,冯苗,詹红兵
(福州大学材料科学与工程学院,福建福州 350116)
0 引言
钛酸盐是一种广泛应用于牙科材料以及化妆品的环境友好型材料.其纳米结构不仅具有优良的生物相容性、导电性、化学和热稳定性,且制备简单,通过水热法即可获得许多不同的结构,如纳米带、纳米线、纳米管和纳米花等[1-5].酶生物电化学是近年来研究的热点,作为酶电极材料,要有良好的生物相容性以及导电性,而钛酸盐纳米材料由于表面微弱的负电荷有利于蛋白质的吸附,且对吸附在其上的蛋白质稳定性影响很小[6-7],可望应用于制备基于蛋白质的生物电极材料.目前已有关于钛酸盐纳米片和纳米管的酶生物电化学性能的研究报道[8-11].
钛酸盐纳米带(titanate nanobelts,TNBs)是一种新型钛酸盐纳米结构,具有钛酸盐纳米材料的优良性能,其高比表面积有利于吸附更多蛋白质等活性物质,在电极材料与目标溶液间的电子转移中起到重要作用,同时它又具有机械强度和化学稳定性,是一种潜在的优良电极表面修饰材料.鉴于目前尚无钛酸盐纳米带关于酶生物电化学性能的报道,拟对葡萄糖氧化酶(GOx)-Nafion-TNBs修饰电极的电化学性能展开研究.将TNBs与GOx的磷酸盐缓冲液(phosphate buffered solution,PBS)、Nafion 按一定体积比混合后滴涂于玻碳电极表面,用循环伏安法对其进行电化学研究.
1 实验部分
1.1 试剂与仪器
TiO2粉末(分析纯,国药集团化学试剂有限公司),NaOH、HCl和乙醇(分析纯,国药集团化学试剂有限公司),Nafion(低脂肪醇中的质量分数为5%,美国Dupont公司),GOx(50 KU生工生物工程有限公司,-20℃下保存),葡萄糖(生工生物工程有限公司).
采用日本Rigaku Miniflex II型X射线衍射分析仪(CuKα,λ=0.153 06 nm,管电压35 kV,工作电流25 mA)对样品粉末进行晶体结构分析,采用美国FEI公司的Nova NanoSEM 230型扫描电子显微镜(SEM,加速电压15 kV)和Tecnai G2 F20 S-TWIN型透射电子显微镜(TEM,加速电压200 kV)对样品进行形貌表征,采用美国Perkin Elmer公司的FT-IR spectrum 2000红外光谱仪(FT-IR)分析样品结构.采用上海辰华的CHI620D型电化学工作站对电极进行循环伏安法测试.
1.2 材料与修饰玻碳电极的制备及修饰电极电化学性能测试
TNBs由TiO2粉末通过水热法在强碱溶液制备而成[4].将0.9 g的TiO2粉末分散在NaOH溶液中(10 mol·L-1,50 mL),将混合溶液倒入聚四氟乙烯内衬的反应釜中,在180℃下反应72 h.将生成物用去离子水和0.1 mol·L-1的HCl水洗多次,得到的絮状物在400℃下煅烧5 h,最终得到的产物为TNBs.
取2 mg经表面处理的TNBs,分散在1 mL水中,超声10 min.将GOx(10 mg)溶解于PBS(1 mL,50 mmol·L-1,pH 7.0)溶液中.采用体积比1∶1的水和乙醇将Nafion从5%稀释至0.5%后,再将GOx-PBS溶液与Nafion和TNBs溶液按体积比1∶1∶2混合得到GOx-Nafion-TNBs溶液.所有溶液均在4℃下保存.
玻碳电极在修饰之前,先将其在金相砂纸上打磨并用二次蒸馏水充分冲洗,然后依次在1、0.3和0.05 μm的Al2O3悬浊液上抛光成镜,抛光结束后依次用丙酮和二次蒸馏水超声清洗5 min并在室温下晾干.取6 μL的GOx-Nafion、GOx-Nafion-TNBs溶液,滴涂在玻碳电极上并于4℃下晾干,获得表面修饰的玻碳电极.
电化学测试均采用三电极系统并且在室温下进行,参比电极为Ag/AgCl(饱和KCl溶液),对电极为Pt丝,工作电极为经过修饰的玻碳电极.采用循环伏安法PBS溶液(0.1 mmol·L-1,pH=7)中进行.如需除氧时,将溶液通高纯氩气至少20 min,且实验时溶液保持在氩气气氛下,以防止空气对电极工作时产生影响.
2 结果与讨论

图1 TNBs的SEM图像(插图:单根TNB的HRTEM)Fig.1 SEM image of the TNBs(inset:HRTEM image of a TNB)
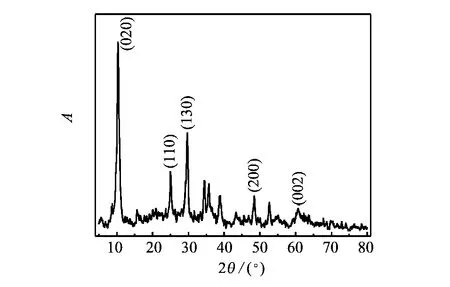
图2 TNBs的XRD图谱Fig.2 XRD pattern of the TNBs
图1为TNBs的电镜照片.图1显示TNBs是单一的带状结构,长度为3~5 μm,宽度为40~100 nm,从插图可以看出,TNBs结晶良好,并且表面光滑没有任何杂质.图2为TNBs的XRD衍射图谱,TNBs的最强峰2θ在10°附近.该钛酸盐的特征峰为10.2°、25°和29.7°,对应 Na2Ti3O7(JCPDS卡片号:72-0148).由于水洗过程中有部分Na+被H+置换出来,故推测该TNBs的化学组分为NaxH2-xTi3O[12]7.
图3是TNBs的FT-IR光谱图,其中1 622、906、696、495 cm-1是产物的特征峰.495 cm-1峰是两个八面体的Ti-O-Ti的刚性振动引起的;696 cm-1是Ti-O-Na的振动;906 cm-1峰的出现是由4个等同的没有链接Na原子的Ti-O键伸缩振动所引起的;1 622 cm-1为H-O-H的弯曲振动;3 158 cm-1为-OH的振动引起的,这是由于TNBs表面有-OH基团的存在.由产物的FT-IR可以得出,该产物有Ti-O -Ti、Ti-O -Na、Ti-O 和表面的 Ti-OH 键存在[13].
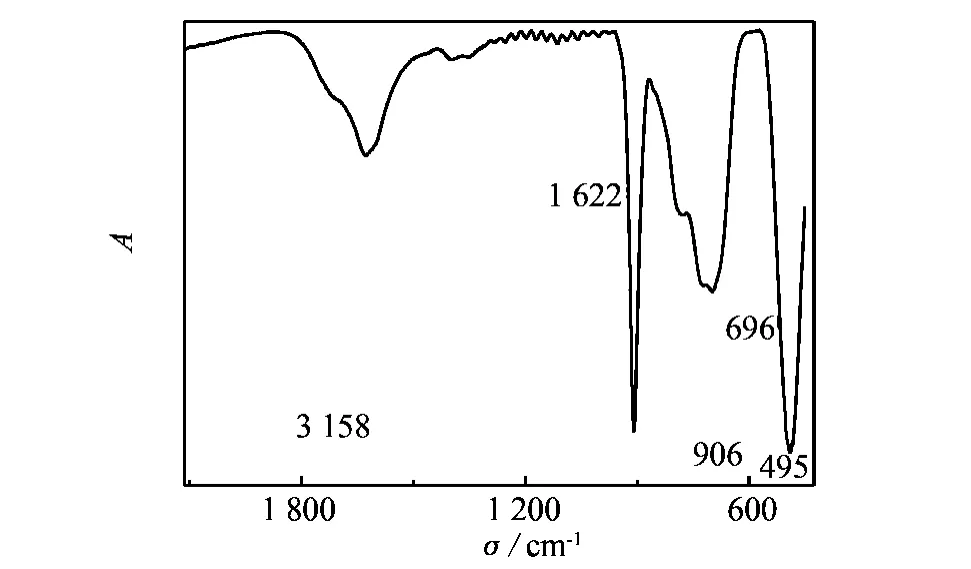
图3 TNBs的FT-IR光谱图Fig.3 FT - IR spectra of the TNBs
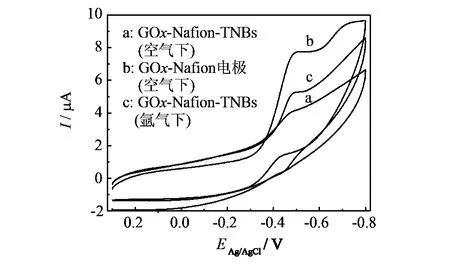
图4 在PBS溶液中各电极的循环伏安曲线(扫描速率 100 mV.s-1)Fig.4 Cyclic voltammograms of the electrodes in PBS(scan rate 100 mV/s)
图4为PBS溶液中各电极的循环伏安曲线(扫描速率100 mV·s-1).从图4可见,GOx-Nafion电极在PBS溶液中出现微弱的氧化还原峰(曲线a),这可能是因为在该电极中电子转移十分缓慢,或者是Nafion并不能吸附蛋白质以至于GOx反应时电子无法转移出来[14].而GOx-Nafion-TNBs电极存在一对氧化还原峰(曲线b).而在氩气气氛下(曲线c),其还原峰电位的最大值在-0.514 V,氧化峰电位的最大值在 -0.452 V,峰位差(ΔEP)为0.062 V ,式量电位Eθ'= -0.483 V,表明固定在TNBs上的GOx能进行直接电化学反应.由于TNBs表面存在游离态的H+,会与GOx中的FAD(flavin adenine dinucletide,黄素腺嘌呤二核苷酸)反应生成还原型的FADH2,在O2存在的情况下,会促进反应进行,所以在空气气氛下的还原峰峰值电流最强,如反应式(1)和(2).
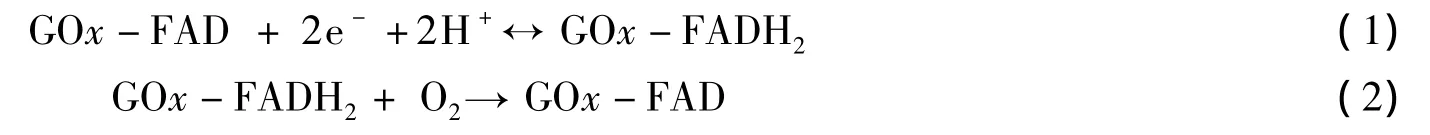
因为GOx分子体积相对较大,其氧化还原中心即GOx(FAD)/GOx(FADH)电对深埋在酶分子内部,与电极表面的距离超过了电子以足够快速率进行转移的范围,因此在裸电极上通常难以进行电子转移[15].GOx-Nafion-TNBs电极的强化电催化响应起因有二:一是TNBs有良好的生物相容性和较大的表面积,能更多地吸附GOx分子,有利于大量的电子转移;二是TNBs有良好的导电性,能够在电极与酶分子间建立优良的电子传递通道.
图5为扫描速率100 mV·s-1时,在空气气氛下不同葡萄糖浓度的PBS溶液中GOx-Nafion-TNBs电极的循环伏安曲线.随着葡萄糖浓度的增大,氧化与还原峰的峰值电流相应减小.由于体系中存在游离态的H+会与GOx中的FAD反应生成还原型的FADH2,在O2存在的情况下,还原型的FADH2会被O2氧化为FAD,如反应式(1)、(2)所示.另一方面,葡萄糖是GOx催化的底物,将葡萄糖加入含有空气的PBS溶液中时会发生GOx的催化反应,将葡萄糖氧化成葡萄糖酸内脂,如反应式(3),从而导致电极表面的氧化型GOx减少,这样会削弱反应式(1)与(2)的进行.因此,葡萄糖浓度增加会抑制电催化反应的进行,导致还原峰电流减小,依此作为一种检测葡萄糖浓度的有效手段.
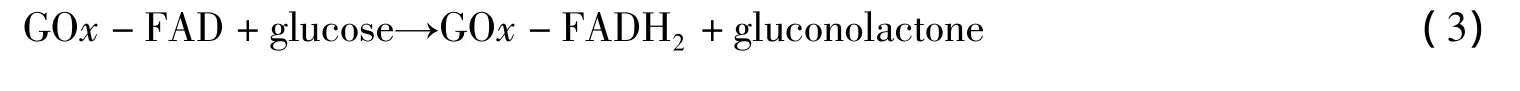
图6为含有15 mg·mL-1葡萄糖的PBS溶液中不同扫描速率GOx-Nafion-TNBs电极的循环伏安曲线(扫描速率50~250 mV·s-1),由此得到其氧化还原峰所对应的峰值电流与扫描速率之间的关系(插图).可见,随着扫描速率从50增加到250 mV·s-1,氧化还原峰所对应的峰值电流与扫描速率几乎呈线性递增关系,ΔEp增加,但Eθ'几乎不变,Eθ'=-0.434±0.004 V说明GOx的电催化反应是一个表面控制过程,且GOx与TNBs牢固地固定在电极表面.峰间差非常小,说明电子转移速度非常快,也说明了GOx均匀分散在 GOx-Nafion-TNBs电极表面.由插图可计算出,Ipc=0.649 6+0.012 4v(R=0.995 μA).
由于nΔEP<200 mV,根据 Laviron公式[16]:
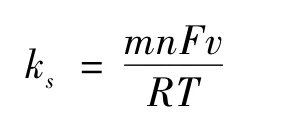
其中:R是气体常数;F是法拉第常数;T是开氏温度;转移系数α取0.5,计算得出在50~250 m V·s-1时ks大约平均为4.97 s-1(25℃),这表明TNBs能促进GOx的直接电化学反应.
通过法拉第公式:Q=nFAΓ*(其中:Q为还原峰的积分面积,A为电极的工作面积,F为法拉第常数,n为转移的电子数),可以计算出电极表面酶的表观吸附量Γ*.在本实验中,计算得出电极表面GOx的表观吸附量Γ*=6.31×10-11mol·cm-2,显示了GOx在TNBs构成的三维空间网络结构中的高吸附量,进一步说明TNBs的存在有利于保持蛋白质酶的生物活性,促进GOx分子与电极之间的电子传递.
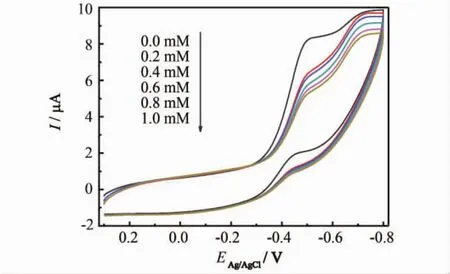
图5 不同葡萄糖浓度下PBS溶液中GOx-Nafion-TNBs电极的循环伏安曲线(扫描速率100 m V·s-1)Fig.5 Cyclic voltammograms of GOx-Nafion-TNBs electrodes in PBS with different concentrations of glucose(scan rate 100 mV·s-1)
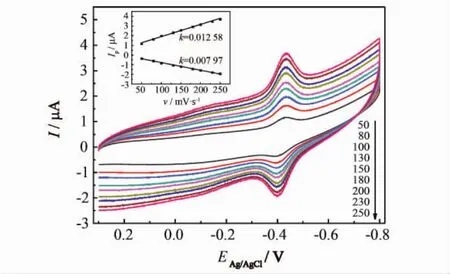
图6 含有15 mg·L-1葡萄糖的PBS溶液中不同扫描速率GOx-Nafion-TNBs电极的循环伏安曲线(扫描速率50~250 mV·s-1)(插图:氧化还原峰所对应的峰值电流与扫描速率之间的关系)Fig.6 Cyclic voltammograms of the GOx-Nafion-TNBs electrode in PBS with 15 mg·L-1glucose at different scan rates(scan rates scan rates 50~250 mV·s-1)(Inset:plots of peak currents versus scan rates)
3 结语
采用水热法制备出TNBs.制备的TNBs结构为(NaxH2-xTi3O7),表面带有羟基基团,长度为3~5 μm,宽度为40~100 nm.用TNBs吸附GOx制成葡萄糖生物传感器.计算结果表明GOx-Nafion-TNBs修饰电极上的直接电子转移速率常数为4.97 s-1,电极表面GOx表观吸附量为6.31×10-11mol·cm-2.TNBs构成的三维空间网络结构不仅可以为GOx提供一个稳定的显微工作环境,而且能与其牢固结合,并为电子从GOx转移到电极表面提供一个快速通道,对其电化学性能起到积极的促进作用.
由于TNBs的以上性能,我们期待基于TNBs复合材料的电化学生物传感器在葡萄糖的检测上有广泛的应用,并且能拓展第三代生物传感器的电极材料的种类.
[1]Miao L,S Tanemura,Huang R,et al.Synthesis of cation - intercalated titanate nanobelts[J].Journal of Nanoscience and Nanotechnology,2011,11:9 267-9 273.
[2]Li N,Zhang L D,Chen Y Z,et al.Highly efficient,irreversible and selective ion exchange property of layered titanate nanostructures[J].Advanced Function Materials,2012,22:835 -841.
[3]Li N,Zhang L D,Chen Y Z,et al.Adsorption behavior of Cu(II)onto titanate nanofibers prepared by alkalitreatment[J].Journal of Hazardous Materials,2011,189:265 -272.
[4]Miao L,Ina Y,S Tanemura,et al.Fabrication and photochromic study of titanate nanotubes loaded with silver nanoparticles[J].Surface Science,2007,13(601):2 797-2 799.
[5]Huang J Q,Cao Y G,Liu Z G,et al.Efficient removal of heavy metal ions from water system by titanate nanoflowers[J].Chemical Engineering Journal,2012,180:75 -80.
[6]Topoglidis E,Cass A,Gilardi G,et al.Protein adsorption on nanocrystalline TiO2films:an immobilization strategy for bioanalytical devices[J].Analytical Chemistry,1998,70(23):5 111 -5 113.
[7]Zhang L,Zhang Q,Lu X B,et al.Direct electrochemistry and electrocatalysis based on film of horseradish peroxidase intercalated into layered titanate nano - sheets[J].Biosensors Bioelectronics,2007,23(1):102 -106.
[8]Dai H,Xu H F,Wu X P,et al.Electrochemical behavior of thionine at titanate nanotubes-based modified electrode:a sensing platform for the detection of trichloroacetic acid[J].Talanta,2010,81(45):1 461 -1 466.
[9]Dai H,Lin Y,Wu X,et al.A new electrochemiluminescent sensing interface for clonazepam based on titanate nanotubes selfassembled film[J].Sensors and Actuators:B,2010,145(1):320-326.
[10]Zhang L,Zhang Q,Li J H.Layered titanate nanosheets intercalated with myoglobin for direct electrochemistry[J].Advanced Function Materials,2007,17(12):1 958 -1 965.
[11]Bao S J,Li C M,Zang J F,et al.New nanostructured TiO2for direct electrochemistry and glucose sensor applications[J].Advanced Function Materials,2008,18(4):591 -599.
[12]Feng M,Zhan H B,Miao L.Facile solubilization of titanate nanobelts for nonlinear optical investigations[J].Nanotechnology,2010,21:185 707-185 712.
[13]Huang J Q,Cao Y G,Wang M L,et al.Tailoring of low -dimensional titanate nanostructures[J].Journal of Physical Chemistry C,2010,114:14 748-14 754.
[14]Wu,S,Ju H X,Liu Y.Conductive mesocellular silica-carbon nanocomposite foams for immobilization direct electrochemistry and biosensing of proteins[J].Advanced Function Materials,2007,17(4):585 - 592.
[15]Yang M L,Wang J,Li H Q,et al.A lactate electrochemical biosensor with a titanate nanotube as direct electron transfer promoter[J].Nanotechnology,2008,19(7):075 502 -075 507.
[16]Laviron E.General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J].Journal of Electroanalytical Chemistry,1979,101(1):19-28.

