有关化学反应速率与化学平衡中几个概念的探讨
杨 帆
(湖州师范学院生命科学学院 浙江 湖州 313000)
一、化学反应速率与化学反应速度
在化学教材和论文中,经常可见到化学反应速率和化学反应速度这两个词语,它们常被用来表达相同的含义,即化学反应进行快慢的程度。但是,物理学上速率和速度是两个不同的概念。速率是一个标量,标量是有大小而无方向的量;而速度却是失量,既说明大小又表明方向。所以,速率仅为绝对大小,不会有表现方向的正或负;而速度则不然,可能是正值或负值,代表了两个相反的方向。当然,化学反应多数都是可逆反应,的确是存在两个不同的方向,但是,化学反应的方向是化学热力学重点讨论的问题。而化学反应速率则是化学动力学中的主要问题,在数值上仅表现化学反应进行的快慢,而不反映进行的方向。
在中学课本中,化学反应速率是采用反应物或生成物的浓度随着时间的变化率来表示。公式如下:
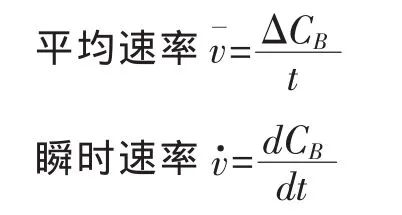
对于反应物,浓度的变化为减少量,化学反应速率即是反应物的消耗速率;对于生成物,浓度变化为增加量,化学反应速率即是生成物的增加速率。无论以哪个物质来计算化学反应速率,浓度变化均取正值,所以化学反应速率也绝不会出现负值。
所以,在语言上使用化学反应速率比化学反应速度更合理,建议摒弃化学反应速度的用法而统一使用化学反应速率这一术语。并且建议在公式中加绝对值符号,即
浓度的变化取末、始态即反应物或生成物在反应后和反应前的浓度之差,即使浓度的变化有正、负值,但最终的速率都为绝对值。这样更能体现化学反应速率的标量性质,仅有大小而无表现方向的正、负号。
二、化学反应速率、正反应速率及逆反应速率
中学阶段,在专门学习化学反应速率时并没有涉及正反应速率和逆反应速率。但是,在学习化学平衡时说到:当可逆反应的正反应速率与逆反应速率相等时化学反应达到平衡状态。而对正反应速率和逆反应速率的概念缺乏进一步的解释,造成学生对化学反应速率、正反应速率及逆反应速率理解上的混乱。通过互联网查询发现提出相关问题的不少而回答准确清楚的却并不多。不少人认为:可逆反应的化学反应速率即为这个反应的正反应速率。
化学反应速率既非正反应速率亦非逆反应速率,而是两者之差。对于一个可逆反应同时存在着正方向进行的反应和逆方向进行的反应。而整个化学反应表现为在这两个方向上综合进行的结果。
以 2SO2(g)+O2(g)⇌2SO3(g)为例,同时存在着正反应(2SO2+O2→2SO3)所导致的 SO2、O2的消耗、SO3的增加和逆反应 (2SO3→2SO2+O2)所导致的SO3的消耗和SO2、O2的增加。因此,正反应速率即为由于正反应进行所导致的SO2、O2的消耗速率或者SO3的增加速率;而逆反应速率则为由于逆反应进行所导致的SO3的消耗速率和SO2、O2的增加速率。而化学反应速率则是作为一个反应整体宏观上反应物SO2、O2的消耗速率或者SO3的增加速率。当然,约定俗成,方程式从左至右为反应进行的正方向。
当反应达到平衡时正反应速率等于逆反应速率,此时的化学反应速率即为零,因为各物质的浓度不再随时间而变化。但是,正反应速率和逆反应速率不为零。
化学反应速率可以通过实验测定随着反应的进行反应物或生成物浓度的变化而得到。但是单纯通过实验却不能测定正反应速率或者逆反应速率,因为只能测定出宏观上物质浓度的变化却无法获知浓度的改变中哪些是因为正反应、哪些又是由于逆反应所导致的。
三、化学平衡和化学反应速率
在中学教学中,教师通常将正反应速率和逆反应速率作为化学反应达到平衡及导致化学平衡移动的原因。通过调查学生课堂笔记、网络查阅教师教案及教参,发现许多中学教师都是这样讲述的:当可逆反应的正反应速率等于逆反应速率时化学反应达到平衡。而当外界条件发生变化,导致正、逆反应速率不相等时原有的平衡状态被打破,若正反应速率大于逆反应速率则反应向正方向移动,而逆反应速率大于正反应速率反应向逆方向移动,直到正、逆反应速率再次相等而达到新的化学平衡状态。
而在一些大学化学教材中讲到化学平衡时却对化学反应速率只字不提,仅仅是因为中学已经学习过而不再提及吗?
其实,经典的化学热力学仅从反应前、后状态的能量变化的角度出发,去探讨反应的可能性(即反应进行方向的判断)与限度问题(即化学平衡),并未涉及反应从始态到终态之间的过程,不涉及反应从一个平衡状态到另一个平衡状态过渡的快慢。也就是说,热力学基础上建立的对化学反应(包括化学平衡问题)的结论,与反应速率之间没有任何的联系。[1]
经典热力学通过反应前、后的状态的变化,即ΔG(反应后的状态与反应前的状态的吉布斯自由能变化)来判断一个反应能否自发进行以是否达到平衡。ΔG<0,反应能自发进行,即反应总是自发向吉布斯自由能减少的状态进行的,也就是说若反应后整个反应体系的吉布斯自由能小于反应前的吉布斯自由能,那么反应肯定向正反应方向自发进行;而ΔG=0,反应达到平衡状态,即前、后状态的吉布斯自由能相等则说明已达到化学反应限度,所谓限度也就是在当前条件下反应体系的吉布斯自由能已经降到了最低,同时,反应物的转化率也达到最高。当反应条件发生变化原有平衡状态被打破时,若ΔG<0则平衡向正方向移动,ΔG>0则平衡向逆反应方向移动。其实,这也是“能量最低原理”这个自然界普适规律的体现,即“自然变化进行的方向都是使能量降低,因为能量越低越稳定。”
所以说,在中学阶段将化学平衡的原因归结为正反应速率等于逆反应速率,并认为正反应速率不等于逆反应速率是化学平衡移动的根本原因都是不够严谨的。但是,因为中学还未学习到吉布斯自由能的内容,似乎只能用化学反应速率来解释化学平衡问题同学们才容易理解。因此,建议中学教师在讲解时注意措词:正反应速率等于逆反应速率只能说是化学反应达到平衡的一个标志而不是其根本原因或本质;化学平衡移动的方向也不必借助正反应速率与逆反应速率的比较来判断,而直接用勒夏特列原理来分析即可。即使介绍在化学平衡移动时正反应速率与逆反应速率大小的不同,也必须说明化学反应速率的变化与化学平衡的移动总是相互伴随发生的过程,但并非正、逆化学反应速率的变化导致化学平衡的移动亦非化学平衡的移动导致化学反应速率的变化,化学平衡及其移动的本质将在大学化学中做深入的介绍。
[1]吴新建,张贤金.化学平衡、化学反应速率概念及其关系探讨[J].化学教与学,2012,(4)

