求真务实 事必躬亲——对过氧化氢与二氧化锰反应制取氧气实验的探讨
卞万国
(江苏省盐城市城南新区伍佑初中 江苏 盐城 224041)
初中化学实验知识点零碎而复杂,化学实验过程中的不确定因素很多, 对于各类实验我们教师要亲历亲为,力争把效果较好的实验呈现给学生。 因为较好效果的实验往往在于教师的反复实践后,才可能探索到。
请看一道实验探究题,无论是人教版义务教育课程标准实验教科书 《化学》 九年级上册43 页习题的第5题;还是最新的人教版义务教育教科书《化学》九年级上册42 页练习与应用的第4 题, 都编排了下面这个实验探究题:
利用下列所示的仪器、药品(及其他必要物品)进行实验并探究。
(1)“把二氧化锰加入装有过氧化氢溶液的试管中”与“把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中”的实验现象是否相同? 哪种方法可以得到平稳的氧气流?
(2)设计制取氧气和试验其性质的实验方案(下表可供参考, 你也可以利用一些其他代用品自行设计其他方案),征得老师同意后实施你的方案,实验后进行小结。
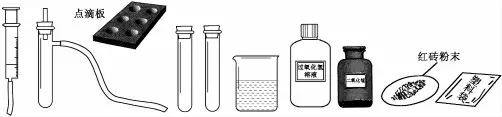
?
对于这个题目的解答有如下几种:
人教版《化学教师教学用书》九年级上册58 页是这样描述的:
(1)此题引导学生思考如何得到平稳气流,为第(2)题做些准备。
(2)这是一道探究活动习题,综合有关氧气知识进行复习。 这样的习题将会在培养学生创造力方面起一定作用。
用氧化铜、氧化铁、红砖粉末等都可以代替二氧化锰作催化剂使过氧化氢溶液分解。 学生也可以再试一试其他什么物质可以作这一反应的催化剂。
把催化剂放在试管里,塞好带有导管的瓶塞(应为橡皮塞, 图中没有瓶子, 只有试管和具支试管—笔者注),用注射器通过导管向内逐滴加入过氧化氢溶液,可以得到平稳的气流,同时也便于收集。
学生设计的方案可能是多种多样的,对此教师应予以鼓励。 对于不正确或可能不成功的方案,只要没有危险,教师也应让学生试一试。 学生会从探索中体验到成功的经验或获得失败的教训。 只要学生积极思考了,认真去做了,在这个过程中一定会有收获的。
提供的表格仅供参考, 学生可以自行设计实验目标、方案、步骤等。 但设计好后,应由教师审查后再实施。
我以前对这一题的理解是:按照上面的提示得出第(1)题中“把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中”(以下简称“前者”)比“把二氧化锰加入装有过氧化氢溶液的试管中”(以下简称“后者”)产生的氧气流平稳,从而启发学生在第(2)题中选出用注射器通过导管向具支试管内逐滴加入过氧化氢溶液,可以得到平稳的气流,同时也便于收集。
网上(包括一些“名师工作室”)对此题的第(1)小题的回答也有多种答案:
甲答案:“如果两次所用两种物质的量一样的话,现象相同(都是剧烈放出气体)。 实验室制取应该向MnO2中加入H2O2液体,要多少加多少,如果加得均匀稳定,那么气体也是均匀稳定的。 ”
乙答案:“如果把二氧化锰加入过氧化氢前,过氧化氢就已经反应生成少量氧气。 加入过氧化氢就会引起快速的剧烈反应,直到过氧化氢全部反应为止,故无法控制反应速度。 由于以上两点原因氧气流不平稳。 当把过氧化氢加入二氧化锰的时候, 反应前试管中没有氧气。加入过氧化氢时,由于可以控制加入的速度,就可以使其较慢反应,以得到平稳的氧气流。 ”
这个答案对前者的分析语言逻辑混乱,按照对后者的分析,我推测前者应这样说才比较通顺:在把二氧化锰加入过氧化氢前,过氧化氢在试管里就已经缓慢反应生成少量氧气。 加入二氧化锰后就会引起快速的剧烈反应,直到过氧化氢全部反应为止,故无法控制反应速度。由于以上两点原因氧气流不平稳……
丙答案:“当然是后者了。 后者试管中过氧化氢一边被消耗,一边被增加,其量一直可以控制为几乎不变,二氧化锰的量也不变,所以氧气流比较平稳;前者过氧化氢的量一直在减少,二氧化锰的量一直在增加,氧气流当然不会平稳了。 再说,“把二氧化锰加入装有过氧化氢的试管中”,你是要加多少二氧化锰啊? 那是催化剂,加一点点就可以了,实际操作中,就是一勺加完了。 ”
丁答案:“现象不一样。 前面方法反应更剧烈,因为反应物更多(二氧化锰是催化剂),所以刚开始氧气大量放出(很激烈),最后到过氧化氢浓度低时就慢了。 后面方法过氧化氢慢慢加入,每次滴入浓度差不多,就可以得到平稳的氧气流。 量少与催化剂接触面积小,所以反应放出气体速率较慢。 ”
……
总的来说, 大家都倾向于前者反应速度开始非常快,而且反应速度很快变慢,氧气流不稳定,不易控制和收集;后者可以做到使氧气流平稳,便于收集。 说实话,我也是一直这么认为的,因为我没做过这样的实验。 直到有一次学校化学兴趣小组一位同学向我问了这一题,我当时心血来潮,给他来个“实践出真知”吧! 心想反正实验挺简单的,也没什么危险,不怎么费事。 于是我把他领到实验室,找出药品和仪器,让他自己动手做一做。
他在那里做实验,我就在旁边看着,做“把二氧化锰加入装有过氧化氢溶液的试管中”的实验时,我看到他把一支试管正插在试管架上的孔中,向试管里倒入适量的过氧化氢溶液, 再向试管内加入少量的二氧化锰,二氧化锰刚加入的瞬间反应剧烈,有大量水雾和氧气从试管中冲出,他吓了一跳,说了句:“乖乖,这么猛啊! ”过了约两三秒钟反应稳定了下来,这时观察到仅在溶液的上半部分二氧化锰粉末上下翻滚、反应快速,下半部分溶液依然澄清且风平浪静,后来二氧化锰粉末逐渐慢慢向下扩散,反应速度较快且稳定,持续了大约两分钟左右,反应才逐渐停止。 接下来做“把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中”, 我看到他往另一支试管中加入少量二氧化锰, 然后试管正插在试管架上的孔中,打开盛过氧化氢溶液的试剂瓶盖,向试管中缓慢地倒入过氧化氢溶液,没料到的事情发生了,加入的液体混合着黑色粉末一起冲出试管溅在那位学生的衣服上、手上,连脸上也有大大小小的黑斑了。 这下他被吓了一跳,但没哭,他说:“这东西还发烫啊!”我赶紧把他拉到水池边洗去脸上、 手上的污物……看这实验探究哪里是“实践出真知啊”,是我出糗出大发了!
后来我自己做了几次实验,改变了过氧化氢溶液的浓度、改变了二氧化锰的量,实验结果仍然是前者反应速度较稳定,后者反应速度变化起伏很大,不易控制。 我心里想:到底是自己实验设计有问题,还是书上的结论有问题呢? 正好赶上暑假闲来无事,我重新设计了实验,并把实验过程用相机拍了下来,来和专家、教授交流探讨。 由于所拍视频容量较大,上传困难,所以这里我只能描述实验现象了,敬请谅解!
本次实验我设计了两部分:
一、不同浓度的过氧化氢溶液与二氧化锰作用

?
实验现象描述:
第一组实验中,右边的试管二氧化锰刚加入的瞬间反应剧烈,有大量水汽和氧气从试管中冲出,过了约两三秒钟反应稳定了下来,这时观察到二氧化锰粉末就在溶液的上半部分上下翻滚,快速反应。 下半部分溶液依然澄清且风平浪静, 后来二氧化锰逐渐慢慢向下扩散,反应速度较快且稳定,持续三分四十秒后,反应速度明显减慢,四分钟后反应逐渐停止。 左边的试管,刚开始倒入过氧化氢溶液反应剧烈,固、液混合物差点冲出试管,停止倾倒后反应很快停止, 再倾倒反应还是很剧烈,我用了近一分钟将10mL 液体断断续续倾倒完, 反应在一分三秒后逐渐停止。
第二组实验中, 右边试管中二氧化锰刚加入的瞬间反应也很剧烈,有大量水汽和氧气从试管中放出,但反应很快稳定了下来, 观察到二氧化锰还是仅在溶液的上半部分上下翻滚、反应,下半部分溶液依然澄清平静,后来二氧化锰逐渐慢慢向下扩散,反应速度较快且稳定,持续二分十秒后,反应速度明显减慢,二分三十秒后反应逐渐停止。 左边试管中,开始倒入过氧化氢溶液反应剧烈,有大量气体和水汽冲出试管,停止倾倒后反应很快停止,再倾倒反应还是很剧烈,我用了约四十五秒钟将10mL 液体断断续续倒完,反应在一分十秒后逐渐停止。
第三组实验中,右边试管中二氧化锰刚加入的瞬间反应很快, 有较多水蒸气和氧气从试管中放出,随即反应稳定了下来,这时观察到二氧化锰就在溶液的上半部分上下翻滚,反应较快进行,下半部分溶液依然风静,后来二氧化锰也逐渐慢慢向下扩散,反应速度较快且稳定,持续一分二十秒后,反应速度明显减慢,一分二十五秒后反应逐渐停止。 左边试管中,刚开始倒入过氧化氢溶液反应很快, 我用了约四十秒将10mL 液体断断续续倒完,反应在五十秒后变慢,一分五秒后逐渐停止。
通过这三组实验可以看出,“把二氧化锰加入装有过氧化氢溶液的试管中”比“把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中”反应持续时间长,产生的氧气流稳定。 分析原因,我认为二氧化锰粉末颗粒很细,与过氧化氢溶液的接触面积很大。 把少量二氧化锰直接加入到过氧化氢溶液中,刚开始时,由于表层过氧化氢溶液与二氧化锰先接触,所以反应剧烈,放出氧气的同时产生大量水雾。 随着二氧化锰粉末进入溶液内部,氧气在二氧化锰颗粒表面生成, 而二氧化锰颗粒很小,表面附着的气泡使二氧化锰颗粒的浮力增加,二氧化锰颗粒向溶液表面运动,附着的气泡脱离二氧化锰颗粒表面而逸出溶液,二氧化锰颗粒的浮力减小,在溶液中又向下运动,这样周而复始。 所以我们就看到反应速度很快稳定下来,二氧化锰在溶液的上半部分上下翻滚,且不会很快下沉到底。 随着反应的进行,溶液上半部分的过氧化氢被消耗,过氧化氢浓度降低,产生的氧气不足以使所有二氧化锰颗粒仍然停留在溶液的上半部分,就有一部分二氧化锰颗粒在重力的作用下就向溶液的深处运动,那里二氧化锰与浓度较高的过氧化氢溶液反应而产生较多的氧气。 从而使二氧化锰颗粒就像运送氧气的“小车” 继续在溶液里上下往复运动, 由于运送氧气的“小车”数量是一定的,所以单位时间内,运送氧气的量基本恒定,反应就这样一直持续着,直至“小车”布满了整个过氧化氢溶液一段时间后,氧气的量随着过氧化氢即将消耗完而很快减少。
而“把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中”,情形则大不相同。 首先“把过氧化氢缓缓加入”的倾倒速度就难以控制,即使让溶液沿着试管内壁呈一条线的流入试管内,试管底的二氧化锰粉末还是会飞起来。 其次无论过氧化氢浓度大小,刚开始倒入的过氧化氢溶液量稍微多一点,反应都会非常剧烈,甚至加入的溶液大部分还没来得及反应就连同氧气、水汽一起冲出试管。 这是因为二氧化锰粉末和过氧化氢溶液下表面接触的瞬间,反应速度非常快,这些运送氧气的“小车”根本来不及运动到溶液表面,它们就在原地“卸下”运送的氧气,导致溶液底部气体压强瞬间增大,气体膨胀,这样氧气裹挟着液体、粉末一起向上冲。 在没有液体流下或滴下时,反应又很快停止。 最后在实验过程中,大部分二氧化锰粉末一直停留在试管内液体的底部,加入新溶液后,这些二氧化锰“小车”依然在原地“卸下”运送的氧气,这样反应就在时断时续中进行,而且当把溶液全部加入后反应也很快停止了。
二、用注射器与广口瓶组合和用气体简易发生装置制取氧气的比较

?
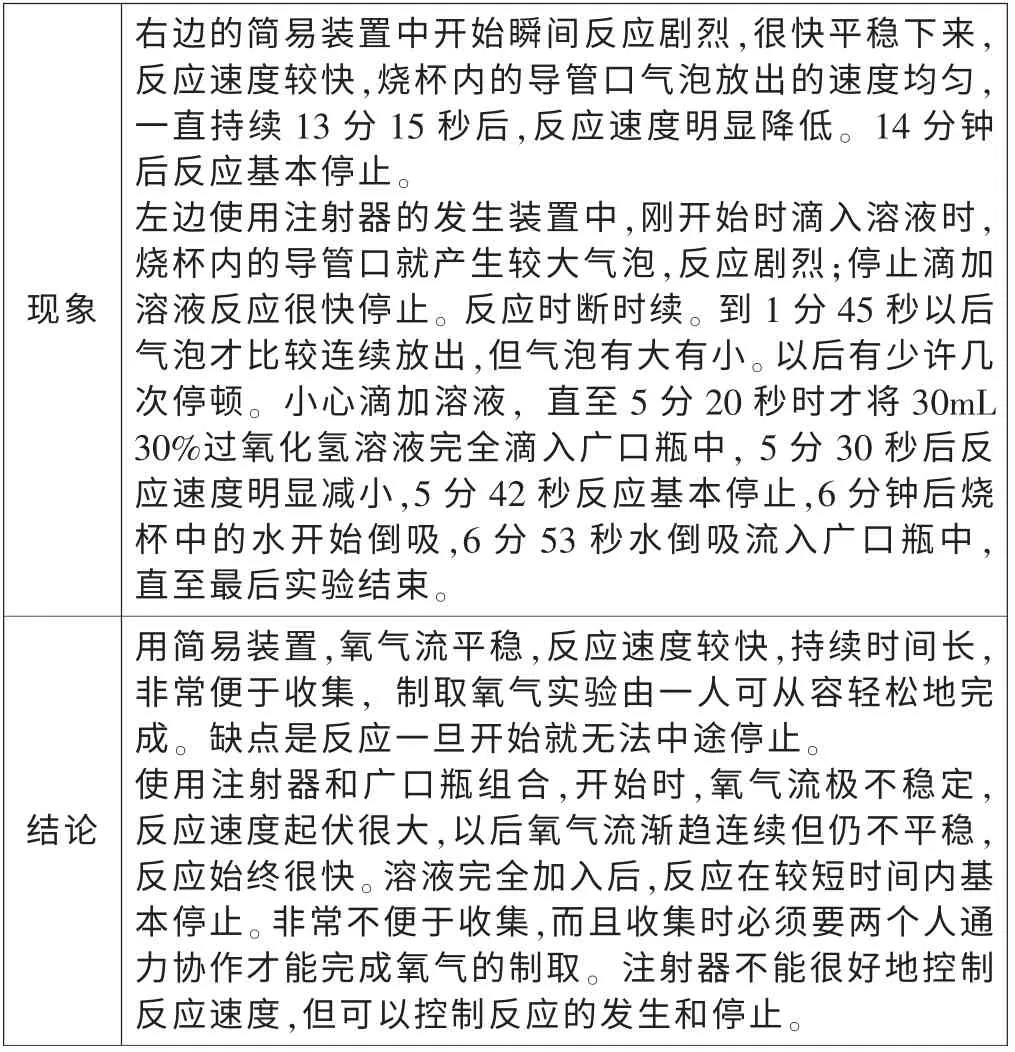
?
综上所述,我认为用过氧化氢溶液,二氧化锰做催化剂制取氧气最好选用简易发生装置,还要先加入过氧化氢溶液,后加入少量二氧化锰,这样反应持续时间较长,氧气流稳定,方便收集气体,实验由一人即可完成;而把过氧化氢溶液加入二氧化锰中, 氧气流不稳定,不便于收集氧气,即使使用注射器、长颈漏斗等与试管、广口瓶、锥形瓶等装置组合也不能取得较好的实验效果。
以上是本人的一些拙见,恳请专家、教授批评指正,提出更好的建议,使我们化学实验教学进行得更有效。
[1] 课程教材研究所化学课程教材研究开发中心.义务教育课程标准实验教科书·化学九年级上册[M].北京:人民教育出版社,2010
[2] 课程教材研究所化学课程教材研究开发中心.义务教育教科书·化学九年级上册[M].北京:人民教育出版社,2012
[3] 课程教材研究所化学课程教材研究开发中心.义务教育课程标准实验教科书·化学九年级上册教师教学用书[M].北京:人民教育出版社,2010

