氧化铁改性活性炭的制备及其吸附脱硫性能
宋 华 ,王 璐 ,张娇静 ,李 锋
(1东北石油大学化学化工学院,黑龙江 大庆 163318;2东北石油大学石油与天然气化工省重点实验室,黑龙江大庆 163318)
随着能源事业的不断发展,天然气在能源领域里显得越来越重要。但是,天然气中的H2S为高度危害介质,不仅危害人体健康,污染环境,而且会对燃气管道及相关设备产生腐蚀作用。因此,在应用天然气之前必须经过脱硫处理,使之达到H2S含量<20 mg/m3的标准[1]。目前,天然气的脱硫方法主要分为两类:湿法和干法。湿法是采用溶液或者溶剂作为脱硫剂,主要包括湿式吸收法和湿式氧化法两大类,湿法处理气量比较大,操作工序连续,广泛用于高含硫天然气的净化[2]。干法脱硫采用固体作脱硫剂,它以能耗低、再生操作简单、占地面积小等优点成为天然气脱硫研究中的热点[3],干法脱硫剂主要有氧化铁、氧化锌、活性炭等。天然气吸附脱硫是利用这些多孔物质的吸附性能净化气体的,吸附脱硫以其工艺简单、操作方便、脱硫精度高、能耗低而被广泛应用于低含硫天然气的深度处理。活性炭是极具发展前景的吸附脱硫材料,具有较发达的孔隙结构、较大的比表面积、良好的吸附性能、易于改性及价格便宜等特点,是一种高效脱硫剂,广泛应用于气体及液体中污染物杂质的吸附脱除[4-6]。水合氧化铁是19世纪中叶以来最早的可再生吸附剂[7]。原料来源丰富,价格低廉,广泛应用于工业气体干法脱硫中。由此可以预见,以活性炭为载体负载氧化铁,可以大大提高活性炭的吸附量,更好地脱除硫化氢。
本文采用低浓度硫化氢模拟原料气,研究了硫化氢在氧化铁负载改性活性炭上的深度脱硫技术,考察了制备条件及吸附温度对氧化铁负载改性活性炭吸附硫化氢性能的影响。
1 实验部分
1.1 主要试剂
椰壳活性炭(粒径0.5~1 mm,温县博源活性炭厂),乙酸锌(分析纯,沈阳市华东试剂厂),乙酸镉(分析纯,天津市科密欧化学试剂开发中心),FeS(分析纯,北京红星化工厂),浓硫酸(98%,哈尔滨市化工试剂厂),NH3·H2O(分析纯,西陇化工股份有限公司),Fe (NO3)3·9H2O(分析纯,天津市光复精细化工研究所)。
1.2 吸附脱硫机理
由于未经处理的活性炭有较多的空隙,硫容量非常大,在吸附过程中,硫化氢被吸附于活性炭的孔隙与孔道中,因而活性炭的孔隙大小决定了吸附脱硫效果的好坏。当活性炭失效时,其孔隙中基本上塞满了硫[6],此过程属于物理吸附。负载型活性炭吸附脱硫剂不仅有物理吸附,还有化学吸附。化学吸附机理是利用活性炭微孔壁上不同的官能团产生不同的活性中心,当H2S+N2扩散进入孔道中时,H2S与 N2竞争吸附于同一类活性中心,由于 H2S与活性部位的结合能力要比N2强,因此H2S优先吸附于活性中心上。氧化铁吸附硫化氢吸附机理见式(1)、式(2)。

因此,其脱硫效率负载氧化铁后要比单独使用活性炭要高。
1.3 吸附剂的制备
(1)用去离子水冲洗活性炭后,浸泡4 h,过滤,120 ℃干燥至恒重。
(2)参照文献[8-9]的方法制备氧化铁,称量2 g水洗的椰壳活性炭放入30 mL(过量)氨水里,置于30 ℃的恒温水浴中搅拌30 min。
(3)再称量负载比例 1∶1(质量比)所需的Fe(NO3)3固体8.08 g,将其溶解于50 mL的去离子水中,形成Fe(NO3)3溶液。
(4)将溶解好的 Fe(NO3)3溶液滴入装有活性炭的氨水里,滴定速度控制在0.5~1滴/秒,将Fe(NO3)3溶液全部滴定完,然后停止搅拌,得到浑浊液。
(5)将浑浊液阴干熟化18 h,沉淀经过水洗、蒸氨,于70 ℃下真空加热干燥36 h,得到氧化铁与活性炭质量比为1∶1的改性活性炭吸附剂。
1.4 原料气的制备
实验采用硫化亚铁与稀硫酸反应来制取硫化氢气体,该反应的化学方程式见式(3)。
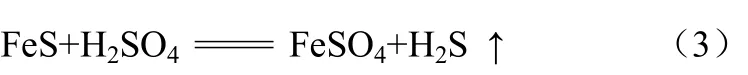
原料气制备装置如图1所示。
硫化亚铁与硫酸在启普发生器反应,产生H2S,进入装有无水氯化钙的干燥瓶中,脱除水蒸气后进入缓冲瓶,之后通过三通将装置内原有空气排空,H2S充入气罐内。采用硫化氢与氮气混合气作为模拟原料气。模拟原料气硫化氢的含量为20 mg/L。
1.5 固定床吸附脱硫装置及计算方法
实验采用固定床装置吸附脱硫,装置如图 2所示。

图1 原料气制备装置

图2 吸附脱除硫化氢装置流程
固定床是由外径为12 mm,内径为10 mm,长为300 mm的石英玻璃器制成,实验时在吸附反应器中装入0.3 g制备好的吸附剂,反应器上下端装填有石英砂。反应开始时以20 mL/min的气速通入自制的含有硫化氢的原料气,未被脱硫剂脱除的硫化氢气体由尾气吸收液吸收,并每隔5 min采用碘量法对吸收液中的硫化氢进行检测,当净化后硫化氢气体浓度为模拟原料气中硫化氢气体浓度的10%时视为穿透。依据吸附结束后吸收液中的硫含量计算穿透硫容、饱和硫容和脱硫率。
穿透硫容是指以出口气体中 H2S的浓度为 2 mg/L(定义此点为破点)时的硫容,即当出口气体中H2S浓度达到这一指标时单位质量脱硫剂所能吸附硫化氢的质量,计算公式见式(4)。

式中,cs为吸附剂穿透硫容,mg/g;c0为反应器入口模拟原料气硫化氢含量,mg/L;V'为模拟原料气流量,mL/min;c为反应器出口模拟原料气硫化氢含量,mg/L;t为吸附时间,min;m为吸附剂质量,g。
饱和硫容是指脱硫剂吸附达到饱和时,即出口气体中硫含量与入口的相同时,单位质量脱硫剂所能吸附硫化氢的质量,计算公式见式(5)。

式中,Q为饱和硫容,mg/g;为样气中的H2S含量,mg/L;C1为I2标准溶液的浓度,mol/L;V1为加入 I2标准溶液的体积,mL;C2为 Na2S2O3标准溶液的浓度,mol/L;V2为滴定时消耗的Na2S2O3标准溶液的体积,mL;V为总气量,L;m为吸附剂用量,g;34为H2S的摩尔质量,g/mol。
脱硫率计算公式见式(6)。
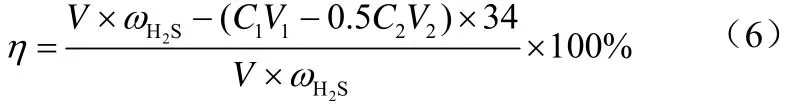
式中,η为吸附剂脱硫率,%。
2 结果与讨论
2.1 氧化铁负载量的影响
在吸附温度 25 ℃,真空干燥温度 50 ℃,干燥时间36 h,气速20 mL/min,吸附剂0.3 g不变条件下,考察氧化铁不同负载量对活性炭吸附性能的影响,结果如图3、图4所示。
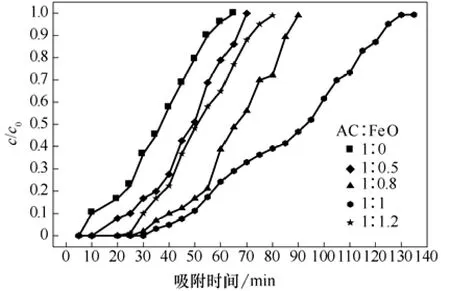
图3 不同负载量改性活性炭穿透曲线
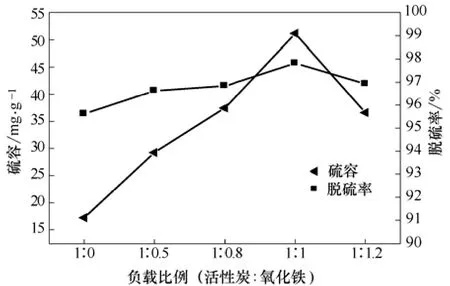
图4 负载量对氧化铁负载改性活性炭饱和硫容及脱硫率的影响
由图3可知,空白活性炭吸附脱硫时,达到破点时间为10 min,此时,通气量为200 mL,穿透硫容为14.3 mg/g;60 min时吸附剂达到饱和,饱和吸附硫容为17.2 mg/g。当氧化铁与活性炭质量比小于1∶1时,达到破点时的穿透硫容随着氧化铁负载量的增加而增加,吸附饱和时间也随之增长;当氧化铁负载比为1∶1时,达到破点时间为50 min,此时通气量为1000 mL;穿透硫容为47.4 mg/g,饱和吸附时间为130 min,饱和硫容为51.2 mg/g。当氧化铁与活性炭质量比大于1∶1时,随着氧化铁负载量的增加,穿透硫容随之减小,饱和吸附时间缩短。这是因为空白活性炭对H2S的净化作用主要依赖于物理吸附,而化学吸附很少;当负载氧化铁后,吸附过程由单一的物理吸附变为物理吸附和化学吸附同时存在,因此吸附效果明显提高,且氧化铁负载量提高有利于吸附脱硫,但氧化铁负载量过高时,过量的氧化铁会引起活性炭孔道堵塞,活性中心被覆盖,导致吸附剂的吸附能力变差。
由图4可知,随着氧化铁与活性炭质量比的增加,硫容与脱硫率先增大后减小,当氧化铁与活性炭质量比为1∶1时,饱和硫容与脱硫率达到最大。因此,氧化铁与活性炭的最佳质量比为1∶1,此时饱和硫容及脱硫率最高达51.2 mg/g和97.8%。
2.2 干燥温度的影响
在质量比为 1∶1(氧化铁∶活性炭),吸附温度25 ℃,真空干燥时间36 h,气速20 mL/min,吸附剂0.3 g不变条件下,考察干燥温度对活性炭吸附性能的影响,结果如图5、图6所示。
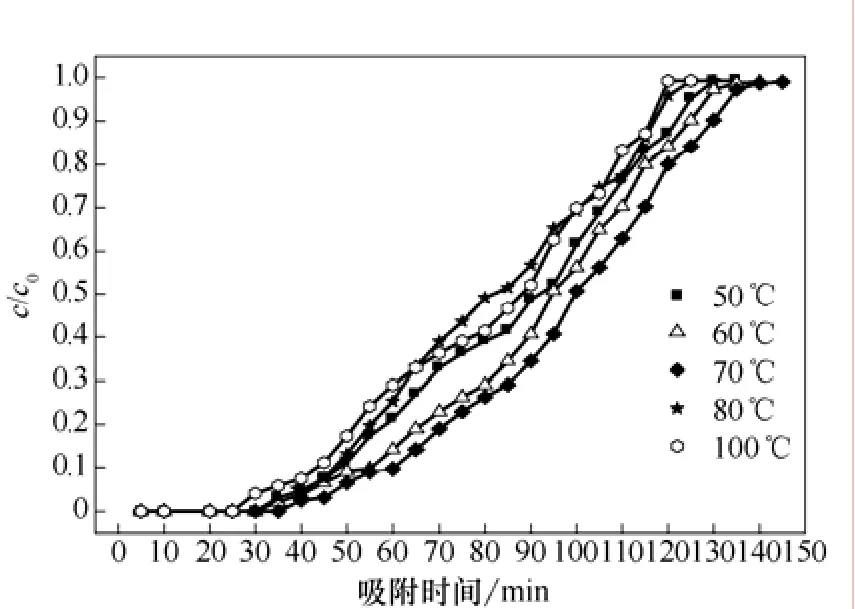
图5 不同干燥温度改性活性炭穿透曲线
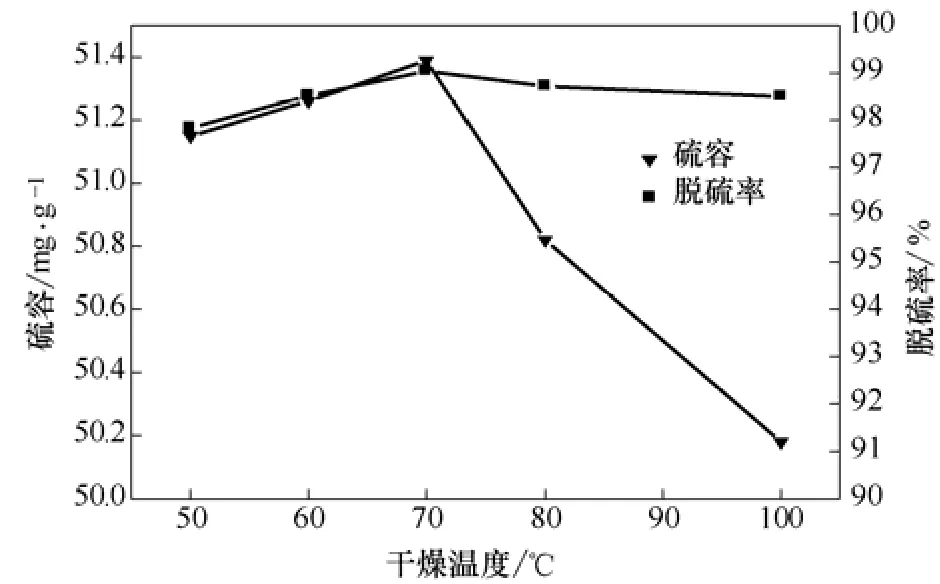
图6 干燥温度对氧化铁负载改性活性炭饱和硫容及脱硫率影响
由图5可知,干燥温度对改性吸附剂达到破点时间影响不明显。当干燥温度小于 70 ℃时,随着干燥温度的增加,吸附剂饱和吸附时间变长,饱和硫容变大,50 ℃、60 ℃的饱和硫容分别为 51.2 mg/g、51.32 mg/g;当干燥温度达70 ℃时,吸附剂饱和吸附时间最长达到140 min,饱和硫容为51.4 mg/g;当干燥温度大于 70 ℃时,随着干燥温度的增加,吸附剂饱和吸附时间缩短,80 ℃、100 ℃的饱和硫容为 50.9 mg/g、50.1 mg/g。以干燥温度为70 ℃的吸附剂穿透曲线为例,随着吸附反应的进行,在0~30 min时间内,即吸附剂还未被穿透,所测定的出口H2S浓度c和进口H2S浓度c0之比一直为0,尾气中不含H2S,说明原料气中的H2S气体完全被吸附剂吸收;当吸附时间大于30 min时,随着反应的继续,c/c0的值开始逐渐增大,当增大到c/c0=0.1,吸附达到破点,直至c/c0=1停止反应。
由图6可知,随着干燥温度的增加,吸附剂的硫容及脱硫率先增大后减小;当干燥温度为 70 ℃时,饱和硫容及脱硫率均达到最高。因此,最适宜干燥温度为 70 ℃,此时,饱和硫容及脱硫率最高达51.4 mg/g、99.0%。
2.3 干燥时间的影响
在负载比例为 1∶1(氧化铁∶活性炭),吸附温度25 ℃,真空干燥温度70 ℃,气速20 mL/min,吸附剂0.3 g不变条件下,考察干燥时间对活性炭吸附性能的影响,结果如图7、图8所示。
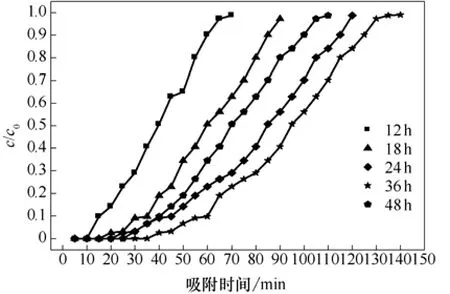
图7 不同干燥时间穿透曲线

图8 干燥时间对氧化铁负载改性活性炭饱和硫容及脱硫率影响
由图7可知,干燥时间为12 h时,达到破点时间为15 min,此时通气量为300 mL,穿透硫容为21.4 mg/g,吸附剂饱和吸附时间为65 min,饱和硫容为24.8 mg/g。随着干燥时间的增加,达到破点时的吸附时间也随之增长,饱和硫容增大;干燥时间为36 h时,达到破点时间为55 min,此时通气量为1100 mL,穿透硫容为48.2 mg/g,吸附剂饱和时吸附时间为140 min,饱和硫容为51.4 mg/g。当干燥时间大于36 h时,随着干燥温度的增加,达破点时穿透硫容变小,吸附时间缩短。干燥时间的不同实际上影响的是吸附剂中的含水量,即湿度。在没有水的情况下,活性炭对硫化氢的吸附性能很差,相应地增加气体湿度,可以促进提高气体吸附相的浓度,从而也会提高脱硫速率和硫容量[10]。谭小耀[11]认为,催化反应在活性炭的水膜内进行,脱硫过程既依赖水膜体积,也要考虑传质过程影响。Bagreev等[12]和 Born等[13]的研究表明,活性炭上预先聚集的水有利于H2S吸附。Alessandra等[14]对活性炭湿度实验研究表明,湿度太大或者太小对活性炭的脱硫效果都不好。以干燥时间为36 h的吸附剂穿透曲线为例,随着吸附反应的进行,在0~30 min时间内,吸附剂还未被穿透,c/c0一直为0,尾气中不含H2S,说明原料气中的 H2S气体完全被吸附;当吸附时间大于30 min时,随着吸附反应的继续,c/c0的值开始逐渐增大,当增大到c/c0=0.1,吸附达到破点,直至c/c0=1,停止反应。
由图8可知,随着干燥时间的增加,吸附剂的硫容及脱硫率先增大后减小;当干燥时间为36 h时,饱和硫容及脱硫率均达到最高。因此最佳干燥时间为36 h,此时饱和硫容及脱硫率最高达51.4 mg/g、99.0%。
2.4 吸附温度的影响
在负载比例为 1∶1(氧化铁∶活性炭),真空干燥温度70 ℃,干燥时间36 h,气速20 mL/min,吸附剂0.3 g不变条件下,考察吸附温度对活性炭吸附性能的影响,结果如图9、图10所示。
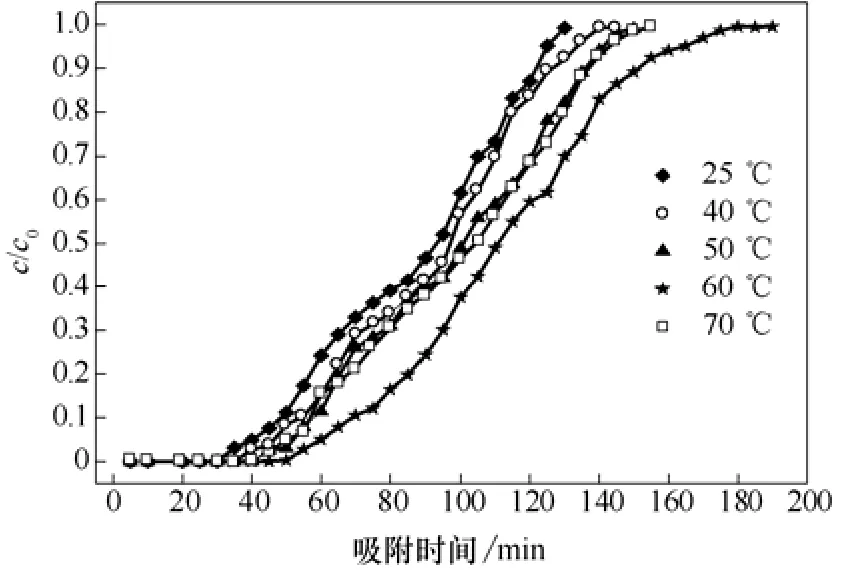
图9 不同吸附温度穿透曲线
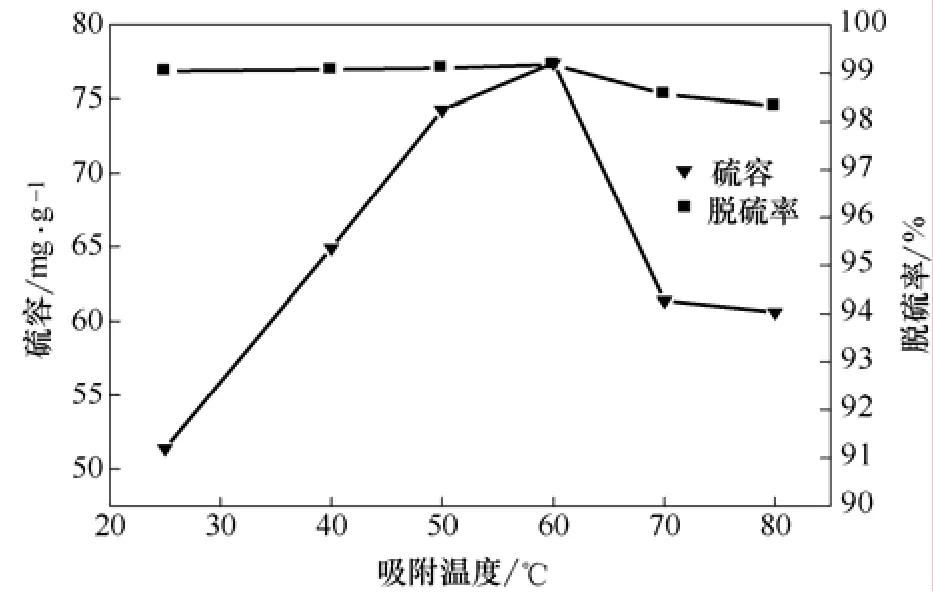
图10 吸附温度对氧化铁负载改性活性炭饱和硫容及脱硫率影响
在气固相吸附反应中,吸附温度是重要的考察因素。由图9可知,吸附温度为25 ℃时,达到破点时间为55 min,此时通气量为1100 mL,穿透硫容为48.2 mg/g。随着吸附温度的升高,吸附时间逐渐变长,但不明显;当吸附温度为 60 ℃时,达到破点时间为70 min,此时,通气量为1400 mL,穿透硫容为72.1 mg/g,饱和吸附时间为180 min,饱和硫容为77.4 mg/g。当吸附温度>60 ℃时,穿透硫容随温度的升高而减小,吸附时间开始缩短。这是因为H2S在活性炭表面上的吸附、H2S在液膜中的溶解度都会受到温度的影响,同时温度也会影响表面的反应速率。反应温度过低,气相与固相之间单靠较弱的范德华力而产生物理吸附,这种吸附通常是可逆而无选择性的,任何气体都可在吸附剂上发生物理吸附,而此时的系统温度和物理吸附不能提供足够的热量使气体分子活化,从而使气体并不与活性炭上的活性物质直接参与化学反应。随着吸附温度的升高,吸附质分子与吸附中心间吸附化学键越强,硫化氢气体靠化学键吸附在改性活性炭表面的量也越多,氧化铁负载改性活性炭对硫化氢的净化效率也随之变高,此时物理吸附与化学吸附共存。当吸附温度>60 ℃时,氧化铁部分失活[15],从而使吸附剂脱除硫化氢的效果降低。

表1 吸附剂的BET及脱硫性能
由图 10可知,随着吸附温度的增加,吸附剂的硫容及脱硫率先增大后减小;当吸附温度为 60℃时,饱和硫容及脱硫率均达到最高。此时,饱和硫容及脱硫率达77.4 mg/g和99.2%。
2.5 吸附剂的比表面积(BET)分析
针对空白活性炭与负载氧化铁的活性炭做了BET分析,分析结果如表1所示。
由表1得出,负载氧化铁活性炭的比表面积比空白活性炭提高了78.2 m2/g;孔容提高了8.5 μL/g,而负载后吸附剂的孔径比负载前吸附剂的孔径要小。这可能是由于部分氧化铁负载于活性炭的内、外表面,使活性炭的表面性质发生了较大的变化。从而增加了活性炭的比表面积与总孔容,一部分氧化铁进入活性炭孔道使得活性炭的大孔变成微孔,从而减小了平均孔径。这些特征与两个吸附剂的形貌差异较大相吻合。研究发现,负载氧化铁的活性炭明显比空白活性炭的硫容高,这表明,负载氧化铁有利于提高活性炭的吸附活性。
2.6 形貌观察
图11为活性炭负载氧化铁前后的SEM图。由图11(a)可知,负载前后吸附剂形貌差异较大,空白活性炭孔径大小不均匀,表面光滑;从图11(b)中看出,经氧化铁改性后的活性炭孔径明显减小,表面凸凹不平,活性炭表面覆盖有明显的粒状晶相结构的晶体,表明活性炭经负载改性成型后表面性质发生了较大改变。氧化铁比较均匀地分散在活性炭表面、嵌入活性炭孔中,氧化铁附着于活性炭大孔的内壁,使活性炭原有的大孔变成许多小的微孔,从而提高了改性活性炭比表面积和降低了改性活性炭的平均孔径;活性炭表面沉积氧化铁形成大量的新孔,最终导致改性活性炭孔容增大。这与3.5节中BET测定数据相吻合。
3 结 论

图11 不同形态改性活性炭表面扫描电镜图
采用负载氧化铁法对活性炭进行改性制备了氧化铁/活性炭吸附剂,负载氧化铁后吸附剂的比表面积由580.4 m2/g提高到658.6 m2/g;负载前后形貌差异较大,负载后氧化铁均匀地分散在活性炭表面及孔道中,改变了活性炭的孔道结构。未改性的活性炭吸附剂达到破点时间为10 min,此时通气量为200 mL,穿透硫容为14.3 mg/g,60 min时吸附剂达到饱和,饱和吸附硫容为17.2 mg/g。活性炭负载氧化铁后吸附脱除硫化氢性能得到显著提高。在实验条件范围内,氧化铁与活性炭负载比例为 1∶1,真空干燥温度为70 ℃,干燥时间为36 h时得到的氧化铁/活性炭吸附剂具有适宜的脱硫化氢活性。在吸附温度为60 ℃时,氧化铁/活性炭吸附剂达到破点时间为70 min,此时,吸附剂处理的总气量为1400 mL,穿透硫容为72.1 mg/g,饱和吸附时间为180 min,饱和硫容为77.4 mg/g。与未经改性的活性炭相比,达到破点时通气量提高了1200 mL,饱和硫容提高了60.2 mg/g。
[1]樊辉,陈陆建,赵红,等.活性炭基脱硫剂吸附脱除天然气中H2S的研究[J].天然气化工:C1化学与化工,2011,36(1):34-38.
[2]王兰芝,李桂明,杨红健,等.天然气净化技术研究进展[J].河南化工,2006,23(12):11-13.
[3]宋倩倩,李春虎.脱除原料气中 H2S的干法研究进展[J].广州化工,2008,36(5):27-28,50.
[4]Wang Li,Cao Bin,Wang Shudong,et al.H2S catalytic oxidation on impregnated activated carbon:Experiment and modelling[J].Chemical Engineering Journal,2006,118(3):133-139.
[5]Andrey Bagreev,Teresa J Bandosz.H2S adsorption/oxidation on unmodified activated carbons:Importance of prehumidification[J].Carbon,2001,39(12):2303-2311.
[6]王翠萍.活性炭脱硫性能分析[J].山西煤炭,2010,30(4):78-80.
[7]王青宁,李澜,俞树荣,等.凹凸棒石黏土-活性金属氧化物复合脱硫剂对脱H2S效果的影响[J].化工进展,2006,25(1):95-100.
[8]梁绪树,程帅,孙体昌,等.氨法制备氧化铁红晶种影响因素研究[J].金属矿山,2011(4):77-82,93.
[9]杨艳.铁锌脱硫剂的研究[D].武汉:武汉科技大学,2002.
[10]Meeyoo V,Trimm D L,Cant N W.Adsorpyion-reaction process for the removal of hydrogen sulfide from gas stream[J].J.Chem.Tech.Biotechnol.,1997,68:411-416.
[11]谭小耀.浸渍活性炭脱除H2S过程的研究[D].大连:中科院大连化学物理研究所,1995.
[12]Bagreev A,Bandosz T J.H2S adsorption/oxidation on unmodified activated carbons importance of prehum idification[J].Carbon,2001,39(15):2303-2311.
[13]Born A,Laplanche A,Marsteau S.Adsorption-oxidation of hydrogen sulfide on activated carbon fibers:Effect of the composition and the relative humidity of the gas phase[J].Chemosphere,2004,54(4):481-488.
[14]Alessandra P,Alessandro T.The effect of water in the low- temperature catalytic oxidation of hydrogen sulfide to sulfur over activated carbon[J].Applied Catalysis A:General,1998,173(2):185-192.
[15]闫日雄.高含硫天然气吸附氧化脱硫用脱硫剂设计、制备及其应用研究[D].北京:中国石油大学,2007.

