乙酸、糠醛和5-羟甲基糠醛对产酸克雷伯氏菌发酵生产2,3-丁二醇的影响
吴晶,程可可,李文英,冯杰,张建安
1 太原理工大学煤科学与技术省部共建国家重点实验室培育基地,山西太原 030024
2 清华大学核能与新能源技术研究院,北京 100084
2,3-丁二醇(2,3-BDO)是一种大宗化学品,被广泛应用于燃料、化工、医药、食品以及航空航天等多个领域[1]。本身可作为燃料[2-3]、燃料添加剂、风味添加剂[4]、抗冻剂[5]等,还可用来制备油墨、增塑剂、增湿剂、熏蒸剂、软化剂、炸药及药物载体等[6-7]。利用废弃的生物质如玉米芯、玉米秸秆、麦秆、甘蔗渣等发酵生产2,3-丁二醇是近年来研究的热点[8],这些生物质主要由纤维素、半纤维素和木质素组成,发酵前需经过预处理和酶解将纤维素和半纤维素转化为单糖。稀酸法可以有效地将木质纤维素中的半纤维素转化为单糖(以木糖为主),但酸水解过程中所产生的一定含量毒性物质可明显抑制水解液的发酵性能,主要有乙酸、糠醛和HMF,并且预处理条件(如预处理温度、pH、时间)严重影响毒性物质的生成和浓度,乙酸、糠醛和HMF 的浓度范围分别为0~10 g/L、0~2 g/L 和0~2 g/L[9-10]。对于半纤维素稀酸水解液中抑制物对微生物的影响前人已有一定的研究,方祥年等研究了半纤维素水解液中抑制物对假丝酵母发酵生产木糖醇的影响,发现当发酵液中乙酸与糠醛的质量浓度分别超过1 g/L 时,抑制作用逐渐增强,通过调节半纤维素水解液的起始pH 值从4.0到6.0,可有效减轻乙酸对发酵的抑制作用[11]。宋向阳等研究了发酵抑制物对絮凝酵母戊糖发酵的影响,对于5种抑制物甲酸、乙酸、糠醛、乙醇和乳酸,絮凝酵母对其的耐受浓度分别为0.5、0.5、1.0、30.0和8.0 g/L[12]。王晓凤等对丝状真菌Amorphotheca resinae ZN1的糠醛降解代谢进行了分析,研究表明糠醛首先快速地转化为毒性较低的糠醇,在有氧条件下,糠醇又再度生成不对微生物产生危害的低浓度糠醛,糠醛继续氧化为糠酸。推测糠酸可能继续进入TCA 循环,进而完成糠醛的完全降解[13]。我们在前期用实际水解液发酵过程中发现菌体明显受到抑制[14],目前对于产酸克雷伯氏菌对抑制物的代谢产物及中间产物报道很少,本文以木糖为底物,探讨了3种抑制物对产酸克雷伯氏菌发酵生产2,3-丁二醇的影响,并对产物进行了检测,为直接生物转化半纤维素水解液的工艺优化、水解液脱毒以及发酵动力学的深入研究打下了一定的基础。
1 材料与方法
1.1 菌种及培养基
产酸克雷伯氏菌Klebsiella oxytoca ACCC 10370由中国农业微生物菌种保藏管理中心(Agricultural Culture Collection of China)提供。
斜面培养基:琼脂15 g/L,氯化钠10 g/L,酵母浸粉5 g/L,蛋白胨10 g/L。
种子培养基:木糖30 g/L,(NH4)2SO42 g/L,K2HPO44.4 g/L,KH2PO41.3 g/L,酵母浸粉1 g/L,MgSO4·7H2O 0.2 g/L,微量元素1 mL/L,FeSO4溶液2 mL/L。微量元素和FeSO4溶液参照文献[15]。
发酵培养基:木糖60 g/L,(NH4)2SO42 g/L,K2HPO40.9 g/L,KH2PO40.26 g/L,酵母浸粉1.5 g/L,MgSO4·7H2O 0.2 g/L,微量元素1 mL/L,FeSO4溶液2 mL/L,抑制物(乙酸0~50 g/L,糠醛0~5 g/L 或HMF 0~9 g/L)。
1.2 培养及发酵方法
将斜面菌株接入装有100 mL 种子培养基的500 mL 三角瓶中,在摇床中以30℃、转速150 r/min 条件下培养14 h。然后以5%(V/V)的接种量接入发酵培养基发酵,发酵在装有150 mL发酵培养基的500 mL 三角瓶中进行,发酵条件为35℃、转速150 r/min,发酵初始pH 为7.0。
1.3 分析方法
实验中各物质浓度采用高效液相色谱法(岛津公司LC-20A)测定,色谱柱型号Aminex®HPX-87H 柱(Bio-Red 美国),柱温65℃,流动相0.005 mol/L H2SO4,流速为0.8 mL/min;检测器型号为RID-10A 和SPD-20A,进样量30μL。木糖、乙酸和2,3-丁二醇用RID-10A 检测器检测,糠醛和HMF 用SPD-20A 检测器检测。糠酸、2-氧代戊二酸和2,5-呋喃二甲醇用气相色谱质谱连用仪(GCMS)定性检测,用SPD-20A 检测器定量检测。比生长速率根据菌体在2~10 h 时OD600值计算得到。
2 结果与分析
2.1 乙酸对产酸克雷伯氏菌木糖发酵的影响
以60 g/L 木糖为发酵底物,分别添加一定量的乙酸,使发酵液乙酸初始浓度分别为0、10、20、30、40和50 g/L,发酵液初始pH 用NaOH调至7.0左右,进行不同浓度的乙酸对产酸克雷伯氏菌木糖发酵影响的研究,结果见表1。
从表1可以看出,随着乙酸浓度的增加,产酸克雷伯氏菌的比生长速率明显降低,与不加乙酸时相比,当乙酸浓度为10、20、30、40和50 g/L时,菌体比生长速率分别降低了15%、38%、63%、80%和81%。乙酸浓度为40 g/L 时已经严重抑制菌体生长,无法正常发酵生产2,3-丁二醇。还可以看出,随着乙酸浓度从0增加到30 g/L,2,3-丁二醇产量逐渐增大且得率也逐渐提高,30 g/L 乙酸浓度下2,3-丁二醇得率达到0.4 g/g,为理论得率(0.5 g/g)的80%,但随乙酸浓度的增加木糖消耗速率降低,因此发酵时间也随之延长,木糖完全消耗时发酵结束,大约分别为14 h、20 h、28 h 和41 h,图1A 和图1B 为不同初始浓度乙酸时木糖和2,3-丁二醇的浓度变化。
由以上分析可知,产酸克雷伯氏菌可耐受30 g/L 的乙酸,且在此浓度范围内有利于产酸克雷伯氏菌利用木糖发酵生产2,3-丁二醇,但乙酸对菌体生长的抑制会使发酵时间延长。乙酸对克雷伯氏菌发酵的影响机制已有相关报道,丁二醇由丙酮酸转化所得,在这个转化过程中,乙酰乳酸脱羧酶、乙酰乳酸合成酶和乙偶姻还原酶起关键作用,这三种酶为同一操纵子所控制,由budA、budB 和budC 三个基因编码,乙酸的存在对操纵子的表达有促进作用[16-18]。还有研究发现,乙酸还可作为生产2,3-丁二醇的底物,在发酵过程中,部分乙酸转化为乙醛,再缩合为乙偶姻,进一步生成2,3-丁二醇[19]。在本实验中也检测到乙酸在发酵过程中浓度呈下降趋势(图1C),有3 g/L 以上的乙酸被菌体代谢,这部分乙酸用于生产2,3-丁二醇可提高2.25 g/L 以上的2,3-丁二醇产量。另外,乙酸的存在抑制了菌体的生长,使用于生产生物量的木糖相对减少,从而使相对较多的木糖用于生产2,3-丁二醇。
2.2 糠醛对产酸克雷伯氏菌木糖发酵的影响
糠醛是由生物质中的半纤维素组分在较低的酸浓度(低于3 g/L)和温度(低于200℃)下水解产生戊糖,再由戊糖脱水环化而成[20]。糠醛对产酸克雷伯氏菌发酵有明显的抑制作用,并且随着浓度的升高抑制作用更加明显。
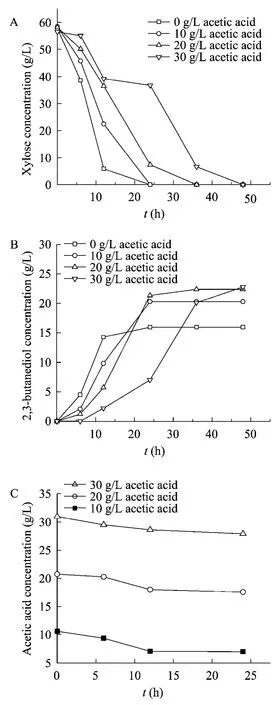
图1 批次发酵中各物质浓度的变化Fig.1 Concentration changes of each substance in batch fermentation.(A) Concentration change of xylose.(B) Concentration change of 2,3-butanediol.(C)Concentration change of acetic acid.
本实验以60 g/L 木糖为发酵底物,分别向发酵液中添加一定量的糠醛,使发酵液糠醛初始浓度分别为0、1、2、3、4和5 g/L,研究糠醛对产酸克雷伯氏菌发酵生产2,3-丁二醇的影响,发酵时间为24~45 h,结果如表2所示。
由表2可知,不添加糠醛时,经24 h 发酵2,3-丁二醇浓度为16.33 g/L,菌体比生长速率为0.563 h−1,木糖消耗速率为4.88 g/(L·h)。当添加1 g/L 糠醛时,菌体比生长速率和2,3-丁二醇产量不受影响,但木糖消耗速率下降明显,发酵时间延长了大约7 h。当添加2 g/L 糠醛时,与不添加糠醛相比2,3-丁二醇产量不受影响,但比生长速率仅为其41%,木糖消耗速率为其47%。当糠醛浓度为3 g/L 时,菌体生长受到严重抑制,但发酵到45 h 时2,3-丁二醇浓度仍可达到16.41 g/L。糠醛浓度增加到4 g/L 时,菌体虽有略微的生长,但发酵到45 h 时还有25.24 g/L 的木糖残留,仅生产了7.86 g/L 的2,3-丁二醇,至糠醛浓度增大至5 g/L 时,菌体生长已经完全被抑制,比生长速率为0。
由以上分析可知,产酸克雷伯氏菌可耐受4 g/L 的糠醛,但随糠醛浓度的增大,发酵时间明显延长。另外,在发酵过程中,产酸克雷伯氏菌可将糠醛代谢,菌体在培养12 h 时已经检测不到糠醛,并且发酵过程中检测到少量的糠酸和2-氧代戊二酸(图2)。糠醛在微生物中的代谢途径也有相关报道,糠醛首先被氧化为糠酸,再经过一系列酶的作用降解为2-氧代戊二酸,最后进入三羧酸循环被菌体代谢[21]。

表1 乙酸对产酸克雷伯氏菌木糖发酵的影响Table 1 Effects of acetic acid on 2,3-butanediol fermentation from xylose by Klebsiella oxytoca

表2 糠醛对产酸克雷伯氏菌木糖发酵的影响Table 2 Effects of furfural on xylose fermentation by Klebsiella oxytoca

图2 批次发酵中糠醛及代谢中间产物浓度的变化Fig.2 Concentration changes of furfural and metabolic intermediate in batch fermentation.
2.3 HMF 对产酸克雷伯氏菌木糖发酵的影响
实验以60 g/L 木糖为发酵底物,发酵液初始HMF 浓度分别为0、1、3、5、7和9 g/L,在温度35℃,摇床转速150 r/min 条件下进行不同浓度的HMF 对产酸克雷伯氏菌木糖发酵影响的研究,结果见表3。
随着HMF 浓度的增加,菌体受到的抑制逐渐增大。与不加HMF 时相比,当HMF 浓度从1 g/L 增到5 g/L 时,比生长速率分别降低了29%、64%和79%,总体木糖消耗速率分别降低了45%、65%和79%。当HMF 浓度为3 g/L时,2,3-丁二醇的产量和得率略有降低,HMF 浓度增加到5 g/L 时,2,3-丁二醇的产量明显降低,仅为12.37 g/L,当HMF 浓度增加到7 g/L 时菌体受到严重抑制,几乎没有生长。
在发酵过程中,HMF 被产酸克雷伯氏菌代谢,如图3所示,发酵过程中HMF 浓度一直下降,到24 h 已经被菌体代谢完,而在HMF 消耗的同时检测到有2,5-呋喃二甲醇生成且浓度逐渐增大,有70%以上的HMF 被菌体转化成了2,5-呋喃二甲醇。据文献报道,部分HMF 在菌体内被氧化为HMF 酸,再通过氧化还原酶作用被转化为2,5-呋喃二甲酸,进一步通过脱羧酶的作用被转化为糠酸,最后与糠醛代谢途径一样形成2-氧代戊二酸进入三羧酸循环被菌体代谢[21]。

表3 HMF 对产酸克雷伯氏菌木糖发酵的影响Table 3 Effects of HMF on xylose fermentation by Klebsiella oxytoca

图3 批次发酵中糠醛及代谢产物浓度的变化Fig.3 Concentration changes of HMF and metabolite in batch fermentation.
3 结论
分别考察3种抑制物对产酸克雷伯氏菌发酵生产2,3-丁二醇的影响,产酸克雷伯氏菌对乙酸、糠醛和HMF 的最高耐受浓度分别为30 g/L、4 g/L 和5 g/L。3种抑制物对菌体生长抑制明显且使发酵时间延长,乙酸在30 g/L 浓度范围内对2,3-丁二醇产量有促进作用,糠醛和HMF在3 g/L浓度范围内对2,3-丁二醇产量影响不大。
乙酸对2,3-丁二醇代谢途径中操纵子的表达有促进作用,并且部分乙酸可作为底物进入2,3-丁二醇代谢途径,另外,由于乙酸对菌体生长的抑制,减少了用于生产生物量的木糖,使相对较多的木糖用于生产2,3-丁二醇。
发酵过程中产酸克雷伯氏菌可将糠醛和HMF 代谢掉。糠醛被氧化为糠酸,进一步被转换为2-氧代戊二酸,最后进入三羧酸循环被菌体代谢。70%以上的HMF 被转化为2,5-呋喃二甲醇,部分HMF 被转化为2,5-呋喃二甲酸,进一步被转化为糠酸,最后被转换为2-氧代戊二酸进入三羧酸循环被菌体代谢。
产酸克雷伯氏菌可以代谢乙酸、糠醛和HMF,且在一定的乙酸浓度范围内有利于提高2,3-丁二醇产量,而3种抑制物中糠醛的抑制作用最大,因此,在木质纤维素水解液的脱毒中可优先考虑脱除糠醛,一定浓度的乙酸可以不用脱除。
有文献报道克雷伯氏肺炎杆菌K.pneumonia HR521 LDH (乳酸合成途径中ldhA 基因被敲除)具有很好的发酵性能,2,3-丁二醇得率能达到理论得率的90.53%,生产强度为1.56 g/(L·h),并且没有副产物乳酸的生成[22],而本文产酸克雷伯氏菌Klebsiella oxytoca ACCC 10370能耐受较高浓度的抑制物,若能结合两种菌的特性,得到高产2,3-丁二醇且能耐受水解液中高浓度抑制物的菌种,将有利于工业生产的应用。
[1]Garg SK,Jain A.Fermentative production of 2,3-butanediol:a review.Bioresour Technol,1995,51(2/3):103−109.
[2]Flichinger MC.Current biological research in conversion of cellulosic carbohydrates into liquid fuels:how far have we come.Biotechnol Bioeng,1980,22(Suppl 1):27−48.
[3]Yu EKC,Levitin N,Saddler JN.Production of 2,3-butanediol by Klebsiella pneumoniae grown on acid hydrolyzed wood hemicellulose.Biotechnol Lett,1982,4(11):741−746.
[4]Romano P,Granchi L,Caruso M,et al.The species-specific ratios of 2,3-butanediol and acetoin isomers as a tool to evaluate wine yeast performance.Int J Food Mircobiol,2003,86(1/2):163−169.
[5]Bartowsky EJ,Henschke PA.The ‘buttery’attribute of wine-diacetyl-desirability,spoilage and beyond.Int J Food Microbiol,2004,96(3):235−252.
[6]Soltys KA,Batta AK,Koneru B.Successful nonfreezing,subzero preservation of rat liver with 2,3-butanediol and type I antifreeze protein.J Surg Res,2001,96(1):30−34.
[7]Celińska E,Grajek W.Biotechnological production of 2,3-butanediol-current state and prospects.Biotechnol Adv,2009,27(6):715−725.
[8]Ji XJ,Huang H,OuYang PK.Microbial 2,3-butanediol production:a state-of-the-art review.Biotechnol Adv,2011,29(3):351−364.
[9]Grover BP,Garg SK,Verma J.Production of 2,3-butanediol from wood hydrolysate by Klebsiella pneumonia.World J Microbiol Biotechnol,1990,6(3):328−332.
[10]Cai BY,Ge JP,Lin HZ,et al.Statistical optimization of dilute sulfuric acid pretreatment of corncob for xylose recovery and ethanol production.Biomass Bioenergy,2012,36:250−257.
[11]Fang XN,Huang W,Xia LM.Effects of inhibitors in hemicellulosic hydrolysate on xylitol production.J Zhejiang Univ:Eng Sci,2005,39(4):547−551(in Chinese).方祥年,黄炜,夏黎明.半纤维素水解液中抑制物对发酵生产木糖醇的影响.浙江大学学报:工学版,2005,39(4):547−551.
[12]Song XY,Lv MF,Chen M,et al.Effect of fermentation inhibition for fermentation of pentose to flocculating yeast.J Biol,2011,28(3):46−49(in Chinese).宋向阳,吕美峰,陈牧,等.发酵抑制物对絮凝酵母戊糖发酵的影响.生物学杂志,2011,28(3):46−49.
[13]Wang XF,Zhang J,Xin XJ,et al.Furfural degradation by filamentous fungus Amorphotheca resinae ZN1.Chin J Biotech,2012,28(9):1070−1079(in Chinese).王晓凤,张建,辛秀娟,等.丝状真菌Amorphotheca resinae ZN1的糠醛降解代谢分析.生物工程学报,2012,28(9):1070−1079.
[14]Cheng,KK,Liu Q,Zhang JA,et al.Improved2,3-butanediol production from corncob acid hydrolysate by fed-batch fermentation using Klebsiella oxytoca.Proc Biochem,2010,45(4):613−616.
[15]Cheng KK,Liu HJ,Liu DH.Multiple growth inhibition of Klebsiella pneumoniae in 1,3-propanediol fermentation.Biotechnol Lett,2005,27(1):19−22.
[16]Magee RJ,Kosaric N.The microbial production of 2,3-butanediol.Adv Appl Microbiol,1987,32:89−161.
[17]Blomqvist K,Nikkola M,Lehtovaara P,et al.Characterization of the genes of the 2,3-butanediol operons from Klebsiella terrigena and Enterobacter aerogenes.J Bacteriol,1993,175(5):1392−1404.
[18]Mayer D,Schlensog V,Böck A.Identification of the transcriptional activator controlling the butanediol fermentation pathway in Klebsiella terrigena.J Bacteriol,1995,177(18):5261−5269.
[19]Frazer FR,McCarkey TA.Effect of components of acid-hydrolysed hardwood on conversion of D-xylose to 2,3-butanediol by Klebsiella pneumoniae.Enzyme Microb Technol,1991,13(2):110−115.
[20]Wang RF,Shi WY.Production and application of furfural.Henan Chem Ind,2008,25(5):14−15(in Chinese).王瑞芳,石蔚云.糠醛的生产及应用.河南化工,2008,25(5):14−15.
[21]Koopman F,Wierckx N,De Winde JH,et al.Identification and characterization of the furfural and 5-(hydroxymethyl)furfural degradation pathways of Cupriavidus basilensis HMF14.Proc Natl Acad Sci USA,2010,107(11):4919−4924.
[22]Song YQ,Wu CR,Xu YZ,et al.Comparison of 2,3-butanediol production by several strains and optimization of the fermentation medium.Chin J Biotech,2011,27(3):489−492(in Chinese).宋源泉,吴如春,许赟珍,等.2,3-丁二醇生产菌株生产能力的比较和培养基优化.生物工程学报,2011,27(3):489−492.

