通气量和菊粉浓度对克鲁维酵母乙醇发酵的影响
高教琪,袁文杰,陈丽杰,韩锡铜,白凤武
大连理工大学生命科学与技术学院,辽宁大连 116024
生物燃料,作为目前化石燃料的主要替代物,是未来能源工业的重要发展方向[1]。生物乙醇是目前为止研究最早、技术最为成熟的生物质能源产品。它既可以作为燃料直接使用,也可以与汽油和柴油以一定比例配混使用。生物乙醇因其具有较高的辛烷值,而且无毒,对环境污染程度较小,一直以来都被公认为最有可能替代化石能源的生物质能源之一[2]。利用淀粉质原料生产乙醇研究较早,技术也相对比较成熟,已经在包括中国在内的世界各国实现工业化生产。然而,中国人口多、耕地少的基本国情,严重制约了目前粮食类淀粉质原料燃料乙醇产业的规模化发展,所以,寻找新的非粮作物代替淀粉质原料进行乙醇的工业化生产将是未来中国燃料乙醇的主要发展方向[3]。
我国已将菊芋作为重点发展的非粮能源植物列入生物产业发展的“中华人民共和国国民经济和社会发展第十一个、第十二个五年规划纲要”中。菊芋俗称洋姜或鬼子姜,与其他农作物相比具有适应性强、耐贫瘠、耐寒、耐旱、种植简易及产量高等特点[4],不仅可以为生物能源产品生产开辟新的原料来源,而且有助于生态环境保护。菊芋块茎中的主要成分是菊粉,是由果糖残基以β-2,1键连接而成的线形多聚物[5],可以被多种微生物分解产生低聚果糖或果单糖,继而发酵生产乙醇[6-9]。
集成生物加工(Consolidated bioprocessing,CBP)系统集水解酶生产、底物水解和发酵为一体,在乙醇发酵的应用方面具有非常突出的优点,是目前利用许多非粮作物生产燃料乙醇经济上最具有竞争能力的技术路线[10-11]。马克斯克鲁维酵母可分泌菊粉酶,将菊粉水解为果糖并发酵生产乙醇,因此是利用CBP 技术发酵菊芋生产乙醇的理想菌株[12]。
目前,利用CBP 技术发酵菊粉类原料生产乙醇的研究已进行多年[6,10-11,13],主要的研究内容是菌株的筛选、发酵工艺的开发等方面,但发酵时间长,乙醇收率低的问题仍然存在[14]。
菊粉酶的活性是影响CBP 技术的关键,而通气量和底物浓度是影响菊粉酶活性的关键因素[15-17]。目前国内外尚没有文献对CBP 技术中的这两个因素进行报道。对于克鲁维乙醇发酵过程,也没有文献对其代谢过程进行报道。本文研究通气量和底物浓度交互作用下的菊粉酶活性及乙醇发酵情况,并通过测定发酵过程中的主要副产物,增加对克鲁维酵母CBP技术发酵菊芋生产乙醇过程关键因素的了解,为乙醇发酵条件下的菊粉酶调控打下基础,以提高菊芋发酵的生产效率。
1 材料与方法
1.1 材料
1.1.1 菌株
马克斯克鲁维酵母Kluyveromyces marxianus YX01(ATCC8554,本实验室驯化后保存)。
1.1.2 主要试剂
菊粉(菊芋的热水抽提物)购于内蒙古亿利生物技术有限公司,经实验测定100 g 菊粉水解可得到85 g 还原糖;蛋白胨、酵母浸粉、3,5-二硝基水杨酸、硫酸、NaOH 等均为国产分析纯以上级产品。
1.1.3 培养基
种子培养基:4%(W/V)菊粉,2%(W/V)蛋白胨,1%(W/V)酵母粉,pH 自然。121℃灭菌15 min 后使用。
发酵培养基:
①50g/L菊粉,2%(W/V)蛋白胨,1%(W/V)酵母粉,pH 自然。121℃灭菌15 min 后使用;135 g/L②或250 g/L 菊粉,2%(W/V)蛋白胨,1%(W/V)酵母粉,pH 自然。115℃灭菌15 min 后使用。
1.2 方法
1.2.1 50g/L菊粉在不同通气量条件下的发酵情况
5 L 发酵罐中装入2 L 含有50 g/L 菊粉的发酵培养基,分别按10%的接种量接种培养24 h的种子液,在通气量分别为0、0.5、1.0 vvm 的条件下,30℃、150 r/min 进行批式培养。分别在0、4、8、12、24、36、48、60、72 h 时取样,测定生物量、总糖、还原糖、乙醇和酶活,考察在50 g/L 菊粉、不同通气量条件下K.marxinaus YX01的发酵情况。
1.2.2 135g/L 菊粉在不同通气量条件下的发酵情况
5 L 发酵罐中装入2 L 含有135 g/L 菊粉的发酵培养基,发酵条件同1.2.1。分别在0、12、24、36、48、60、72、96 h 时取样,测定生物量、总糖、还原糖、乙醇和酶活,考察在135 g/L 菊粉、不同通气量条件下K.marxinaus YX01的发酵情况。
1.2.3 250g/L 菊粉在不同通气量条件下的发酵情况
5 L 发酵罐中装入2 L 含有250 g/L 菊粉的发酵培养基,发酵条件同1.2.1。分别在0、6、12、24、36、48、60、72、96、120 h 时取样,测定生物量、总糖、还原糖、乙醇和酶活,考察在250 g/L菊粉、不同通气量条件下K.marxinaus YX01的发酵情况。
1.2.4 分析方法
酶活的测定:参照文献[18]。菊粉酶活性单位定义:一定条件下,以菊粉为底物,每分钟产生1μmol 果糖所需酶量(U)。
生物量的测定:采用OD 值法,将菌液适当稀释,在620 nm 处测量其吸光值。
还原糖测定:取适当稀释倍数的发酵上清液,采用DNS 法测定糖浓度。
乙醇测定:详见文献[19]。
发酵液甘油和乙酸的分析方法:将发酵液在10000× g 下离心5 min,取上清液,采用高效液相色谱(HPLC)测定。离子交换柱型号为Aminex HPX-87H。流动相为50 mmol/L 的硫酸溶液(HPLC grade),流速为0.5 mL/min,柱温为50℃,RI 检测器的温度为50℃。
2 结果与分析
2.1 不同菊粉浓度、不同通气量条件下的乙醇发酵情况比较
不同菊粉浓度在不同的通气量下表现出基本相同的规律。以250 g/L 菊粉浓度为例,由图1可见,通气量为1.0 vvm 和0.5 vvm 时,在发酵前24 h,总糖浓度快速下降,36 h 左右基本已经达到终点;而不通气情况下,100 h 左右才到达终点;还原糖消耗速率方面,通气量为1.0 vvm和0.5 vvm 时,在前12 h 左右基本保持稳定,或稍有上升,之后迅速下降直至终点时维持在较低水平;在不通气时,前24 h 还原糖浓度会上升,之后维持一定时间稳定,最后下降至较低水平。通气条件的乙醇发酵过程明显快于不通气条件,且0.5 vvm 与1.0 vvm 并未表现出明显差异,乙醇浓度在发酵24 h 时已达到最高;而不通气条件下,乙醇浓度持续升高,到发酵120 h 达到最高。
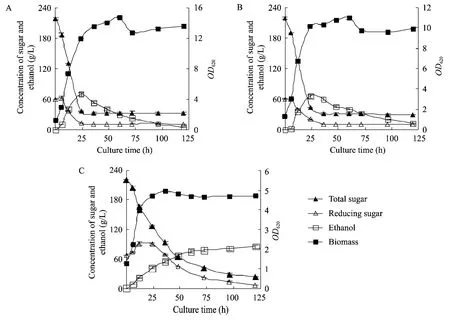
图1 250g/L初始碳源浓度时不同通气条件下K.marxinaus YX01发酵情况Fig.1 Fermentation of K.marxinaus YX01 under different aeration rates at 250 g/L.(A)1.0 vvm.(B)0.5 vvm.(C)0.0 vvm.
出现这种现象可能是由于接种后 K.marxinaus YX01分泌的菊粉酶迅速将底物降解成为供其自身利用的果糖等还原糖,通气情况下,糖的利用速率快,没有出现还原糖的积累;但在乙醇浓度方面,不通气时达到84.74 g/L,明显高于1.0 vvm 和0.5 vvm 时,是由于在有氧且碳源不足情况下,乙醇作为碳源被重新利用,并且大通气量导致部分乙醇挥发。通气量为1.0 vvm 和0.5 vvm 时的发酵情况类似,其原因可能是由于在1.0 vvm 时的生物量略高于0.5 vvm,导致在发酵过程中,培养基中的溶氧情况相似,而溶氧并非通气量是培养过程中的关键因素。
表1显示了不同菊粉浓度以及不同通气量条件下发酵终点K.marxinaus YX01状况。不通气时乙醇发酵性能明显较通气条件有明显提高,其中最高的乙醇得率为0.442,达到了理论值的86.4%;在135 g/L 时,乙醇发酵结果也较为理想,不通气条件乙醇得率为0.438,达到理论值的85.7%;在250 g/L,不通气条件下,乙醇得率为0.433,为理论值的84.7%。但是,随着初始底物浓度的增加,乙醇发酵结果有所下降,而且终点时残糖浓度也明显增加,这种现象可能由于高浓度底物对于微生物的生长有一定影响,而且糖转化形成了较高浓度的乙醇,对微生物在发酵后期的生长产生了较为严重的抑制作用。
2.2 K.marxinaus YX01在不同发酵条件下菊粉酶的表达情况
由图2可以看出,K.marxinaus YX01菊粉酶的表达受到高浓度碳源的抑制,而且通气条件下酶活高于不通气条件下的酶活。在50 g/L 时,1.0 vvm 条件下,最高酶活力为21.54 U/mL,而不通气条件下只有9.34 U/mL;但是,当糖浓度达到250 g/L 时,酶活力受通气量的影响作用不再显著,在所有情况下,菊粉酶活力都处于相对较低水平,是由于较高的糖浓度对于菊粉酶产生了严重的抑制作用。综合图1的结果,可以看到菊粉酶的活力与乙醇的发酵速度呈正相关,说明CBP 技术中糖的水解速率是工艺的关键控制点。
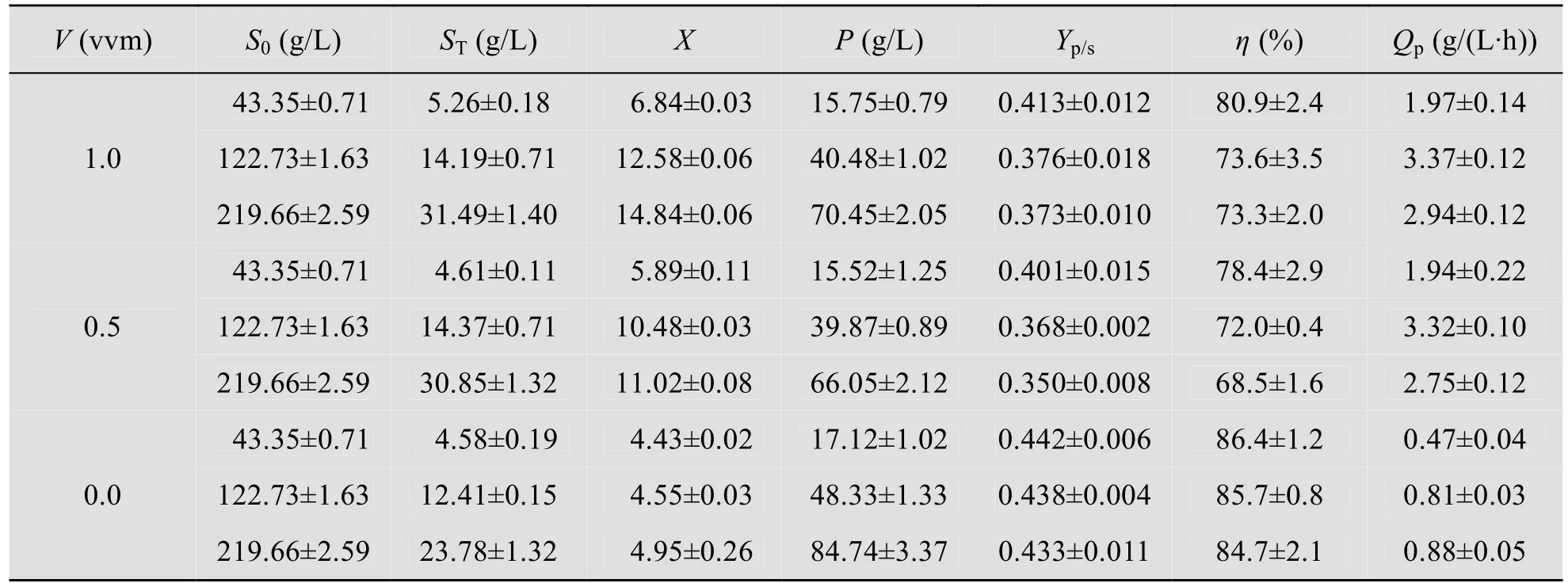
表1 K.marxinaus YX01在不同菊粉浓度、通气量条件下的发酵情况Table 1 Comparison of the fermentation by K.marxinaus YX01 under conditions of different inulin concentrations and aeration rates
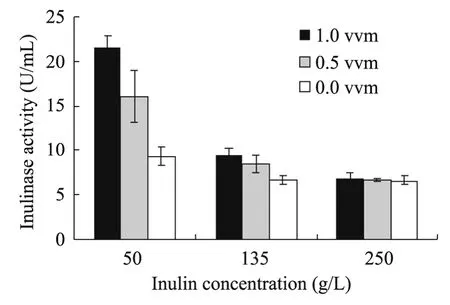
图2 发酵96 h 时菊粉酶在不同发酵条件下的表达活性Fig.2 Inulinase activity under different conditions at 96 h.
2.3 不同发酵条件下发酵液中副产物的分析
在乙醇发酵过程中,甘油和乙酸等副产物会伴随乙醇的产生而产生,这对于乙醇的发酵来说是不利的,它导致了发酵效率的降低。
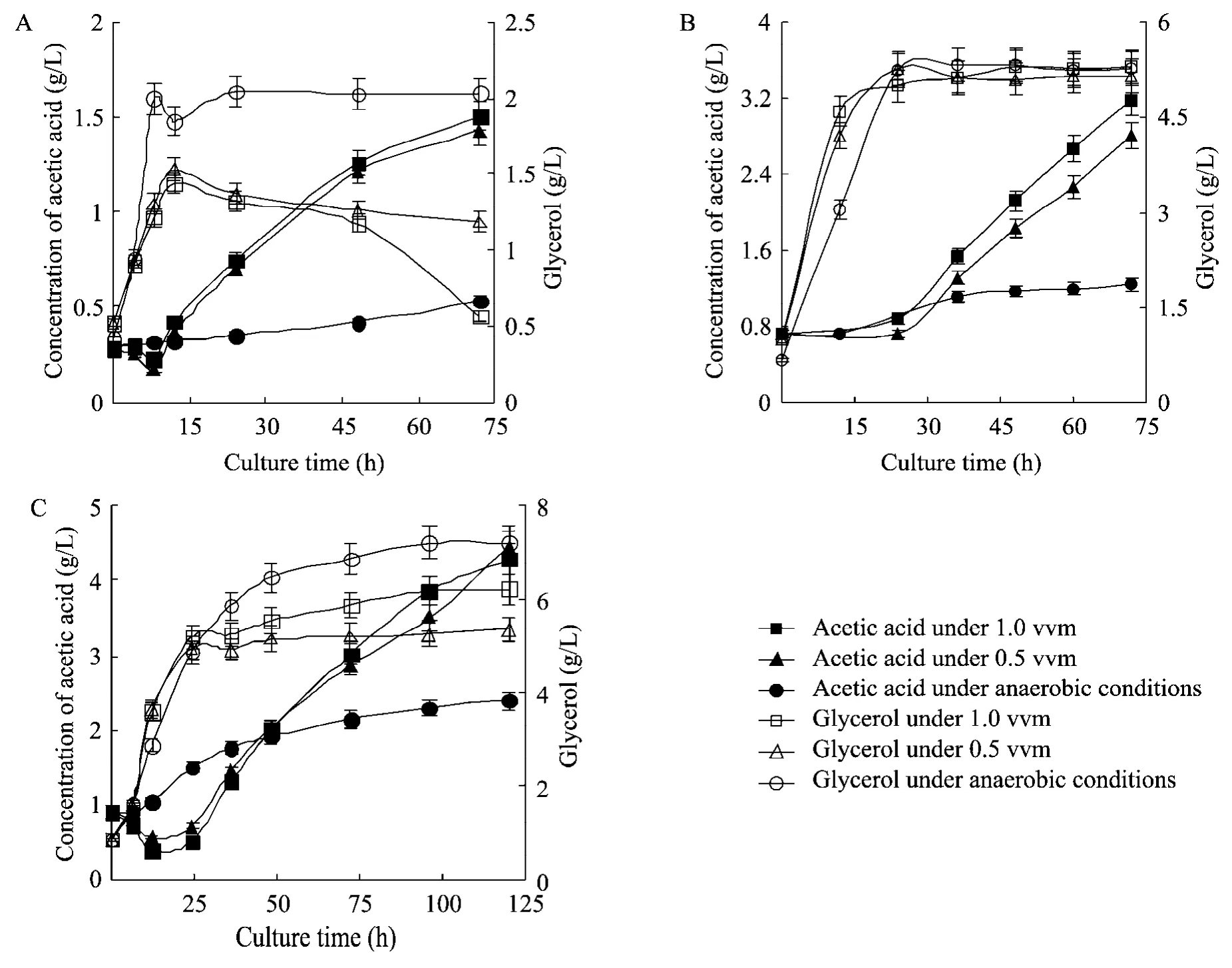
图3 不同初始碳源浓度和不同通气量条件下甘油和乙酸浓度随时间的变化Fig.3 Concentration changes of glycerol and acetic acid under conditions of different inulin concentrations and aeration rates.(A)50 g/L.(B)135 g/L.(C)250 g/L.
由图3可以看出,不同的发酵条件对于甘油的含量具有较大影响。甘油的产生伴随着乙醇发酵过程,且表现出同样的趋势。随着初始碳源浓度的增加,甘油的合成量明显增加,这主要是由于细胞在高渗条件下,大量合成甘油可以保护细胞不受损伤,在250 g/L 时,甘油含量是50 g/L时的3倍;但是随着通气量的增加,甘油的合成受到了抑制,这可能是由于较高的氧化环境不利于甘油途径的进行。甘油具有保护细胞、调节细胞的氧化还原水平等作用[20],所以在一定程度上来说,甘油的积累有利于细胞生长,但是在乙醇的生产工业中,甘油的合成分流了流向乙醇的碳源,降低了乙醇得率,同时在精馏过程中,甘油只能作为废水排放,造成了碳源的浪费[21]。
另一种副产物乙酸主要来自于乙醛或乙醇的氧化。乙酸也是随着发酵过程的延长而逐渐积累,但是与甘油相反,乙酸的产量随着通气量的增加而增高。这可能由于在高通气条件下,流向甘油途径的碳受到抑制,而流向乙醇、乙酸的碳增加。但是由表1结果来看,高通气量降低了乙醇的得率,可能是由于部分乙醇在有氧条件下被氧化形成乙酸的原因。
3 讨论
目前有关通气量和底物浓度对K.marxinaus乙醇发酵和菊粉酶表达影响的研究并不多。我们的研究结果表明,相对厌氧和高底物浓度的条件不利于K.marxinaus YX01菊粉酶的分泌但有利于乙醇发酵,酶和乙醇的产率受通气量影响显著,随通气量增大,菊粉酶活力上升而乙醇得率随之降低,这与Bernardo 等[15]的研究结果相似。较高的底物浓度严重抑制了菊粉酶活力但对乙醇得率影响不是很明显,但是菊粉酶活力的降低,延长了发酵时间,大大降低了乙醇生产效率[22]。
发酵过程副产物主要为乙酸和甘油,且与酿酒酵母乙醇发酵过程副产物的变化趋势有相似之处[20]。实验证明,乙酸和甘油对菊粉酶活性没有明显抑制作用,但无疑副产物的产生降低了乙醇产量。发酵过程中,与乙醇对于细胞的毒害作用相比,副产物乙酸由于浓度相对较低,其毒害作用影响不大。
解决高效菊粉酶活力和高乙醇产量之间的矛盾是利用K.marxinaus 实现菊粉类物质CBP技术的关键。今后的研究工作可从以下两个方面开展:一是进一步确定满足菊粉酶高表达与乙醇高得率的通气条件;二是找到调控菊粉酶表达的相关转录因子,利用分子生物学的方法进行改造,实现其在乙醇发酵条件下的可控表达。
[1]Ragauskas AJ,Williams CK,Davison BH,et al.The path forward for biofuels and biomaterials.Science,2006,311(5760):484−489.
[2]Rosamond LN,Adam L,Marshall B,et al.The ripple effect:biofuels,food security,and the environment.Environment,2007,49(9):30−43.
[3]Heaton1 EA,Flavell RB,Mascia PN,et al.Herbaceous energy crop development:recent progress and future prospects.Curr Opin Biotechnol,2009,19(3):202−208.
[4]Kosaric N,Cosentino GP,Wieczorek A.The Jerusalem artichoke as an agricultural crop.Biomass,1984,5(1):1−36.
[5]Kays S,Nottingham S.Biology and Chemistry of Jerusalem artichoke.London:CRC Press,2007:1−20.
[6]Wang JM,Zhang T,Chi Z,et al.18S rDNA integration of the exo-inulinase gene into chromosomes of the high ethanol producing yeast Saccharomyces sp.W0 for direct conversion of inulin to bioethanol.Biomass Bioenerg,2011,35(7):3032−3039.
[7]Bajpai P,Margaritis A.Ethanol production from Jerusalem artichoke juice using flocculent cells of Kluyveromyces marxianus.Biotechnol Lett,1986,8(5):361−364.
[8]Bajpai P,Margaritis A.Kinetics of ethanol production by immobilized Kluyveromyces marxianus cells at varying sugar concentrations of Jerusalem artichoke juice.Appl Microbiol Biotechnol,1987,26(5):447−449.
[9]Chang BL,Yuan WJ,Zhao XQ,et al.Ethanol fermentation from Jerusalem artichoke juice with self-flocculating yeast Saccharomyces cerevisiae flo.Chin J Process Eng,2009,9(4):796−800(in Chinese).常宝磊,袁文杰,赵心清,等.自絮凝颗粒酵母发酵菊芋汁生产乙醇.过程工程学报,2009,9(4):796−800.
[10]Yuan WJ,Ren JG,Zhao XQ,et al.One-step Ethanol Fermentation with Kluyveromyces marxianus YX01 from Jerusalem artichoke.Chin J Biotech,2008,24(11):1931−1936(in Chinese).袁文杰,任剑刚,赵心清.等.一步法发酵菊芋生产乙醇.生物工程学报,2008,24(11):1931−1936.
[11]Yu J,Jiang JX,Zhang YQ,et al.Simultaneous saccharification and fermentation of Jerusalem artichoke tubers to ethanol with an inulinasehyperproducing yeast Kluyveromyces cicerisporus.Chin J Biotech,2010,26(7):982−990(in Chinese).俞静,江佳稀,张永强,等.鹰嘴豆孢克鲁维酵母利用菊芋原料同步糖化与发酵生产乙醇.生物工程学报,2010,26(7):982−990.
[12]Fonseca GG,Heinzle E,Wittmann C,et al.The yeast Kluyveromyces marxianus and its biotechnological potential.Appl Microbiol Biotechnol,2008,79(3):339−354.
[13]Yang M,Yuan WJ,Feng LH.Production of fuel ethanol from uncooked Helianthus tuberosus by consolidated bio-processing (CBP) fermentation.J Anhui Agri Sci,2012,40(9):5438−5441(in Chinese).杨梅,袁文杰,凤丽华.菊芋生料联合生物加工发酵生产燃料乙醇.安徽农业科学,2012,40(9):5438−5441.
[14]Yang M,Yuan WJ.Effect of different impellers onfuel ethanol production from uncooked Jerusalem artichoke by consolidated bio-processing fermentation.J Jinlin Inst Chem Technol,2012,29(1):71−75(in Chinese).杨梅,袁文杰.搅拌桨对菊芋联合生物加工发酵生产燃料乙醇的影响.吉林化工学院学报,2012,29(1):71−75.
[15]Bernardo O,Silva-Santisteban Y,Converti A,et al.Effects of carbon and nitrogen sources and oxygenation on the production of inulinase by Kluyveromyces marxianus.Appl Biochem Biotechnol,2009,152(2):249−261.
[16]Gill PK,Sharma AD,Harchand RK,et al.Effect of media supplements and culture conditions on inulinase production by an actinomycete strain.Bioresour Technol,2003,87(3):359−362.
[17]Bernardo O,Silva-Santisteban Y,Filho FM.Agitation,aeration and shear stress as key factors in inulinase production by Kluyveromyces marxianus.Enzym Microb Technol,2005,36(5/6):717−724.
[18]Zhang SF,Yang F,Wang Q,et al.High-level secretory expression and characterization of the recombinant Kluyveromyces marxianus inulinase.Process Biochem,2012,47(1):151−155.
[19]Yuan WJ,Zhao XQ,Ge XM,et al.Ethanol fermentation with Kluyveromyces marxianus from Jerusalem artichoke grown in salina and irrigated with a mixture of seawater and freshwater.J Appl Microbiol,2008,105(6):2076−2083
[20]Michnick S,Roustan JL,Remize F,et al.Modulation of glycerol and ethanol yields during alcoholic fermentation in Saccharomyces cerevisiae strains overexpressed or disrupted for GPD1 encoding glycerol 3-phosphate dehydrogenase.Yeast,1997,13(9):783−793.
[21]Ferguson P,Mulholland H,Barron D,et al.Sucrose-supplemented distillery spent wash as a medium for production of ethanol at 45℃ by free and alginate-immobilized preparations of Kluyveromyces marxianus IMB3.Bioprocess Eng,1998,18(4):257−259.
[22]Yuan WJ,Chang BL,Ren JG,et al.Consolidated bioprocessing strategy for ethanol production from Jerusalem artichoke tubers by Kluyveromyces marxianus under high gravity conditions.J Appl Microbiol,2012,112(9):38−44.

