碳源种类及碳氮比对眼点拟微绿球藻生长密度、油脂含量和脂肪酸组成的影响
窦晓,陆向红,卢美贞,薛蓉,晏荣军,计建炳
浙江工业大学化学工程与材料学院浙江省生物质燃料利用技术研究重点实验室,浙江杭州 310014
石化燃料的日益匮乏和燃烧带来的环境污染等问题都会影响人类的可持续发展,寻找绿色可再生能源是一项重要的战略任务[1]。微藻因生长速率快、油脂含量高、无污染以及不占耕地等特点,在众多生物质能源原料中,受到格外关注[2-4]。
目前微藻生物柴油产业发展的瓶颈问题就是成本过高,为了解决这个问题除了可以对微藻生物柴油生产的各个环节进行优化之外,还可以提取高价值的副产物。眼点拟微绿球藻脂肪酸组成简单,富含EPA[5],是微藻生物柴油理想原料之一。
氮是微藻生长必需的大量元素之一,对于微藻的生长、繁殖等生理活动有着重要的作用[6]。碳元素大约占藻细胞干重的50%,是藻细胞的主要组成部分[7],在微藻培养过程中适量加入碳源,有助于提高微藻生长的密度。氮元素对眼点拟微绿球藻生长影响的研究报道较多,碳元素对微藻生长的影响也有一定的研究:Roessler 等[8]的研究显示丰富的碳源有利于积累更多的油脂;Regnanlt 等[9]发现不同的C/N 对微藻油脂合成具有显著影响;陈洁等[10]的研究结果表明眼点拟微绿球藻偏喜重碳酸盐型碳源,在培养时加入NaHCO3能够提高微藻的生长密度;有报道提出眼点拟微绿球藻一般脂含量为28%,混养培养可达39%,如果混养培养中辅以蔗糖可达到54%[11]。他们的研究找到了眼点拟微绿球藻生长的最佳氮源NaNO3,证实了眼点拟微绿球藻能够利用外在碳源,但是最适合眼点拟微绿球藻生长和油脂积累的碳源以及在不同的NaNO3浓度下不同C/N 对眼点拟微绿球藻生长密度、油脂含量和油脂组成的影响尚未见报道。本文采用连续充气培养的方法,固定N/P=4∶1的条件下,考察了不同碳源、NaNO3浓度和C/N 耦合作用对眼点拟微绿球藻生长密度、油脂含量和脂肪酸组成的影响,以期筛选出眼点拟微绿球藻生长和油脂积累的最佳条件。
1 材料与方法
1.1 材料
试验用眼点拟微绿球藻 Nannochloropsis oculata 来自海洋生物种质库,经过涂布平板的方法纯化之后,在本实验室保存待用。
1.2 试验过程
1.2.1 眼点拟微绿球藻的扩种
选取纯化之后镜检无原生动物污染、生长状况良好的眼点拟微绿球藻,在恒温光照培养箱中用250 mL 锥形瓶进行扩种培养,培养箱温度为20℃,连续光照,光照强度为3000 lx,培养期间每天定时摇动3次。
将培养至对数期的眼点拟微绿球藻放入5 L的培养瓶中进行进一步扩种培养,培养过程连续充气,自然光照,培养温度20℃~25℃。培养采用F/2培养基[12],海水采用海水晶配制成的人工海水,pH 8.0。
1.2.2 实验设计
取2 L 培养至对数期的眼点拟微绿球藻藻液,3000 r/min 离心去除营养盐,得到待用藻泥。在相同的NaNO3浓度、N/P 下,设计4组实验,第1组为对照组,第2、3、4组培养初期分别加入1 g NaCO3、1 g NaHCO3、1 g 葡萄糖,培养至稳定期后再加入等量的碳源,选择眼点拟微绿球藻生长的最佳碳源。以选取的最佳碳源为碳源,保持N/P 不变,配制不同NaNO3浓度和C/N 的培养液,具体数据见表1。
将去除培养盐的眼点拟微绿球藻藻泥接种至1 L 的锥形瓶中,在连续通入无菌空气,自然光照,室内温度20℃~25℃,pH 8.0的条件下培养。每隔24 h 取藻液在紫外分光光度计下测定OD440的吸光度。培养至稳定期3 d 后,收集微藻,测定微藻的生物量及油脂含量。
改变眼点拟微绿球藻的接种密度,其余培养盐配方和培养方法不变,考察不同接种密度下,NaNO3浓度、C/N 对眼点拟微绿球藻生长密度和油脂含量的影响。
1.3 分析方法
1.3.1 眼点拟微绿球藻细胞密度的测定
每隔24 h,采用紫外可见分光光度仪测定微藻溶液在440 nm 处的吸光值(OD440),每个样品重复测定3次,取平均值。
1.3.2 眼点拟微绿球藻油脂含量的测定
用1 mol/L 的NaOH 溶液将培养至稳定期后3 d 的藻液的pH 值调至10.5,静置24 h,去除上清液得到藻泥。藻泥中加入去离子水,3000 r/min离心5 min,去除上清液,此过程重复3次以去除培养盐,将无培养盐的藻泥在70℃的烘箱中烘干至恒重,采用改良酸法[13]测定藻粉中油脂的含量。

表1 不同培养盐中NaNO3和NaHCO3浓度Table 1 Concentration of NaNO3 and NaHCO3 in different medium
1.3.3 眼点拟微绿球藻藻油成分的分析
藻油的甲酯化:将所得到的藻油用CHCl3溶解,转入1.5 mL Agillient 玻璃瓶中,加入1 mL 1 mol/L 的硫酸甲醇溶液,充N2密封,于100℃反应1 h,自然冷却,加入200μL 去离子水,混匀,用200μL 正己烷萃取3次,合并有机相,用200μL 去离子水反萃取洗涤3次,取有机相,转入1.5 mL Agillient 玻璃瓶中,N2吹干,称重。
气相色谱-质谱联用定性分析:采用Aglient公司生产的7890-5973N 型气质联用仪(GC-MS)对甲酯化后微藻油脂中的脂肪酸甲酯进行定性分析。GC-MS 条件:DB-5MS 石英毛细管柱色谱柱(30 m×250µm×0.25µm)。柱升温程序:初温60℃,以10℃/min升至270℃,保持5 min,再以8℃/min升至300℃,保持8 min;操作条件:进样口温度270℃,色谱-质谱接口温度260℃;载气:氦气;载气流速:1.0 mL/min;电离方式:El;电离能量:70 eV;测定方式:全扫描方式(SCAN);扫描范围:200~550 amu;进样量:1μL。
气相色谱定量分析:采用Aglient 公司生产的7890型气相色谱仪(GC),对甲酯化后微藻油脂中的脂肪酸甲酯进行定量分析。GC 分析条件:DB-WAX 毛细管色谱柱(30 m×0.32 mm×0.50μm)。柱升温程序:从50℃升至150℃,保持2 min;以10℃/min升至200℃,保持6 min;再以10℃/min升至230℃,保持5 min。载气:氮气;流量:3 mL/min。检测器:氢火焰检测器,氢气:30 mL/min;空气:300 mL/min。进样口温度:280℃;检测器温度300℃。
2 结果与分析
2.1 眼点拟微绿球藻藻油脂肪酸组成和含量的确定
取甲酯化之后的眼点拟微绿球藻藻油,采用气相色谱-质谱(GC-MS)联用定性分析脂肪酸的组成,结果如图1所示。
从图1可以看出,眼点拟微绿球藻藻油由8种脂肪酸组成,分别是饱和脂肪酸:豆蔻酸(C14∶0),棕榈酸(C16∶0),硬脂酸(C18∶0);不饱和脂肪酸:棕榈油酸(C16∶1),油酸(C18∶1),亚油酸(C18∶2),二十碳四烯酸(C20∶4),二十碳五烯酸(EPA,C20∶5)。采用气相色谱仪(GC)对藻油进行定量分析,眼点拟微绿球藻藻油中棕榈酸(C16∶0),棕榈油酸(C16∶1),EPA (C20∶5)的含量比较大,分别为32%~45%,32%~49%,1%~15%。
2.2 不同碳源对眼点拟微绿球藻生长密度和油脂含量的影响
表2显示了不同碳源对眼点拟微绿球藻生长密度和油脂含量的影响。可以看出外加碳源能够提高眼点拟微绿球藻的生长密度,但是却减低了微藻的油脂含量,这与Roessler 等[8]的研究结论“丰富的碳源有利于积累更多的油脂”矛盾,这可能是因为加入的碳源的量与他们有区别。在实验室条件下,加入NaHCO3能够获得最大生物量,这与陈洁等[10]的结论相一致。从表中可以看出3种外加碳源中,无论是从生长密度还是油脂含量来看,无机碳源的促进作用都高于有机碳源葡萄糖,可能是因为眼点拟微绿球藻的生长更加偏重于利用无机碳源。两种无机碳源中,眼点拟微绿球藻的生长和油脂积累更偏重于利用NaHCO3,这是因为NaHCO3和Na2CO3与培养液中添加的海盐中的Mg2+、Ca2+等形成了沉淀,添加Na2CO3所形成的沉淀比NaHCO3多[14],根据以上结论,此后的实验采用NaHCO3为碳源。
2.3 C/N 对眼点拟微绿球藻生长密度的影响

图1 眼点拟微绿球藻藻油甲酯的气质联用总离子流图Fig.1 Total ion chromatogram in GC-MS of fatty acid methyl ester of N.oculata.
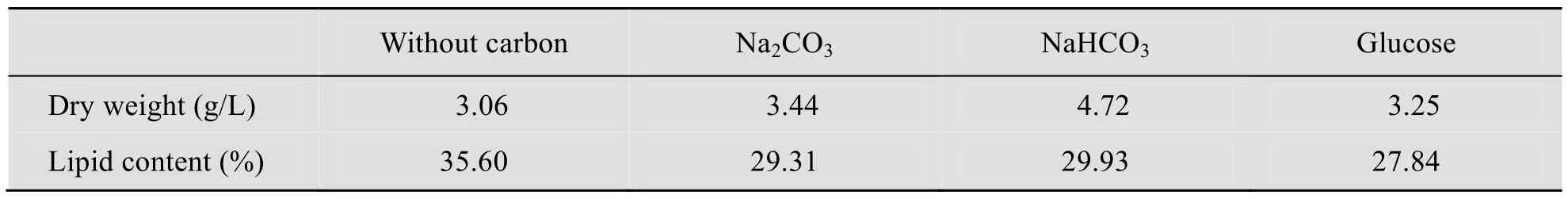
表2 不同碳源对眼点拟微绿球藻生长密度和油脂含量的影响Table 2 Effects of different carbon sources on the the growth density and lipid content of N.oculata
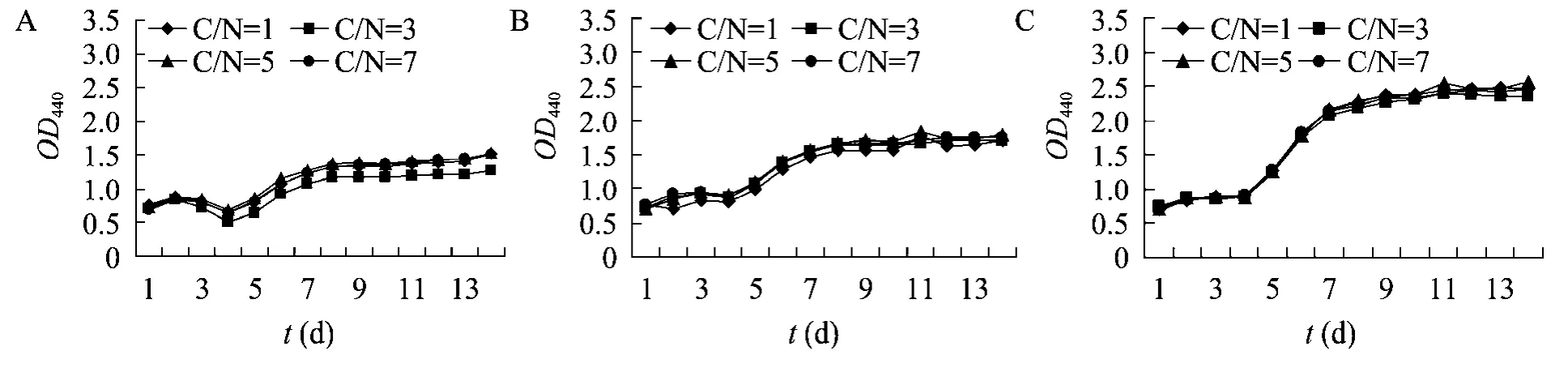
图2 不同C/N 对眼点拟微绿球藻生长密度的影响(接种密度OD440=0.70,NaNO3浓度分别为0.025 g/L(A)、0.075 g/L (B)、0.225 g/L (C))Fig.2 Effects of different C/N ratio on the growth density of N.oculata.Inoculation density at OD440 of 0.70,the concentration of NaNO3 at 0.025 g/L(A),0.075 g/L (B),0.225 g/L (C).
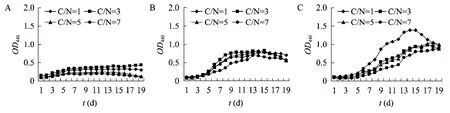
图3 不同C/N 对眼点拟微绿球藻生长密度的影响(初始接种密度OD440=0.10,NaNO3浓度分别为0.025 g/L(A)、0.075 g/L(B)、0.225 g/L (C))Fig.3 Effects of different C/N ratio on the growth density of N.oculata.Inoculation density at OD440 of 0.10,the concentration of NaNO3 at 0.025 g/L(A),0.075 g/L (B),0.225 g/L (C).
沈和定等[15]研究了初始接种密度对微绿球藻生长密度的影响,结果表明最佳的初始接种密度为(50×104~200×104)个/mL,参考此研究结果,本论文选取初始接种密度285×104个/mL(OD440=0.70)和35×104个/mL (OD440=0.10),研究NaNO3浓度和C/N 在不同初始接种密度下对眼点拟微绿球藻生长密度和油脂含量的影响。图2和图3分别为初始接种密度OD440=0.70和OD440=0.10时,在不同NaNO3浓度下C/N 对眼点拟微绿球藻生长密度的影响。可以看出NaHCO3浓度(C/N)对眼点拟微绿球藻生长密度的影响与初始接种密度和培养液中NaNO3浓度有关。在较低的NaNO3浓度时,NaHCO3浓度对微藻生长有较大影响:NaHCO3浓度存在饱和点,在低于饱和点时,随着NaHCO3浓度的增加,眼点拟微绿球藻的生长速率增加;超过饱和点时,NaHCO3浓度的增加反而会抑制微藻的生长。但随着NaNO3浓度的增加,NaHCO3对眼点拟微绿球藻生长速率的影响逐渐变小,这可能是因为在NaNO3浓度较低的时候,碳源是微藻生长的控制因子,随着NaNO3浓度的提高,氮源成为微藻生长的控制因子。在不同的初始接种密度下,NaHCO3浓度的饱和点不同,当初始接种密度OD440=0.70的时候,NaHCO3浓度的饱和点为C/N=5,此时眼点拟微绿球藻的生长速率高于其他组;当初始接种密度 OD440=0.10的时候,NaHCO3浓度的饱和点为C/N=3,此时眼点拟微绿球藻具有较高的生长速率,这可能是因为在NaNO3浓度较低时,随着接种量的增加,微藻生长所需的碳源的量有所增加。
在不同的初始接种量和NaNO3浓度下,C/N对眼点拟微绿球藻生物量的影响见表3,可以看出在不同的初始接种量和NaNO3浓度下,C/N 对眼点拟微绿球藻生物量的影响与其对微藻生长速率的影响保持一致;在相同的NaNO3浓度和C/N 下都表现为高的初始接种量能获得高的生长密度,这与张海琪等[16]的结论相一致。
2.4 C/N 对眼点拟微绿球藻油脂含量的影响
在不同的初始接种密度和NaNO3浓度下,C/N 对眼点拟微绿球藻油脂含量的影响见图4。两种接种密度下都表现为:C/N 为1时,眼点拟微绿球藻的油脂含量最高;在相同的C/N 下,随着NaNO3浓度的增加,微藻的油脂含量逐渐降低,这与Attilio Converti[17]的“氮缺陷有利于微藻油脂积累”的结论相符合;在相同的NaNO3浓度下,随着C/N 的增加,眼点拟微绿球藻的油脂含量波动比较大,但都是在C/N=1时达到最大,这可能与微藻固定CO2及油脂代谢过程中的关键酶核酮糖-1,5-二磷酸羧化酶/加氧酶(简称Rubisco)有关,这个酶是光合作用碳固定以及油脂合成过程中的重要调节酶[18],从微藻脂肪酸和油脂生物合成的途径图中可以看出[19]:在微藻油脂合成的过程中,C3循环是最基本的、最重要的一个步骤,此循环又包括3个阶段:
1)羧化阶段(CO2的固定阶段):RuBP (二磷酸核酮糖)+CO2→2 PGA (3-磷酸甘油酸);催化酶:Rubisco (核酮糖-1,5-二磷酸羧化酶/加氧酶)。
2)还原阶段:PGA→GAP(甘油醛-3-磷酸)。
3)再生阶段:RuBP 的再生。

Rubisco 的羧化活性和加氧活性需要在含有CO2及Mg2+的偏碱性pH 环境中活化[21-22],根据活化动力学的分析,Lorimer 等[23]提出以下动力学模型:
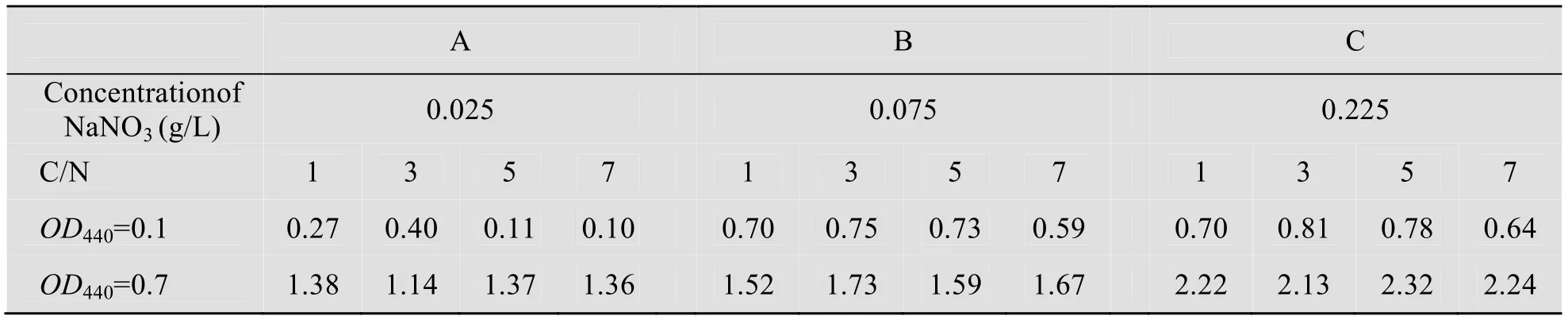
表3 接种密度和C/N 对眼点拟微绿球藻生物量的影响Table 3 Effects of different inoculation density and C/N ratio to the growth density of N.oculata
E(钝化)+ ACO2←→E-ACO2(钝化);
E-ACO2(钝化)+Mg2+←→E-ACO2-Mg2+(活化);
E 代表Rubisco 酶;ACO2代表起催化作用的CO2。
动力模型显示Mg2+对Rubisco的羧化活性和加氧活性的活化起着很大的作用,当C/N 从1增加到3的时候,培养液中HCO3−量增加,溶液碱性增强,Mg2+的沉淀量增加,游离的Mg2+降低,不利Rubisco 酶的活化,从而导致微藻的油脂含量下降;当C/N 从3增加到7的时候,此时培养基中CO2的浓度变大,酶的活性对PGA 的生成速率的影响变小,底物CO2浓度的增加起主要作用,所以微藻的油脂含量又有所增加。
在两种初始接种密度下,NaNO3浓度和C/N对眼点拟微绿球藻油脂含量影响的显著性分析结果见表4。从表4可以看出,在两种不同的接种密度下,都表现为眼点拟微绿球藻的油脂含量和NaNO3浓度显著相关(P<0.05),与C/N 有相关性,但相关性相对较弱(P>0.05),这说明眼点拟微绿球藻的油脂积累受NaNO3的浓度和C/N 影响,但NaNO3浓度的影响更大。
2.5 C/N 对眼点拟微绿球藻油脂脂肪酸组成的影响
表5显示的是C/N 对眼点拟微绿球藻油脂脂肪酸组成的影响。从表5可以看出,藻油的脂肪酸主要由棕榈酸(C16∶0)和棕榈油酸(C16∶1)组成。C/N 对藻油脂肪酸组成的影响与NaNO3浓度有关。在NaNO3浓度为0.025 g/L 时,随着C/N 的增加,棕榈酸含量下降,棕榈油酸含量增加;在NaNO3浓度为0.075 g/L 时,随着C/N 的增加,棕榈酸含量增加,棕榈油酸含量下降。
从表5还可以看当NaNO3浓度较低的时候,藻油的脂肪酸主要以饱和的和单不饱和脂肪酸为主,随着NaNO3浓度的增加,藻油中的多不饱和脂肪酸含量也随之增加。特别地,NaNO3浓度增加到0.225 g/L 时,藻油中EPA (C20∶5)含量大幅提高,达到10%以上。EPA 是一种良好的医疗保健品[24],纯度为99%的EPA 在国际上的售价已经达到了200美元/g[25],在获取微藻生物柴油的时候得到高价值的副产物能在很大的程度上降低微藻生物柴油的成本。

图4 不同的初始接种密度和NaNO3浓度下C/N 对眼点拟微绿球藻油脂含量的影响(初始接种密度分别为OD440=0.70(A),OD440=0.10(B))Fig.4 Effects of C/N ratio on the lipid content of N.oculata at different inoculation density and the concentration of NaNO3.The inoculation density with OD440 of 0.70(A) and 0.10(B).

表4 不同的初始接种密度下NaNO3浓度和C/N 对眼点拟微绿球藻油脂含量影响的方差分析Table 4 The ANOVA of the effects of the concentration of NaNO3 and C/N ratio on the lipid content of N.oculata at different inoculation density

表5 C/N 和NaNO3浓度对眼点拟微绿球藻油脂肪酸组成的影响Table 5 Effects of C/N ratio and the concentration of NaNO3 on the fat acid constituents of N.oculata
C/N和NaNO3浓度对眼点拟微绿球藻藻油饱和、单不饱和、多不饱和脂肪酸含量影响的显著性分析结果见表6。从表6中可以看出C/N 对眼点拟微绿球藻藻油脂肪酸组成成分的影响不显著(P>0.05);眼点拟微绿球藻藻油脂肪酸的组成与NaNO3浓度的相关性随着藻油脂肪酸不饱和度的增加而逐渐增加,微藻藻油中多不饱和脂肪酸的含量与NaNO3浓度极显著相关(P<0.01),所以在培养眼点拟微绿球藻的时候适当地提高NaNO3浓度能够大幅度地提高眼点拟微绿球藻藻油中多不饱和脂肪酸的含量,从而提高眼点拟微绿球藻在生产医疗保健产品上的价值。
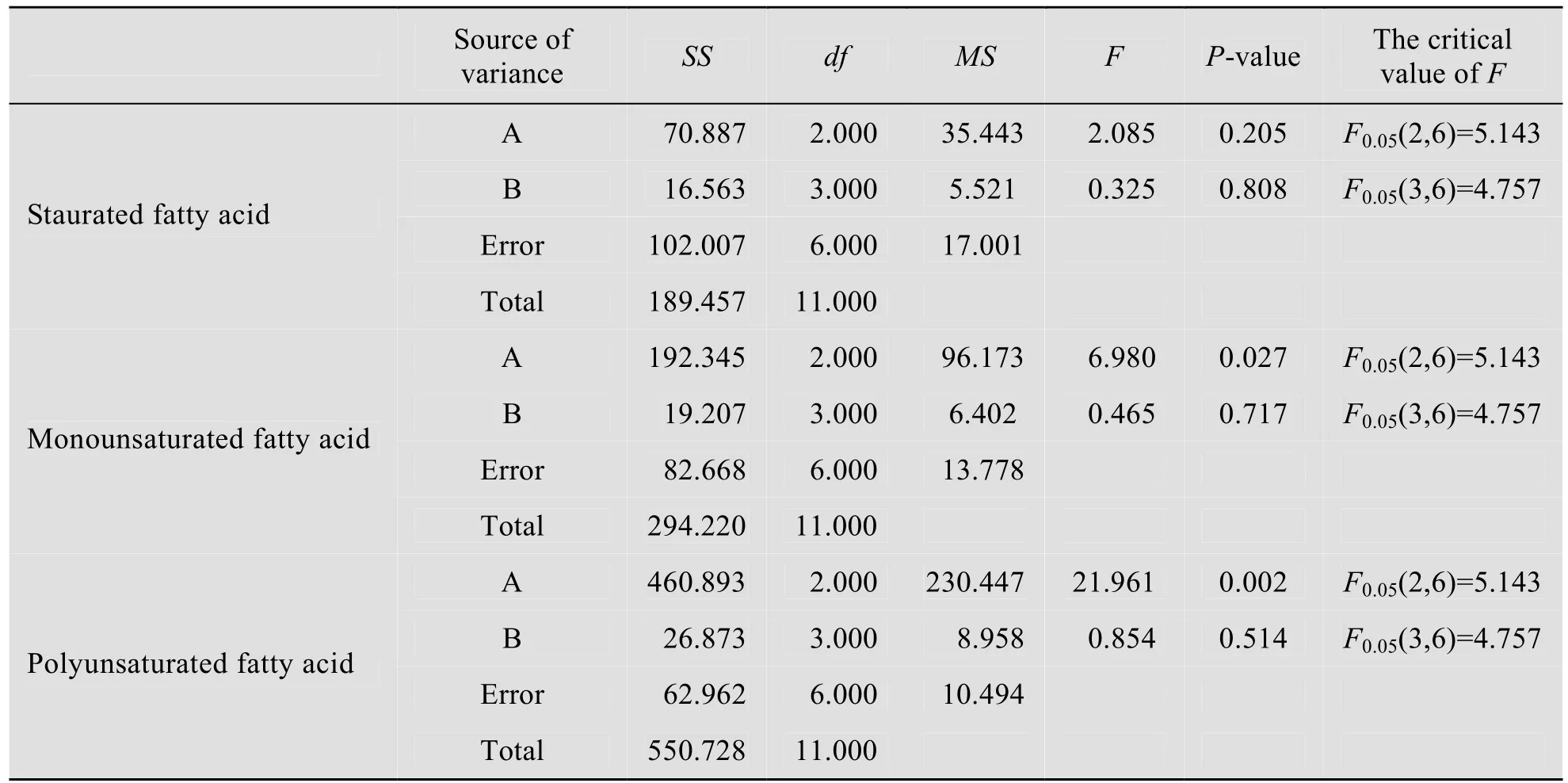
表6 C/N 和NaNO3浓度对眼点拟微绿球藻油脂脂肪酸组成影响的方差分析Table 6 The ANOVA of the effects of the concentration of NaNO3 and C/N ratio on the fat acid constituents of N.oculata
2.6 眼点拟微绿球藻最佳培养条件的筛选
微藻培养的最终目标是获得高的油脂产率,微藻油脂产率与微藻生长密度和油脂含量有关。

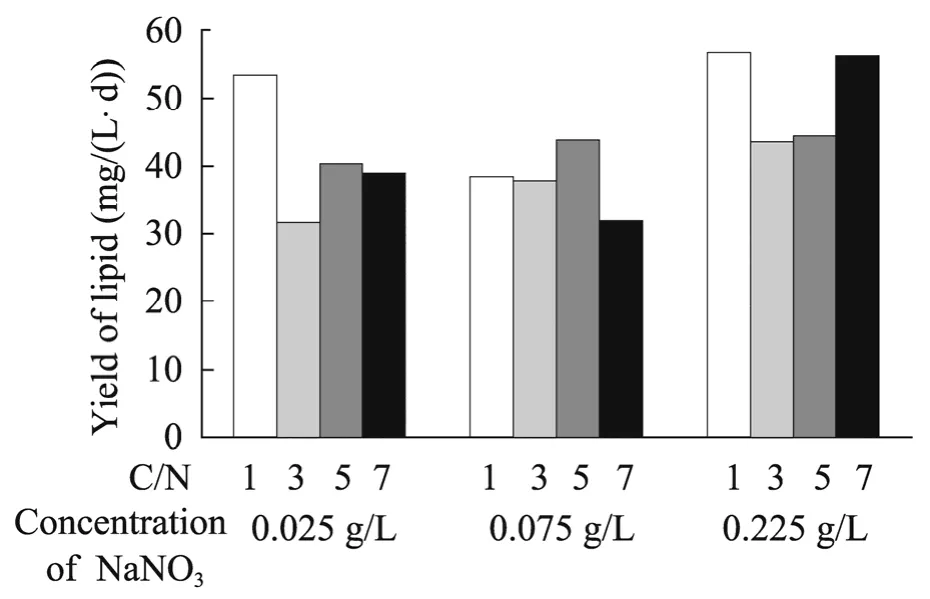
图5 不同NaNO3浓度下,C/N 对眼点拟微绿球藻油脂产率的影响Fig.5 The effects of C/N ratio on the lipid productivity of N.oculata at diffient concentration of NaNO3.
3 结论

[1]Sheehan J,Dunnahay T,Benemann J,et al.A Look Back at the US Department of Energy’s Aquatic Species Program:Biodiesel from Algae.Golden:National Renewable Energy Laboratory of the U.S.Department of Energy,1998:328.
[2]Wang ZK.Marine diatom based biofuel production.Fishery Modernization,2008,35(2):59−63(in Chinese).王兆凯.基于海洋硅藻的生物燃料油生产.渔业现代化,2008,35(2):59−63.
[3]Milne TA,Evans RJ,Nagle N.Catalytic conversion of microalgae and vegetable oils to premium gasoline,with shape selective zeolites.Biomass,1990,21:219−232.
[4]Minowa T,Yokoyama SY,Kishimoto M,et al.Oil production from algal cells of Dunaliella tertiolecta by direct thermochemical liquefaction.Fuel,1995,74:1735−1738.
[5]Browm MR,Jeffiey SW,Volkman JK,et al.Nutritional properties of microalgae for mariculture.Aquaculture,1997,151:315−331.
[6]Hu ZX,An M,Duan XS,et al.Effects of nitrogen sources on the growth,contents of total lipids and total hydrocarbons of Botryococcus brauni.Acta Ecolog Sin,2009,29(6):3288−3294(in Chinese).胡章喜,安民,段舜山,等.不同氮源对布朗葡萄藻生长、总脂和总烃含量的影响.生物科学,2009,29(6):3288−3294.
[7]Chen F,Jiang Y.Biotechnology of Microalgae.Beijing:China Light Industry Press,1999(in Chinese).陈峰,姜悦.微藻生物技术.北京:中国轻工业出版社,1999.
[8]Roessler PG.Environmental control of glycerol lipid metabolism in microalgae commercial implications and future research directions.J Phycol,1990,26:393−399.
[9]Regnanlt A,Chervin D,Chammai A,et al.Lipid composition of Euglena gracilis in relation to carbon-nitrogen balances.Phytochemistry,1995,3(40):725−733.
[10]Chen J,Jiang XM,Duan SS.Analysis of growth factors of Nannochloropsis oculata.Ecologic Sci,2002,21(1):50−52(in Chinese).陈洁,蒋霞敏,段舜山.眼点拟微绿球藻生长的生态因子分析.生态科学,2002.21(1):50−52.
[11]Yao R,Cheng LH,Xu XH,et al.Advances on technology of microalgal high lipid production.Prog Chem,2010,22(6):1221−1229(in Chinese).姚茹,程丽华,徐新华,等.微藻的高油脂化技术研究进展.化学进展,2010,22(6):1221−1229
[12]Kain JM,Fogg GE.Studies on the growth of marine phytoplankton.J Mar Biol Ass UK,1958,37:781−788.
[13]Ma S,Fu LL,Wang M,et al.Comparison of extraction methods of crude fat from microalgae.China Oils Fats,2010,35(5):77−79(in Chinese).马帅,付莉莉,汪萌,等.从微藻中提取粗脂的方法比较.中国油脂,2010,35(5):77−79.
[14]Zheng HL,Gao Z,Zhang Q,et al.Effect of inorganic carbon source on lipid production with autotrophic Chlorella vulgaris.Chin J Biotech,2011,27(3):436−444(in Chinese).郑洪立,高振,张齐,等.无机碳源对小球藻自养产油脂的影响.生物工程学报,2011,27(3):436−444.
[15]Shen HD,Huang XX.Study on metamorphosis and survival rate of zoea I of Eriocheir sinensis fed on Nannochloropsis oculata,Phaeodactylum tricornutum and powder of Spirulina platensis.J Shanghai Fisheries Univ,1999,8(3):202−209(in Chinese).沈和定,黄旭雄.三种藻类对中华绒螯蟹Ⅰ期溞状幼体培育效果的比较.上海水产大学学报,1999,8(3):202−209.
[16]Zhang HQ,Jiang XM,Pan SY,et al.Effect of light intensity,carbon source and vaccination density on the growth of Nannochloris oculata.Hebei Fishery,2011,1:9−13(in Chinese).张海琪,蒋霞敏,潘双叶,等.光照、温度、碳源及接种密度对微绿球藻生长的影响.河北渔业,2011,1:9−13.
[17]Converti A,Casazza AA,Ortiz YY,et al.Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production.Chem Eng Proc,2009,48(6):1146−1151.
[18]Zheng HL,Zhang Q,Ma XC,et al.China Biotechnol,2009,29(3):110−116(in Chinese).郑洪立,张齐,马小琛,等.中国生物工程杂志,2009,29(3):110−116.
[19]Courchesne NM,Parisien A,Wang B,et al.Enhancement of lipid production using biochemical,genetic and transcription factor engineering approaches.J Biotechnol,2009,141(1/2):31−41.
[20]卡尔文循环[EB/OL].[2012-7-16].http://jpkc.njau.edu.cn/biochemistry/BiochemistryWebCourse/View_106.asp.
[21]Laing WA,Christeller JT.A model for the kinetics of activation and catalysis of ribulose 1,5-bisphosphate carboxylase.Biochem J,159:563−570.
[22]Pierce JW,McCurry SD,Mulligan RM,et al.Activation and assay of ribulose-1,5-bisphosphate carboxylase/oxygenase.Methods Enzymol,89:47−55.
[23]Lorimer GH.The carbonxylation and oxygenation of ribulose-1,5-bisphosphate:the primary events in photosynthesis and photorespiration.Annu Rev Plant Physiol,1981,32:349−383.
[24]Tapiero H,Ba GN,Couvreur P,et al.Polyunsaturated fatty acids(PUFA)and eicosanoids in human health and pathologies.Biomed Pharmacother,2002,56(5):215−222.
[25]Barlow SM,Stansby ME.Nutritional Evaluation of Long-Chain Fatty Acids in Fish Oil.New Yock:Academic Press,1982:25−40.

