斑茅酶解转化可发酵单糖的液氨预处理及参数优化
刘建军,彭何欢,赵相君,程成,陈峰,邵千钧
浙江农林大学工程学院国家木质资源综合利用工程中心,浙江临安 311300
能源需求与环境保护是中国经济发展面临的双重压力,我国的碳排放量已居世界第一,石油消费量居世界第二。纤维素乙醇作为第二代燃料乙醇技术,受到各国政府与研究者的高度重视。纤维素乙醇燃料与汽油相比,能消减温室气体排放86%[1]。我国宜耕边际性土地资源丰富,预计生产乙醇的总潜力为7.4×107t 以上[2],可替代1/3以上的汽油消费量。斑茅 Saccharum arundinaceum Ratz,又名大密,是禾本科甘蔗属多年生、密丛高大草本,最近研究者根据基因表达将其划归为蔗茅属Erianthus。斑茅的秆粗壮,高2~4 m (最高可达6 m),茎达1~2 cm,具有分蘖力强、根系发达、抗旱性强等特性,广泛分布在我国热带、亚热带至暖温带的广大区域,具有生物产量高、较高的光合效率和干物质积累的能力。其灰分与木质素含量低、纤维素含量较高,从化学成分及能值上看斑茅很适合作能源植物[3]。
木质纤维素原料来源于植物细胞壁,主要成分是半纤维素、纤维素和木质素等,其中纤维素的成分是葡聚糖,经水解后可转化为葡萄糖,半纤维素的主要成分为木聚糖、阿拉伯聚糖、甘露聚糖等,经水解后可转化为木糖、阿拉伯糖、甘露糖等,单糖经发酵可转化为乙醇(五碳糖发酵需要经基因工程改进后的菌种)。植物具有很强的水解顽抗性,被学者称为生物质顽抗(Biomass recalcitrance)[4-5]。木质素将纤维素紧紧包裹,并形成共价键联结网络结构(Lignin-carbohydrate complexes,LCCs),半纤维素缠绕其中,再加上植物材料本身的致密性和纤维素的高结晶度,使水解酶难以接触到纤维素,导致酶解效率低下。预处理技术可去除部分木质素,瓦解纤维素的晶体结构,部分降解半纤维素,暴露纤维素的核心部分,使其在酶的作用下高效地水解成可发酵的单糖。预处理是纤维素乙醇转化过程中最重要的关键技术[4],生产成本高达30美分/加仑乙醇[6],占纤维素乙醇生产成本的1/4~1/3。预处理的主要方法有:酸预处理、碱预处理、热水预处理、蒸汽爆破法和氨纤维爆破法等[6-8],处理效果各有优劣。
氨是价格低廉的碱性原料,可采用氨的水溶液或纯液氨进行预处理。氨水预处理根据处理温度、氨含量与水分不同,主要有ARP 法(Ammonia recycle percolation)[9-10]、SAA 法(Soaking in aqueous ammonia)[11]和LMAA 法(Low moisture anhydrous ammonia)[12]等。以玉米秸秆为原料,纤维素酶的添加量为每克葡聚糖15 FPU/(g 当量葡聚糖),72 h 的葡聚糖转化率(葡萄糖得率与理论最大值之比):ARP 法为88.5%[9]和90.1%[10],SAA 法为92.5%(10 FPU/(g 当量葡聚糖))[11];LMAA 法的乙醇得率为理论最高值的89%[12]。
纯液氨处理主要采用氨爆法(Ammonia fiber explosion,AFEX),玉米秸秆在优化条件下,葡聚糖的转化率在95%以上,而木聚糖的转化率为80%以上[13]。AFEX 用于草本植物的效果良好,除玉米秸秆外,还用于稻草[14]、甜高粱秸秆[15]、青贮玉米[16]、芒[17]、柳枝稷[18-19]等。
本文提出的液氨处理法(Liquid ammonia treatment,LAT)在AFEX 的基础上作了改进,提高了温度处理范围(AFEX 认为90℃具有最佳的处理效果),并将氨的快速释放改为缓慢释放,降低了工艺控制难度与处理成本。LAT 法能移除一部分木质素,不会使半纤维素分解后的木糖降解,氨易于回收再利用,预处理过程中不产生阻碍酶解或发酵的物质,LAT 法预处理的优势与AFEX 法相似。斑茅转化燃料乙醇的相关研究目前报道还不多,由于它的生物形态和化学组分与能源草本植物芒的相近,本文的结果将与芒的预处理研究结果进行比较。
1 材料与方法
1.1 材料
实验采用的生物质原料为一年生斑茅、芒和玉米秸秆,均采自浙江省临安市浙江农林大学平山实验农场(北纬30.23°、东经119.72°),斑茅和芒的采收期为12月份,玉米秸秆采收期为7月份(播种至青穗采收约65 d)。实验采用了地上部分的整株植物,将其切割成约1~2 cm 长条状,40℃烘干至含水率低于15%,用FZ102微型植物粉碎机粉碎成50~100目的粉末。经混合均匀后采用水分分析仪MA35(赛多利斯)测得其含水率,并用塑料袋密封后置−20℃冰箱中存放备用。
用于高效液相色谱(HPLC)分析的葡萄糖、木糖等标准品均采购自Sigma-Aldrich 公司,纯度为99%以上。
添加的水解酶为纤维素酶(Novozyme NS50013)、β-葡萄糖苷酶(Novozyme NS50010)及木聚糖酶(山东泽生生物科技有限公司)。
1.2 方法
实验分析方法参照了美国的国家可再生能源实验室(National renewable energy laboratory,NREL)制订的实验规程(Laboratory analytical procedure,LAP),部分实验在相关规程上有适当改进(见下述方法表述)。
1.2.1 组分含量测定
生物质中碳水化合物和酸不溶性木质素(Klason 木质素)的含量采用酸水解法测定,碳水化合物组分由LAP002确定,酸不溶性木质素由LAP003测定。LAP002和LAP003均采用酸解法,可以在一次实验中完成。
酸水解的具体步骤是先准确称量已知含水率并去除抽提物的生物质原料约0.3 g,加入72%硫酸3 mL,在30℃水浴中保持2 h,加去离子水84 mL (稀释至4%硫酸),放入灭菌锅中121℃保持1 h。经真空过滤后将滤纸上的固形物烘干至恒重,用HPLC 法(色谱分析柱为Aminex HPX-87H 醇酸柱,美国Bio-Rad 生产)测定各种单糖的浓度,并计算出葡聚糖(纤维素)、木聚糖、阿拉伯聚糖等含量,由滤纸上的固形物质量确定不溶性木质素含量。
灰分测定采用LAP005规程,称量1 g 左右已知含水率的原料,将其放入已测定质量的有盖陶瓷坩锅中,置入箱式电阻炉中程序缓慢升温,约2 h 升后至575℃,保持此温度4 h 以上。冷至室温前将坩锅放入干燥器,称量质量并计算灰分。
1.2.2 LAT 法预处理
LAT 法预处理:根据生物质原料与液氨的比例将确定量的液氨注入称量小钢瓶,将待处理的已知含水率的原料放入反应器(高压反应釜)中,加热小钢瓶至50℃~60℃,然后将氨注入反应器,加热反应器到预定温度(约加热10~30 min,视加热器的功率与预定温度而定),然后保留一定的时间后控制在预定温度),而后氨被缓慢释放(释放时间约30 s)。取出处理后的原料置于通风柜中室温干燥12 h 左右或烘箱中低于45℃干燥。称重并测得含水率,计算预处理后生物质原料得率,将处理后的原料放入−20℃冷藏备用。
液氨预处理优化的工艺参数选择分别为:预处理的温度、含水率、驻留时间以及液氨与生物质的比例等。
1.2.3 酶水解
酶水解参照LAP009的相关规程进行,反应量由原来的10 mL 提高到15 mL。称取0.15 g 葡聚糖当量的生物质放入酶解瓶(20 mL 样品瓶),预处理后的原料中葡聚糖含量视同未作预处理原料。依次加入蒸馏水、柠檬酸钠缓冲溶液(平衡后pH 值为4.8)、抗生素(四环素和环己酰亚胺),经预混合1 h 后添加纤维素酶、β-葡萄糖苷酶、及木糖酶(有的实验组未添加)。纤维素酶的添加量为15 FPU/(g 当量葡聚糖)、β-葡萄糖苷酶64 pNPGU/g。酶解条件是温度设定为50℃,摇床转速为150 r/min。酶解取样时间分别为24 h、72 h 和144 h。
酶解取样1 mL 放入离心管,放置加热器(设置温度99℃)中加热20 min,使酶蛋白变性失效,放入−20℃冰箱冷却5 min,放入离心机(艾本德5424,设置转速14500 r/min)离心5 min,经0.22μm 一次性针头过滤器过滤(聚醚砜膜)后转入HPLC 分析瓶,放入5℃或−20℃冷藏待分析。
1.2.4 单糖的测定
酶解液或酸解液中的单糖定量分析采用HPLC 法,色谱仪为Agilent Technologies 1200 Series (安捷伦公司,带自动进样器G1329A),采用示差折光检测器检测。检测酸解液和发酵液采用BioRad 公司的HPX-87H 色谱柱,流动相为0.005 mol/L 稀硫酸,流速为0.60 mL/min,柱温为50℃。
1.2.5 酶解率计算
酶解率为实际获得单糖含量与原料中同类单糖含量之比(或同类聚糖之比),以葡聚糖的酶解率为例,其计算公式是:

酶解率d 为百分数,式中分子为酶解所获得葡萄糖含量折算成葡聚糖的量,其中g 为酶解液中葡萄糖的含量(单位为g/L);分母为理论上加入的葡聚糖量,c 为原料成分分析(酸解法)葡聚糖含量百分数,0.375为加入酶解瓶中的干基生物质原料质量。
2 结果与分析
2.1 原料组分分析
表1给出了斑茅和五节芒的组分比较(原料经95%乙醇索氏抽提24 h)。斑茅中的葡聚糖(纤维素)含量为42.88%、木聚糖含量为22.83%,两者合计65.71%;五节芒中的葡聚糖(纤维素)含量为43.70%、木聚糖含量为22.22%,两者合计65.92%。上述分析可知斑茅与五节芒的组分非常接近。
2.2 预处理温度对酶解单糖得率的影响
预处理温度对酶解率的影响如图1所示,横坐标为预处理温度(untreated 表示未经预处理),即预处理加热到此温度下并保留一定时间的温度(实验过程中温度波动范围为±5℃);纵坐标为葡聚糖/木聚糖的转化率。其他预处理条件为含水率80%、预处理驻留时间为10 min、液氨与原材料比例为2∶1。结果表明,在70℃~170℃范围内,葡聚糖的酶解转化率随着预处理温度升高而增加,至130℃时达到最大值,而后随温度升高略有下降,130℃时72 h 取样的酶解率为65.80%,与未经预处理的10.31%相比提高了5.38倍。木聚糖的酶解转化率随温度变化趋势与葡聚糖相似,也在温度为130℃时达到最高值。未经处理原料的木聚糖转化率为7.01%,温度为130℃时的木聚糖转化为81.07%,提高了10.56倍。酶解144 h 时葡聚糖和木聚糖转化率分别为74.40%和85.44%(图中未表示)。随着预处理温度的继续提高,葡聚糖和木聚糖转化率均无明显变化。Murnen 等[15]采用AFEX 预处理芒(奇冈)的实验结果中72 h 葡聚糖转化率未超过70%,此实验结果的转化率略高。国外学者以玉米秸秆为原料,采用ARP 法预处理,纤维素酶的添加量为每克葡聚糖15 FPU/(g 当量葡聚糖),72 h 的葡聚糖转化率为88.5%[9]。经对LAT 法预处理后的木质素含量分析,130℃实验条件下预处理后原料的酸不溶性木质素比未经预处理的原料下降13.75%,这是酶解效果提高的一个原因。Rollin 等研究认为提高纤维素的可及性比移除木质素更为重要[20],表面结构与纤维素结晶度改变情况有待进一步研究。
2.3 预处理含水率控制对酶解单糖得率的影响
预处理前原料的含水率对预处理效果有一定的影响,实验通过添加水来控制原料预处理时的含水率。将温度控制在优化温度130℃,原料含水率对酶解率的影响如图2所示,实验中的含水率为水分与干基物料比值。结果表明,随着含水率升高,转化率上升,当含水率为80%~100%时,葡聚糖的酶解转化率较高,72 h 取样的酶解率分别为69.34%和71.04%(因预处理批量与酶解批量不同,相同预处理条件下,酶解率略有差异),与未经预处理的10.31%相比分别提高了573%和1056%。未经处理的木聚糖转化率为7.01%,经LAT 预处理后木聚糖转化率显著提高,在含水率控制为80%时为82.60%,木聚糖转化率比未经预处理的提高了10.78倍。实验显示预处理的含水率控制为80%,酶解144 h 时,葡聚糖和木聚糖的酶解率分别为73.98%和83.39%。

表1 生物质的组分分析(干基)Table 1 Compositional analysis (dry basis) of biomass

图1 不同温度下斑茅中葡聚糖/木聚糖的酶解转化率Fig.1 Effects of temperature on glucan and xylan conversion of LAT treated Saccharum arundinaceum.The treatment condition (fixed) was at 80% moisture content (dwb),2:1 ammonia loading and 10 min residence time.The cellulase loading was 15 FPU/(g of glucan),and the enzymatic hydrolysis time was 24 h and 72 h.

图2 不同含水率下斑茅中葡聚糖/木聚糖的酶解转化率Fig.2 Effects of moisture content on glucan and xylan conversion of LAT treated Saccharum arundinaceum.The treated condition (fixed) was at 130℃,2:1 ammonia loading and 10 min residence time.The Cellulase loading was 15 FPU/(g of glucan),and the enzymatic hydrolysis time was 24 h and 72 h.
2.4 驻留时间对酶解单糖得率的影响
将温度控制在130℃、含水率为80%、液氨与原料比例为2∶1时,以驻留时间分别为5 min、10 min、15 min 对照试验,对酶解率的影响如图3所示。在10 min 内,酶解率随着预处理驻留时间增加而提升,而预处理时间继续增加时,酶解率下降。10 min 左右对葡聚糖和木聚糖均有较好的酶解转化率,分别为69.34%和82.60%。随着预处理时间加长,可能是聚糖或单糖分解导致酶解率下降,葡萄糖得率下降较缓慢,而木糖得率快速下降。
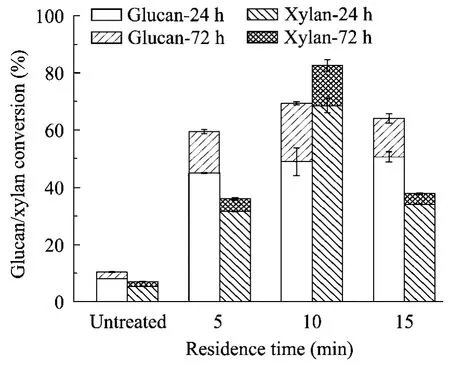
图3 不同驻留时间下斑茅中葡聚糖/木聚糖的酶解转化率Fig.3 Effects of residence time on glucan and xylan conversion of LAT treated Saccharum arundinaceum.The treated condition (fixed) was at 130℃,80%moisture content and 2:1 ammonia loading.The cellulase loading was 15 FPU/(g of glucan),and the enzymatic hydrolysis time was 24 h and 72 h.
2.5 液氨和生物质比例对酶解单糖得率的影响
将优化后的因素(130℃、80%含水率、10 min)液氨与生物质比例(干基)按照质量比0.5∶1、1∶1、2∶1、3∶1进行对照实验,结果如图4所示。当液氨比例升高时,葡聚糖转化率上升,2∶1以上增加趋缓;木聚糖的酶解转化率在2∶1时达到最高值,随着氨用量提高,木糖得率下降明显。文献指出农作物秸秆类原料最佳氨用量比例为1∶1[11-14],斑茅与之不同,结果显示优化条件与生物质种类有显著的相关性。
2.6 质量平衡与预处理效果比较
预处理与酶解的质量平衡流程如图5所示。在前述预处理优化条件(预处理温度130℃、含水率80%、驻留时间为10 min、液氨与生物质比例为2∶1),纤维素酶添加量为15 FPU/(g 当量葡聚糖),100 g 干基斑茅经72 h 酶解后可获得单糖54.47 g,而未作预处理的单糖获得量为6.73 g,转化率提高了8.09倍。Vanderghem 等采用甲酸/乙酸混合液对芒草在107℃处理3 h,其最高酶解转化率达75.3%[21],酶解效果与LAT 法相近。Sorensen 等采用稀酸预浸/湿爆法对芒草进行预处理[22],预处理后的芒酶解的葡萄糖、木聚糖的最高得率分别为63.7%和82.4%。本试验的LAT法预处理斑茅的酶解得率为69.34%和82.65%,说明LAT 法预处理对斑茅的酶解促进效果更好。
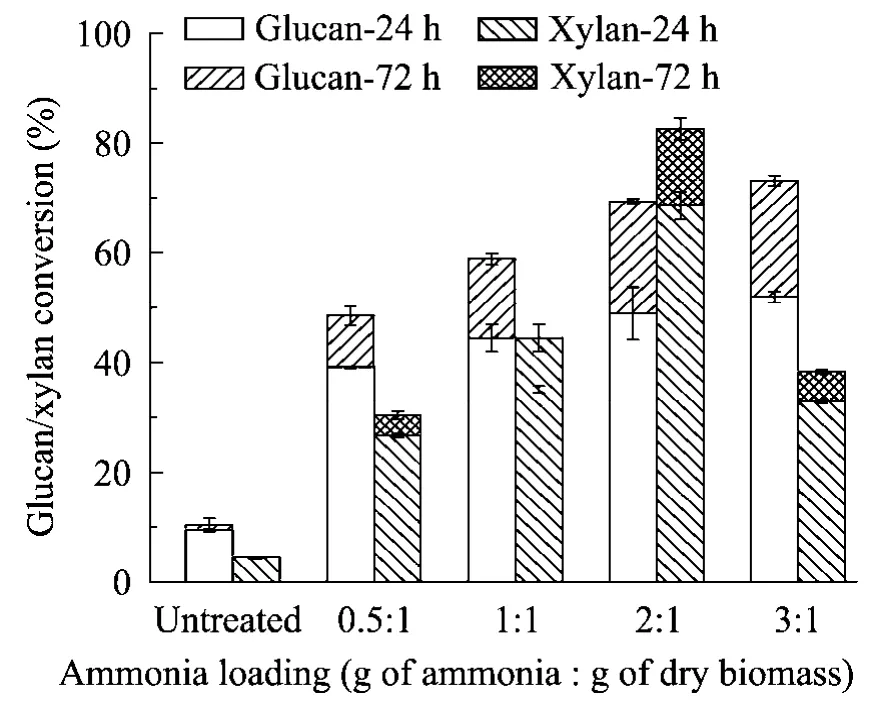
图4 液氨与生物质不同比例下斑茅中葡聚糖/木聚糖的酶解转化率Fig.4 Effects of ammonia loading on glucan and xylan conversion of LAT treated Saccharum arundinaceum.The treated condition (fixed) was at 130℃,80%moisture content and 10 min residence time.The cellulase loading was 15 FPU/(g of glucan),and the enzymatic hydrolysis time was 24 h and 72 h.

图5 斑茅液氨预处理与酶解过程质量平衡流程图Fig.5 Flow chart of mass balance during pretreatment and hydrolysis process for Saccharum arundinaceum.The LAT pretreatment condition was at 130℃,80% moisture content,2:1 ammonia loading and 10 min residence time.The cellulase loading was 15 FPU/(g of glucan),and the enzymatic hydrolysis time was 24 h and 72 h.
3 结论
通过对斑茅的LAT 法预处理、酶解过程的试验研究,得到如下结论。斑茅与芒在化学组分上比较接近,其预处理效果与芒有较大的可比性。液氨预处理能显著提高斑茅原料的单糖转化率,通过优化预处理条件比未经预处理的原料的单糖获得量提高到8倍。预处理效果优于稀酸预浸/湿爆法,与酸预处理、氨爆法(AFEX)处理效果接近。
斑茅采用LAT 法预处理的优化条件是:温度为130℃、含水率80%、驻留时间为10 min、液氨与生物质比例为2∶1时,在纤维素酶添加量为15 FPU/(g 当量葡聚糖)时,葡萄糖和木糖的72 h 酶解转化率分别为69.34%和82.65%,相比于未作预处理的原料分别提高了573%和1056%,预处理显著地提升了酶解效率。
[1]Wang M,Wu M,Huo H.Life-cycle energy and greenhouse gas emission impacts of different corn ethanol plant types.Environ Res Lett,2007,2(2):9−22.
[2]Yan LZ,Zhang L,Wang SQ,et al.Potential yields of bio-ethanol from energy crops and their regional distribution in China.Trans Chin Soc Agric Engin,2008,24(5):213−216(in Chinese).严良政,张琳,王士强,等.中国能源作物生产生物乙醇的潜力及分布特点.农业工程学报,2008,24(5):213−216.
[3]Liang XZ.Genetic diversity and evaluation of biomass energy of Erianthus arundinaceum (Retz.)JeSWiet[D].Ya’an:Sichuan Agricultural University,2011(in Chinese).梁绪振.斑茅种质资源遗传多样性及生物质能潜力评估[D].雅安:四川农业大学,2011.
[4]Himmel ME,Ding SY,Johnson DK,et al.Biomass recalcitrance:engineering plants and enzymes for biofuels production.Science,2007,315(5813):804−807.
[5]Gross AS,Chu JW.On the molecular origins of biomass recalcitrance:the interaction network and solvation structures of cellulose microfibrils.J Phys Chem B,2010,114(42):13333−13341
[6]Mosier N,Wyman C,Dale B,et al.Features of promising technologies for pretreatment of lignocellulosic biomass.Bioresour Technol,2005,96(6):673−686.
[7]Geddes CC,Nieves IU,Ingram LO.Advances in ethanol production.Curr Opin Biotech,2011,22(3):312−319.
[8]Kumar P,Barrett DM,Delwiche MJ,et al.Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production.Ind Eng Chem Res,2009,48(8):3713−3729
[9]Kim TH,Lee YY.Pretreatment and fractionation of corn stover by ammonia recycle percolation process.Bioresour Technol,2005,96(18):2007−2013.
[10]Kim TH,Lee YY,Sunwoo C,et al.Pretreatment of corn stover by low-liquid ammonia recycle percolation process.Appl Biochem Biotechnol,2006,133(1):41−57.
[11]Kim TH,Lee YY.Pretreatment of corn stover by soaking in aqueous ammonia.Appl Biochem Biotechnol,2005,121−124:1119−1131.
[12]Yoo CG,Nghiem NP,Hicks KB,et al.Pretreatment of corn stover using low-moisture anhydrous ammonia (LMAA) process.Bioresour Technol,2011,102(21):10028−10034.
[13]Teymouri F,Laureano-Perez L,Alizadeh H,et al.Optimization of the ammonia fiber explosion(AFEX) treatment parameters for enzymatic hydrolysis of corn stover.Bioresour Technol,2005,96(18):2014−2018.
[14]Zhong C,Lau MW,Balan V,et al.Optimization of enzymatic hydrolysis and ethanol fermentation from AFEX-treated rice straw.Appl Microbiol Biotechnol,2009,84(4):667−676.
[15]Li BZ,Balan V,Yuan YJ,et al.Process optimization to convert forage and sweet sorghum bagasse to ethanol based on ammonia fiber expansion(AFEX)pretreatment.Bioresour Technol,2010,101(4):1285−1292.
[16]Shao QJ,Chundawat SP,Krishnan C,et al.Enzymatic digestibility and ethanol fermentability of AFEX-treated starch-rich lignocellulosics such as corn silage and whole corn plant.Biotechnol Biofuels,2010,3(1):12.
[17]Murnen HK,Balan V,Chundawat SP,et al.Optimization of ammonia fiber expansion (AFEX)pretreatment and enzymatic hydrolysis of Miscanthus × giganteus to fermentable sugars.Biotechnol Prog,2007,23(4):846−850.
[18]Alizadeh H,Teymouri F,Gilbert TI,et al.Pretreatment of switchgrass by ammonia fiber explosion (AFEX).Appl Biochem Biotech,2005,124(1):1133−1141.
[19]Garlocka RJ,Balana V,Dale BE,et al.Comparative material balances around pretreatment technologies for the conversion of switchgrass to soluble sugars.Bioresour Tech,2011,102(24):11063−11071.
[20]Rollin JA,Zhu ZG,Sathitsuksanoh N,et al.Increasing cellulose accessibility is more important than removing lignin:a comparison of cellulose solvent-based lignocellulose fractionation and soaking in aqueous ammonia.Biotech Bioengin,2011,108(1):22−30.
[21]Vanderghem C,Brostaux Y,Jacquet N,et al.Optimization of formic/acetic acid delignification of Miscanthus × giganteus for enzymatic hydrolysis using response surface methodology.Ind Crop Prod,2012,35(1):280−286.
[22]Sørensen A,Teller PJ,Hilstrøm T,et al.Hydrolysis of Miscanthus for bioethanol production using dilute acid presoaking combined with wet explosion pre-treatment and enzymatic treatment.Bioresour Technol,2008,99(14):6602−6607.

