合成气发酵制取乙醇微生物的对比
宋安东,冯新军,王风芹,谢慧,杨大娇
1 河南农业大学生命科学学院,河南郑州 450002
2 农业部农业微生物酶工程重点实验室,河南郑州 450002
生物质是一种丰富的可再生资源,利用生物质可以生产燃料乙醇,最主要的方法有两种,即生物化学法和热化学法,后者又包括化学合成和微生物发酵[1]。微生物发酵合成气生产乙醇,是以生物质为原料生产乙醇的一种新技术。即将生物质完全气化,得到以H2、CO、CO2、N2等为主要成分的合成气,再利用一些特殊的微生物将合成气发酵为乙醇。该技术不需要昂贵的酶、酸、碱等试剂,可以将木质纤维素类生物质完全气化,微生物转化理论上可以完全利用有效气体,属环境友好型技术[2]。
目前,已经发现的可以利用合成气合成乙醇的微生物还比较少[3-4],主要是一些常温微生物和个别的嗜热微生物[5]。国外一些科研工作者,陆续从动物粪便(鸡粪[6]、兔粪[7]等)、下水道污泥[6]、农业泻湖[8]、煤浆[6]等物质中发现了一些能够利用合成气生产乙醇的微生物,开展的研究主要集中在梭状芽胞杆菌Clostridium ljungdahlii和梭状芽胞杆菌Clostridium carboxidivorans 两株菌上[9-21]。国内缺少具专利权的相关菌株,郭颖等[22-23]以国外研究较少的C.autoethanogenum为对象进行了一些研究。
实验室在前期以羊驼、长臂猿、小熊猫、狒狒的粪便为样品进行富集培养时,得到可利用合成气发酵制取乙醇的A-fm 4、G-fm 4、Lp-fm 4、B-fm 4等4种菌群。本研究以4种富集菌群为研究对象,与合成气发酵菌株C.autoethanogenum在两种接种量下发酵合成气生产乙醇的能力进行了对比。
1 材料与方法
1.1 菌株
A-fm 4、G-fm 4、Lp-fm 4、B-fm 4均为本实验室富集筛选得到的菌群,C.autoethanogenum DSM10061购自德国菌种保藏中心(DSMZ)。
富集菌群在前期试验中通过PCR-DGGE 技术进行了初步鉴定,表1是对4种富集菌群中主要微生物的16S rDNA 序列测序后的初步鉴定结果。
1.2 培养基及配制方法
DSM640活化培养基(g/L):NH4Cl 0.90,NaCl 0.90,MgCl2·6H2O 0.40,KH2PO40.75,K2HPO41.50,胰蛋白胨2.00,酵母膏1.00,FeCl3·6H2O 2.40×10−3,纤维二糖1.00,L-盐酸半胱氨酸0.75,木糖5.00。纤维二糖在培养基灭菌后过滤加入,微量元素溶液1 mL,pH 6.0。
改良培养基(g/L)[13]:NaCl 1.20,NH4Cl 1.50,KCl 0.15,MgSO4·6H2O 0.30,CaCl20.06,KH2PO40.30,酵母膏0.50,2-吗啉乙磺酸5.00,L-盐酸半胱氨酸0.20,木糖5.00。微量元素溶液添加10 mL,维生素溶液添加10 mL,pH 5.75。pH 的调节应在加入2-吗啉乙磺酸后立即进行。

表1 富集菌群中优势微生物16S rDNA 片段序列的比对结果Table 1 Comparison of 16S rDNA sequences of dominant microbes by sequencing and Blast analysis
发酵培养基[23](g/L):NH4Cl 1.00,NaCl 1.00,MgSO40.15,KH2PO40.10,CaCl20.04,胰蛋白胨2.00,酵母膏0.30,L-盐酸半胱氨酸0.20,2-吗啉乙磺酸10.00。另矿质元素溶液10 mL,维生素溶液10 mL,pH 4.5。
维生素贮液[13](mg/L):VB610,硫胺素5.00,VB25.00,泛酸钙5.00,硫辛酸5.00,对氨基苯甲酸5.00,烟碱酸5.00,VB125.00,生物素2.00,叶酸2.00。配好后用0.22μm 过滤器过滤除菌使用。
微量元素贮液[13](g/L):氨三乙酸2.00,MgSO41.00,(NH4)2SO4·FeSO4·6H2O 0.80,CoCl2·6H2O 0.20,ZnSO4·7H2O 0.20,CuCl2·2H2O 0.02,NiCl2·6H2O 0.02,Na2MoO4·2H2O 0.02,Na2O4Se 0.02,Na2WO4·2H2O 0.02。
所有培养基按配方配制,每80 mL (发酵培养基为60 mL)分装入300 mL 的厌氧培养瓶中,放入厌氧培养箱,在培养基中加入刃天青,添加量为0.50 mg/L。配好的培养基放置在充满合成气的厌氧培养箱内放置24~36 h,缓慢去除溶解氧。然后121℃,1.01×104Pa 灭菌20 min。维生素溶液和盐酸半胱氨酸采用0.45μm 的滤膜过滤除菌。
1.3 合成气
合成气组成为CO 85.5%,H210%,CO24.5%,购自河南源正科技发展有限公司。
1.4 菌种的活化
C.autoethanogenum 的活化:首次活化,打开安瓿瓶,加入已灭菌的活化培养液0.5 mL,浸润30 min;用1 mL 注射器吸取200μL,注射入平板培养瓶并涂布,维持在37℃。观察生长情况,7 d 左右菌种生长良好。向平板培养瓶添加20 mL 活化培养液,培养96 h。再次活化,直接从平板培养瓶中吸取培养液,转接到新鲜的活化培养液中,接种量10%,进行培养。
富集菌群的活化:取A- fm 4、G- fm 4、Lp- fm 4和B- fm 4的保存培养液加入活化培养基中,添加量为10%。
1.5 接种菌龄的确定
采用比浊法,将活化后的菌液接入改良培养基中(接种量10%),每隔一段时间(C.autoethanogenum 为每12 h,富集菌群为每8 h)取一定菌液,在600 nm 下,用可见分光光度计测量OD 值,测定至生物量增长缓慢或不再增长为止,绘制生长曲线,确定生长对数期。
1.6 不同接种量的影响
10%接种量发酵:将在改良培养基中生长至接种期的菌液转接至发酵培养液中,接种量为10%,利用注射器,向厌氧瓶内充入约200 mL 合成气。温度37℃,转速150 r/min 的条件下培养3 d。
25%接种量发酵:将在改良培养基中生长至接种期的菌液完全离心,收集菌体后用改良培养基悬浮至12 mL,接入4瓶发酵培养基(即每瓶发酵培养基接入3 mL),利用注射器,向厌氧瓶内充入约200 mL 合成气。温度37℃,转速150 r/min 的条件下培养3 d。
1.7 产物的测定
用注射器抽取1.5 mL 发酵液,于−4℃,8000 r/min 离心10 min,取上清液测量乙醇浓度。测定乙醇含量采用Agilent technologies 7890A GC System 气相色谱,检测器采用FID,柱子为30 m×0.32 mm×0.3μm HP-FFAP,载气为氮气,载气流率30 mL/min,分流比1∶30,色谱进样口和检测器的温度分别为200℃和250℃。
1.8 主要设备
YX-Ⅱ厌氧培养箱,购自上海新苗医疗器械制造有限公司,温度设置为37℃,每次使用前进行氮气置换5~7次,以保证厌氧环境。
厌氧培养瓶购自海门市科仪实验仪器厂。
2 结果与分析
2.1 接种菌龄的确定
2.1.1 C.autoethanogenum 接种菌龄
用比浊法绘制生长曲线(图1)。由图1可以看出C.autoethanogenum 在36 h 开始进入对数生长期,大约96 h 生长速度明显减慢,逐渐进入稳定期。生长较快的时期是60~84 h,72 h 时生长速率达到最大。选择72 h 为发酵接种菌龄。
2.1.2 富集菌群接种菌龄
分析图2可以看出G- fm 4由8 h 开始进入对数生长期,大约48 h 时菌体生长速度减缓,进入稳定期;A- fm 4、Lp- fm 4和B- fm 4适应期不明显,进入稳定期的时间分别在40 h、56 h、64 h左右。富集菌群生长最快的时期都在32 h 左右,选择32 h 为最佳发酵接种菌龄。

图1 梭状芽胞杆菌生长曲线Fig.1 Growth curve of C.autoethanogenum.
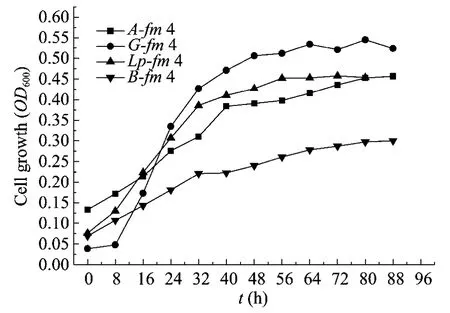
图2 富集菌群生长曲线Fig.2 Growth curve of A- fm 4,G- fm 4,Lp- fm 4 and B- fm 4.
对比图1和图2可以看出,对照菌株C.autoethanogenum 有24 h 左右的生长适应期,随后再进入对数生长期;而富集菌群的适应期不明显,除G- fm 4外,接种后立即进行对数生长。但是,C.autoethanogenum 在96 h 进入稳定期时的OD600值达到1.4左右,而4种富集菌群最大OD600值只有0.5左右。
2.2 发酵时间的确定
将在改良培养基中生长至72 h 的C.autoethanogenum 以10%的接种量接入发酵培养基中进行发酵,每12 h 取一次样测乙醇产量,得到结果如图3所示。
由图3可以看出,C.autoethanogenum 的乙醇产量随着发酵时间的延长有所增加,在72 h时达到最高值,72 h 后乙醇产量总体呈现降低趋势。所以将72 h 作为发酵的最佳时间。
2.3 接种量对乙醇产量的影响
2.3.1 10%接种量发酵的乙醇产量
由图4可以看出,在10%接种量情况下,C.autoethanogenum、A-fm 4、G-fm 4、Lp-fm 4和B-fm 4的实验结果分别为26.99、349.14、232.16、104.25和79.90 mg/L。富集菌群的乙醇产量普遍高于C.autoethanogenum 的实验结果,A-fm 4产量远远超过C.autoethanogenum 报道的最高值259.64 mg/L。
2.3.2 25%接种量发酵的乙醇产量
由图5可以看出,在25%接种量发酵中,C.autoethanogenum、A-fm 4、G-fm 4、Lp-fm 4和B-fm 4的实验结果分别为242.15、485.81、472.73、348.58和272.52 mg/L。富集菌群普遍高于对照菌株C.autoethanogenum,A-fm 4、G-fm 4、LP-fm 4、B-fm 4的乙醇产量分别比C.autoethanogenum 高100.62%、95.20%、44.00%和12.50%,均超过了C.autoethanogenum报道的最高值。
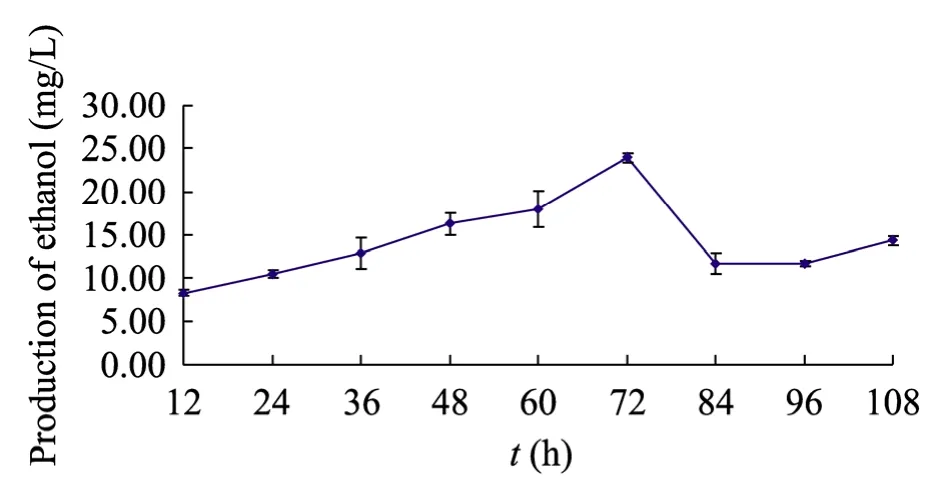
图3 不同发酵时间乙醇产量Fig.3 Ethanol production at different time.

图4 不同菌种乙醇产量比较(10%接种量)Fig.4 Comparison of ethanol production between different strains (10% inoculation size).

图5 不同菌种乙醇产量比较(25%接种量)Fig.5 Comparison of ethanol production between different strains (25% inoculation size).
比较图4和图5可以看出,25%接种量发酵可以明显提高乙醇产量,与10%接种量的乙醇产量相比,C.autoethanogenum 和4种富集菌群提高量分别为797.36%、39.14%、103.62%、234.37%和241.08%。
3 结论与讨论
10%接种量发酵,富集菌群A- fm 4、G- fm 4、LP- fm 4、B- fm 4乙醇产量分别为349.15、232.16、104.25和79.90 mg/L,均高于C.autoethanogenum的26.99 mg/L,A- fm 4的产量高于报道的C.autoethanogenum 最高产量259.64 mg/L。25%接种量发酵,富集菌群产量分别为485.81、472.73、348.58和272.52 mg/L,普遍高于对照菌株C.autoethanogenum 的242.15 mg/L 及其报道最高值。在相同的生长环境下,发酵实验接种时富集菌群的菌体密度小于C.autoethanogenum,乙醇产量却高于后者,表明富集菌群利用合成气产乙醇的能力较高。利用合成气发酵生产乙醇的微生物种类偏少,国内针对此类微生物的筛选还未见报道。由以上数据可知,4种富集菌群能够利用合成气合成乙醇,对国内在该领域的研究具有重要意义。
25%接种量发酵可以明显提高乙醇产量,与10%接种量的乙醇产量相比,C.autoethanogenum和4种富集菌群提高量分别为797.36%、39.14%、103.62%和234.37%,241.08%。鉴于以上结果,高接种量发酵可以作为一种提高乙醇产量的措施。不同菌种发酵时具有不同的最佳接种量,本文只是对10%接种量和25%接种量两个梯度进行了对比研究,后续研究应设计多个梯度进行对比试验,确定最佳接种量。
富集菌群的产量明显高于C.autoethanogenum,且与文献报道的产量相比具有显著优势。但是文献所使用的合成气组分为CO/CO2(95/5,V/V),与本试验使用合成气气体成分有一定差别。本实验中C.autoethanogenum生长曲线与文献报道的相似,表明本实验所用合成气对C.autoethanogenum生长没有明显影响,而对乙醇代谢有一定影响。Kan Liu 等以嗜碱菌Alkalibaculum bacchi 为研究对象,利用两种不同成分的合成气进行发酵,发现合成气的成分不同会影响乙醇产量[24]。
本试验进行发酵时,发酵原料来源于罐装气体,生物质合成气中除了可利用气体如CO、CO2、H2等,还含有硫化物、焦油等不可利用甚至有毒物质,这些组分会对微生物利用合成气发酵产物产生影响。郭颖等[25]研究证明生物质合成气中所含的甲苯、苯酚和焦油在一定量情况下可以提高C.autoethanogenum 乙醇的产量。Asma Ahmed等[26]研究证明合成气中存在NO 时,梭状芽胞杆菌 Clostridium carboxidivorans P7T的代谢会受到抑制。合成气的通入方式也会对发酵结果产生影响, Vel Berzin 等[27]以梭状芽胞杆菌Clostridium sp.MTEtOH550为研究对象采用连续通气法,乙醇产量由11.5 g/L 提高到27.2 g/L。后续试验需要对这些因素可能造成的影响进行研究。
[1]Munasinghe PC,Khanal SK.Biomass-derived syngas fermentation into biofuels:opportunities and challenges.Bioresour Technol,2010,101(13):5013−5022.
[2]Song AD,Feng XJ,Xie H,et al.Comparative analysis on the two technologies of ethanol production from syngas.Chin J Bioprocess Eng,2012,10(5):72−78(in Chinese).宋安东,冯新军,谢慧,等.合成气制取乙醇2种技术比较分析.生物加工过程,2012,10(5):72−78.
[3]Zhang LB,Liu JK,Li D,et al.Study on the Microbiology for syngas ethanol fermentation.Renewable Energy Resour,2007,25(3):27−30(in Chinese).张兰波,刘继开,李东,等.合成气乙醇发酵的微生物研究.可再生能源,2007,25(3):27−30.
[4]Song AD,Feng XJ,Xie H,et al.Biomass-derived syngas fermentation into fuel ethanol:research progress.Food Ferment Indus,2011,37(6):130−136(in Chinese).宋安东,冯新军,谢慧,等.生物质合成气发酵制取燃料乙醇研究进展.食品与发酵工业,2011,37(6):130−136.
[5]Henstra AM,Sipma J,Rinzema A,et al.Microbiology of synthesis gas fermentation for biofuel production.Curr Opin Biotechnol,2007,18(3):200−206.
[6]Hurst KM,Lewis RS.Carbon monoxide partial pressure effects on the metabolic process of syngas fermentation.Biochem Eng J,2010,48(2):159−165.
[7]Vega JL,Prieto S,Elmore BB,et al.The biological production of ethanol from synthesis gas.Appl Biochem Biotech,1989,20-21(1):781−797.
[8]Liou JS,Balkwill DL,Drake GR,et al.Clostridium carboxidivorans sp.nov.,a solvent-producing clostridium isolated from an agricultural settling lagoon,and reclassification of the acetogen Clostridium scatologenes strain SL1 as Clostridium drakei sp.nov..Int J Syst Evol Microbiol,2005,55(5):2085−2091.
[9]Gaddy JL,Clausen EC.Clostridium ljungdahlii,an anaerobic ethanol and acetate producing microorganism:US,5173429.1992-12-22.
[10]Najafpour G,Younesi H.Ethanol and acetate synthesis from waste gas using batch culture of Clostridium ljungdahlii.Enzyme Microb Technol,2006,38(1/2):223−228.
[11]Younesi H,Najafpour G,Mohamed AR.Ethanol and acetate production from synthesis gas via fermentation processes using anaerobic bacterium,Clostridium ljungdahlii.Biochem Eng J,2005,27(2):110−119.
[12]Ahmed A,Lewis RS.Fermentation of biomass-generated synthesis gas:effects of nitric oxide.Biotechnol Bioeng,2007,97(5):1080−1086.
[13]Rajagopalan S,Datar RP,Lewis RS.Formation of ethanol from carbon monoxide via a new microbial catalyst.Biom Bioen,2002,23(6):487−493.
[14]Datar RP,Shenkman RM,Cateni BG,et al.Fermentation of biomass-generated producer gas to ethanol.Biotechnol Bioeng,2004,86(5):587−594.
[15]Liou JSC,Balkwill DL,Drake GR,et al.Clostridium carboxidivorans sp.nov.,a solvent-producing clostridium isolated from an agricultural settling lagoon,and reclassification of the acetogen Clostridium scatologenes strain SL1 as Clostridium drakei sp.nov.Int J Syst Evol Microbiol,2005,55:2085-2091.
[16]Lewis RS,Frankman RS,Allyson T,et al.Ethanol via biomass-generated syngas.Int Sugar J,2008,110(1311):150−155.
[17]Ahmed A,Cateni BG,Huhnke RL,et al.Effects of biomass-generated producer gas constituents on cell growth,product distribution and hydrogenase activity of Clostridium carboxidivorans P7T.Biom Bioen,2006,30(7):665−672.
[18]Cotter JL,Chinn MS,Grunden AM.Influence of process parameters on growth of Clostridium ljungdahlii and Clostridium autoethanogenum on synthesis gas.Enzyme Microb Technol,2009,44(5):281−288.
[19]Cotter JL,Chinn MS,Grunden AM.Ethanol and acetate production by Clostridium ljungdahlii and Clostridium autoethanogenum using resting cells.Bioprocess Biosyst Eng,2009,32(3):369−380.
[20]Köpke M,Held C,Hujer S,et al.Clostridium ljungdahlii represents a microbial production platform based on syngas.Proc Natl Acad Sci USA,2010,107(29):13087−13092.
[21]Ukpong MN,Atiyeh HK,De Lorme MJ,et al.Physiological response of Clostridiumcarboxidivorans during conversion of synthesis gas to solvents in a gas-fed bioreactor.Biotechnol Bioeng,2012,109(11):2720−2728.
[22]Guo Y,Xu JL,Xu HJ,et al.Medium optimization for the growth of Clostridium autoethanogenum.Renewable Energy Resour,2011,29(1):53−56(in Chinese).郭颖,许敬亮,徐惠娟,等.Clostridium autoethanogenum 的生长培养基优化.可再生能源,2011,29(1):53−56.
[23]Guo Y,Xu JL,Zhang Y,et al.Medium optimization for ethanol production with Clostridium autoethanogenum with carbon monoxide as sole carbon source.Bioresour Technol,2010,101(22):8784−8789.
[24]Liu K,Atiyeh HK,Tanner RS,et al.Fermentative production of ethanol from syngas using novel moderately alkaliphilic strains of Alkalibaculum bacchi.Bioresour Technol,2012,104:336−341.
[25]Guo Y,Xu JL,Xu HJ,et al.Study on composition effects of syngas and medium on ethanol production with Clostridium autoethanogenum.Acta Energ Solar Sin,2011,32(9):1370−1374(in Chinese).郭颖,许敬亮,徐惠娟,等.合成气和培养基组分对C.autoethanogenum 发酵产乙醇的影响研究.太阳能学报,2011,32(9):1370−1374.
[26]Ahmed A,Lewis RS.Fermentation of biomass-generated synthesis gas:effects of nitric oxide.Biotechnol Bioeng,2007,97(5):1080−1086.
[27]Berzin V,Kiriukhin M,Tyurin M.Elimination of acetate production to improve ethanol yield during continuous synthesis gas fermentation by engineered biocatalyst Clostridium sp.MTEtOH550.Appl Biochem Biotechnol,2012,167(2):338−347.

