木薯纤维素乙醇发酵的纤维素酶成本评价
方镇宏,邓红波,张小希,张建,鲍杰
1 华东理工大学生物工程学院生物反应器工程国家重点实验室,上海 200237
2 中国石油吉林燃料乙醇有限责任公司,吉林吉林 132101
拥有“淀粉之王”美誉的木薯是生产生物燃料乙醇理想的非粮原料之一,大规模种植于我国的广西壮族自治区等热带与亚热带地区[1-2]。2009年,广西的木薯产量已达600万t,2008年广西北海年产20万t木薯燃料乙醇工厂已经投产运行[3-4]。在木薯燃料乙醇生产过程中,每生产1 t乙醇同时产生500 kg 左右的干基木薯发酵残渣(木薯酒渣)[5],其主要组分为木质纤维素(纤维素、半纤维素和木质素)。与从玉米生产乙醇的工艺比较,木薯酒渣比玉米酒糟(Distillers dried grains with soluble,DDGS)的可溶性糖、蛋白及脂肪含量低,饲用价值非常低,成为木薯燃料乙醇生产中难以合理处置的废弃物[6]。因此,提高木薯酒渣的附加值,对于降低木薯乙醇产业的废弃物排放和过程经济性具有重要意义。
将木薯或木薯酒渣中的纤维素和半纤维素转化为乙醇是最简便、最直接的的方法。以往利用木薯淀粉厂提取淀粉后剩余残渣的研究中,由于残渣中淀粉含量达55%~60%(干重),直接利用淀粉酶或经稀酸水解即可得到大部分还原糖[7],对含量仅15%~18%的纤维素的利用可使用复合淀粉糖化酶、纤维素酶、木糖酶对其进行降解[7-10]。木薯乙醇发酵后的残渣则不同,其淀粉含量在3%以下,主要可以利用的有效成分即是含量20%~30%的纤维素。纤维素转化为乙醇主要有以下3种可以利用的方式。
第一种:木薯纤维素酒渣的直接糖化和乙醇发酵。直接添加纤维素酶进行木薯纤维素酒渣的同步糖化与发酵生产乙醇。已有专利文献数据表明,此法木薯酒渣的乙醇产率在11%~21%之间[11],得率较低。
第二种:木薯纤维素酒渣预处理后的糖化与乙醇发酵。对木薯酒渣进行预处理后,再添加纤维素酶进行木薯酒渣的同步糖化与发酵生产乙醇。木薯乙醇生产过程的短暂高温液化和中温糖化仍不足以破坏木薯纤维成分的结构,因此,对木薯酒渣进行较高强度的预处理可以有效提高纤维素的转化率和后续乙醇发酵的得率。王永伟等利用高压蒸汽锅对木薯酒渣进行低强度的预处理,还原糖浓度达到3.25%[12]。Zhang 等用稀酸预处理后的木薯酒渣进行甲烷发酵,预处理后的物料的甲烷产率提高56.96%[13]。这些预处理方法存在加工温度低、固体浓度较低等问题,造成后续发酵工段糖浓度和乙醇浓度偏低,不具备工业应用价值。预处理过程产生的大量抑制物[14],包括呋喃类物质如糠醛、羟甲基糠醛等也严重抑制微生物生长和发酵的化合物[15],因此预处理后原料须经过脱毒处理后才能进行发酵[16]。对木薯的乙醇发酵残渣进行预处理的研究还未见报道。
第三种:木薯乙醇发酵中同步淀粉与纤维素糖化以及乙醇发酵。在液化后的木薯浆液中,同时添加糖化酶和纤维素酶,进行淀粉与纤维素的同步糖化,进而发酵生产乙醇。相关研究表明,在木薯发酵过程中添加纤维素酶,最终乙醇浓度由14.1%(V/V)提高至14.9%(V/V),说明纤维素酶有助于提高乙醇产量,但是增幅不大[17-18]。
目前,三种木薯酒渣纤维素生产乙醇的研究局限于各自方法的条件探索和优化,并无彼此之间横向的比较。本研究以木薯发酵乙醇后的酒渣为原料,对三种方法在高木薯酒渣含量条件下进行乙醇发酵的技术进行了比较,包括木薯酒渣直接同步糖化与发酵生产乙醇、木薯酒渣预处理后同步糖化与发酵生产乙醇、液化木薯浆液同步淀粉与纤维素糖化生产乙醇,并对三种方法进行了工艺优化。最后,对比了三种木薯酒渣纤维素乙醇的纤维素酶用酶成本,从酶成本角度为木薯纤维素的深加工及综合利用提供依据。
1 材料与方法
1.1 原料与试剂
木薯块茎来源于广西北海市中粮生物质能源有限公司,经锤式粉碎机粉碎并经0.5 cm 的筛网过筛后,105℃烘干并密封保存。木薯酒渣购于江苏省海门市的联海生物科技有限公司,为木薯乙醇发酵醪蒸馏出乙醇后的固体残渣,105℃下烘干后密封储存。木薯干粉与干木薯酒渣的主要组分见表1。
实验中所用的所有酶制剂均购买于杰能科国际有限公司(中国苏州)。高温淀粉液化酶HTAA (Lot number 7201455498),酶活为22000 U/mL;糖化酶为GA-L NEW (Lot number 7201417190),酶活为100000 U/mL;纤维素酶为Accellerase 1000,纤维素酶滤纸酶活和纤维二糖酶酶活分别为55.0 FPU/mL 和152.0 IU/mL。
1.2 发酵菌种及其使用
乙醇发酵菌种为本实验室自行诱变筛选得到的耐高温、耐抑制物的酿酒酵母Saccharomyces cerevisiae DQ1(中国普通微生物保藏中心CGMCC 编号为2528)。
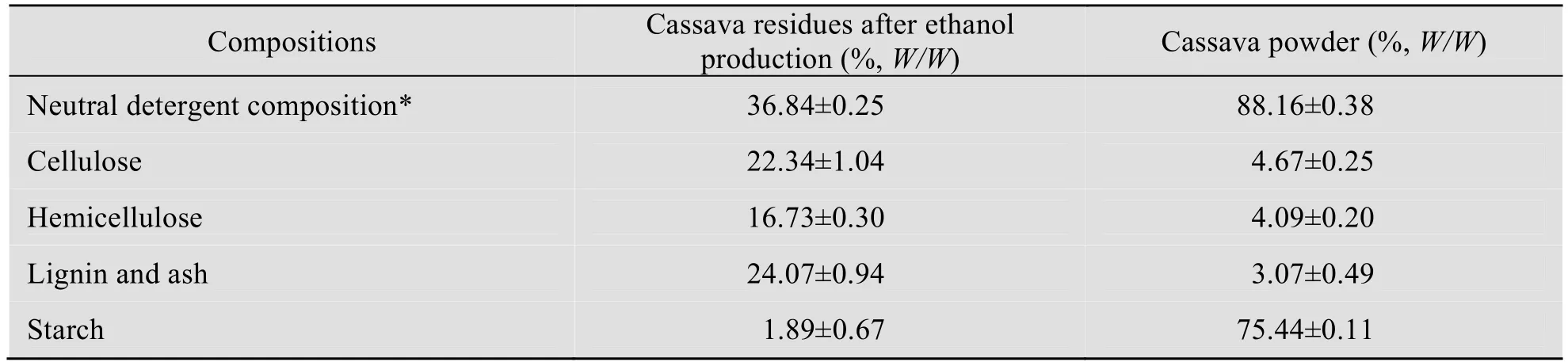
表1 木薯酒渣与木薯粉组分测定Table 1 Composition analysis of cassava residues and cassava powder
YPD 培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉(YE)10 g/L。水解液培养基:根据木薯酒渣水解液中葡萄糖的浓度,补充葡萄糖,使葡萄糖浓度为20 g/L,添加蛋白胨20 g/L,酵母粉10 g/L。同步糖化发酵过程中所用营养盐成分及浓度为:KH2PO42 g/L,MgSO41 g/L,(NH4)2SO41 g/L,YE 1 g/L。上述培养基与营养盐使用前经115℃蒸汽灭菌20 min。
木薯酒渣酶解液的制备于5 L 螺带搅拌桨反应器中进行,酶解条件为20%(W/W)固体含量、10.0 FPU/g DM 的纤维素酶用量,50℃、150 r/min酶解24 h。酶解过程加入5 mol/L NaOH 维持体系pH 为5.0。酶解结束后,8000 r/min 离心5 min,得到的上清液即为木薯酒渣酶解液。木薯酒渣酶解液主要用于不同浓度水解液培养基的配置和酵母菌的驯化。
酵母菌驯化方法为:取2 mL 冷冻保藏(−70℃)菌种,接入150 mL (500 mL 三角瓶)YPD 培养基中,37℃、150 r/min 培养箱中培养16 h (OD600=6.68)。接着以10%(V/V)的接种量接入水解液培养基150 mL,并在相同环境下继续驯化培养8 h (OD600=5.88)。
1.3 预处理反应器与木薯酒渣的预处理
高温预处理反应器为本实验室自行设计,由蒸汽发生器、高压反应釜体和储料仓组成。蒸汽发生器可以输出3.0 MPa 的高温蒸汽,经高压反应釜底部的气体分散器直接与预浸后的木质纤维素接触。同时反应釜内部压力由压力表监测,釜内温度和外壁温度均由高温热电偶监测。
本实验室开发了一种木质纤维素原料的干法稀酸预处理方法,具有用水量低、无废水排出、反应后物料固体含量高,适合后续高固体含量操作等优点[19]。在此将该方法应用于木薯酒渣的预处理:首先将烘干保存的木薯酒渣与稀硫酸(0.5%~2.5%,W/W)以2∶1的固液比(W/W)混合均匀,室温预浸12~16 h。然后将预浸后的木薯酒渣置于预处理反应器中,通入蒸汽使反应器内温度达到140℃~190℃、压力0.6~1.3 MPa,并维持3~5 min。预处理结束后,迅速打开排气阀,使反应器内压力于30 s 内降至常压。将预处理后的物料装入塑料袋,4℃保存备用。
预处理后木薯酒渣的酶解效果评价采用美国可再生能源实验室(National renewable energy laboratory,NREL)的LAP-009并稍作改动[20]。酶解体系为:5%(W/W)固体含量,0.05 mol/L的柠檬酸缓冲液(pH 4.8)为反应体系,纤维素酶用量10.0 FPU/g DM,20 mL/100 mL 的三角瓶体系,置于50℃、150 r/min 的水浴摇床中酶解24 h。在反应过程中定时取样,13000 r/min 离心5 min,上清液后经0.22μm 滤膜过滤进行HPLC分析。每组酶解实验做3个平行,取平均值。
1.4 高固体含量的木薯酒渣同步糖化与乙醇发酵
适合高固体含量木质纤维素固体糖化与发酵的5 L 生物反应器,除配置有常规的温度、pH控制系统外,安装有一组螺带搅拌桨,包括正螺旋螺带桨、涡轮/翼型桨和底桨,反应器详细结构参考文献[21]。该反应器可以处理固体含量高达40%(W/W)的木质纤维素原料进行糖化与发酵。
高固体含量物料的同步糖化与发酵在5 L 螺带搅拌桨反应器中进行[22]。此过程可分为两个阶段,即预酶解阶段和同步糖化与发酵阶段。在预酶解阶段,首先加入所需的全部纤维素酶和发酵用营养盐溶液,然后以补料的方式加入未经预处理的木薯酒渣干固体(始终保持反应体系呈液浆状)至固体含量为30%(W/W)。预酶解阶段在50℃、pH 5.0、150 r/min 的条件下维持8 h。预酶解结束后,将温度调整为37℃、pH 调整为5.5,然后以10%(W/W)的接种量接入经YPD 培养基活化16 h 的酵母菌种开始同步糖化与发酵阶段。该阶段持续64 h,在同步糖化与发酵过程中定时取样,13000 r/min 离心5 min,取上清液进行HPLC 分析。此外,对SSF 阶段的温度(30℃和37℃)和pH 值(4.5、5.0和5.5)进行了优化。
经过预处理的木薯酒渣未经脱毒处理,直接进行30%(W/W)固体含量的同步糖化与乙醇发酵。其同步糖化与发酵过程同上,但接种时的酵母菌经过水解液驯化。
1.5 木薯块茎的同步淀粉与纤维素糖化与乙醇发酵
木薯粉的乙醇发酵分为三个阶段,即液化、预酶解和同步糖化与发酵。首先将木薯粉调浆至固体含量为26.7%(W/W),置于5 L 螺带搅拌桨反应器中,以22 U/g DM 的酶量加入高温淀粉液化酶,90℃、150 r/min 的条件下液化3 h。液化结束后降温至55℃,以100 U/g DM 的酶量加入糖化酶(或同时以15 FPU/g 纤维素的酶量加入纤维素酶),150 r/min 预酶解0.5 h。预酶解结束后降温至37℃,并以10%(W/W)的接种量接入经YPD 培养基活化16 h 的酵母菌种,开始同步糖化发酵。整个木薯乙醇的生产过程,用5 mol/L 的NaOH 控制体系pH 为5.0。并定时取样,13000 r/min 离心5 min 后,将上清液进行HPLC 分析。
1.6 单位质量乙醇所需纤维素酶计算
对比生产木薯纤维素乙醇的三种方法,其共同点是投入纤维素酶使得原料中纤维素最终转化为产品乙醇。在整个工艺过程中,纤维素酶成本所占比例较大,因此可以通过对比纤维素酶的投入带来的乙醇收益的大小来比较这三种方法的优劣性。我们用单位质量乙醇所需纤维素酶活C 来评价方法的经济性,C 值越大,说明得到相同质量乙醇所需酶活越高,其经济性相对就越弱。单位质量乙醇所需纤维素酶活计算如下:

其中:C,单位质量乙醇所需纤维素酶量(FPU/g 乙醇);Y,乙醇得率;UC,纤维素酶用量(FPU/g 纤维素)。
1.7 分析方法
木薯及木薯酒渣组分分析:淀粉含量分析方法参考美国可再生能源实验室方法LAP-016[23]。纤维素与半纤维素的分析利用ANKON 公司纤维素分析仪及包装滤袋采用范氏洗涤法得到[24],即用中性洗涤剂、酸性洗涤剂、72%浓硫酸依次处理样品,利用差重法得出中性洗涤纤维(Neutral detergent fiber,NDF)、酸性洗涤纤维(Acid detergent fiber,ADF)和中酸性洗涤木质素(Acid detergent lignin,ADL)组分的含量。再根据公式:半纤维=NDF−ADF×NDF、纤维素=ADF×NDF−ADF×NDF×ADL 得到纤维素与半纤维素的含量。
中性洗涤剂溶液:乙二胺四乙酸二钠(Na2EDTA)18.61 g/L ,十水四硼酸钠(Na2B4O7·10H2O)6.81 g/L,十二烷基硫酸钠30 g/L,乙二醇乙醚10 mL/L,无水磷酸氢二钠4.65 g/L,无水亚硫酸钠10g/L,α-淀粉酶34800 U/L。
酸性洗涤剂溶液:将十六烷三甲基溴化铵(CTAB)溶解于0.5 mol/L 硫酸溶液中,CTAB 的溶度为20 g/L。
葡萄糖、木糖、乙醇及抑制物浓度分析:葡萄糖、木糖、乙醇、糠醛及羟甲基糠醛通过高效液相色谱仪(Bio-Rad HPX-87H 色谱柱,示差折光检测器RID-10A)测定。测定条件为:5 mmol/L的稀硫酸为流动相,流速为0.6 mL/min,柱温65℃。分析样品先经过适当倍数的稀释并用0.22μm 的滤膜过滤,进样量为20μL。
葡萄糖、木糖、乙醇得率均为相应理论得率的百分比,即按照理论得率为100%计算的得率。计算公式如下[25]:

其中:[Glu],酶解结束时葡萄糖浓度(g/L);[Xyl],酶解结束时木糖浓度(g/L);[Eth],发酵结束时乙醇浓度(g/L);V,酶解或发酵结束时体系的总液体体积(L);W,同步糖化与发酵过程体系的总用水量(g);f,木薯酒渣中的纤维素含量(g/g);fh,木薯酒渣中的半纤维素含量(g/g);[Biomass],糖化或发酵体系的木薯酒渣固体含量(%,W/W);m,糖化或发酵体系的总质量(g)。
上述公式中,1.111与1.136分别为葡聚糖和木聚糖转化为单糖的反应系数,0.511为酵母发酵时葡萄糖到乙醇的转化系数。乙醇得率计算采用Zhang 等[25]优化后的计算方法,此方法将高浓度乙醇发酵时生成的乙醇体积、糖化消耗的水以及乙醇-水体系混合产生的体积缩减等三个因素考虑入内所形成的新的乙醇得率计算式。在木薯粉浆同步糖化发酵计算乙醇对纤维素得率时,[Eth]为添加纤维素酶的实验组与不添加纤维素酶的对照组最终乙醇浓度的差值。
2 结果与分析
2.1 木薯酒渣的直接同步糖化与发酵生产乙醇
在木薯燃料乙醇的生产过程中,木薯要经过高温蒸煮、高温淀粉液化酶的糊化、淀粉糖化酶的糖化和微生物发酵等诸多处理,最终得到的木薯酒渣中纤维素的结构可能已经部分或完全破坏,其被纤维素酶降解的能力已得到加强。而且,直接利用木薯酒渣进行乙醇生产的工艺也是最简便、操作性最强的。目前,同步糖化与发酵(Simultaneous saccharification and fermentation,SSF)工艺是生物转化木质纤维素生产乙醇过程最常用的工艺。但在同步糖化与发酵乙醇的过程中,由于纤维素的酶解和酵母发酵的最适温度和pH 值(分别为45℃~55℃、pH 4.5~5.0和30℃~37℃、pH 5.0~6.0)都有冲突,而且纤维素的酶解在SSF 过程中为限速步骤。基于此,我们在利用木薯酒渣直接进行SSF 时,首先考察了温度和pH值对木薯酒渣发酵性能的影响(表2)。为了得到高的乙醇浓度,降低乙醇分离工序的成本,我们在实验中采用了高固体含量底物的发酵工艺。
分析表2可知,当温度为30℃和37℃时,乙醇得率分别为43.8%和46.6%,而当同步糖化与发酵阶段的温度继续提高时,酵母菌基本不能正常发酵。在37℃条件下,考察了不同pH 对木薯酒渣同步糖化与发酵的影响。如表2所示,在考察的pH 范围内,葡萄糖消耗和乙醇的生产速率差异性很小,最终生成的乙醇浓度基本接近。对比各组实验结果,在同步糖化与发酵过程中,不同实验条件下水解得到的葡萄糖基本都能被酵母利用,这说明乙醇得率低的限制因素是纤维素水解效率低,木薯酒渣中的纤维素结构并没有被充分破坏,其酶解性能较差。实验中纤维素酶的使用量为10 FPU/g 干物料,相当于45 FPU/g纤维素,在如此高的纤维素酶使用量下水解效率仍然低,继续增大酶用量已无太大意义,因此,有必要对木薯酒渣进行高强度的预处理,从而提高木薯酒渣中纤维素的转化率和乙醇得率。

表2 不同发酵参数对未经预处理木薯酒渣30%(W/W)固体含量同步糖化与发酵的影响(a:温度;b:pH 值)Table.2 Effect of different fermentation parameters on ethanol fermentation from cassava residues at 30%(W/W) solids loading (a) temperature (b) pH value
2.2 木薯酒渣稀酸预处理后的同步糖化与乙醇发酵
干法高温稀酸预处理是一种对农作物秸秆非常有效的预处理方法,同时以其低能耗和无废水排放而获得较为广泛的应用。本实验主要考察预浸固液比(木薯酒渣干固体与稀硫酸用量之比)、稀硫酸用量及反应温度三个预处理条件对木薯酒渣中纤维素转化率的影响。当固液比降低至1∶1以下时,预处理后物料含水量已达69.1%,不再适合后续的高固含量同步糖化与发酵操作,因此在固液比为2∶1的条件下,不同稀硫酸用量和温度对预处理效果的影响见表3。分析表3可知,相比未经预处理的木薯酒渣(酶解后其纤维素和半纤维素转化率分别为42.9%和5.6%),预处理后纤维素和半纤维素的转化最高可以达到63.5%(190℃,1.5%稀酸浓度条件下)和26.9%(190℃,2.5%稀酸浓度条件下)。同时,在稀硫酸用量相同的条件下,随着预处理温度的增加,纤维素的转化率有所增加,而半纤维素转化率的提高更为显著,但是预处理物料中抑制物——糠醛的浓度也成倍增加,在预处理温度相同的情况下,随着稀酸浓度的增加,纤维素和半纤维素的转化率都变化不大,而糠醛的浓度则急剧增加。综合考虑木薯酒渣中纤维素、半纤维素的转化率、抑制物的浓度以及酵母菌对抑制物的耐受性,抑制物浓度在0.5 mg/g DM (干物料)以下时无需对物料进行脱毒,而从糖转化率角度比较,越高的纤维素转化率与半纤维素转化率说明预处理效果越好,因此选定160℃,0.5%稀酸浓度预处理后的木薯酒渣,不经脱毒进行高固体含量的同步糖化与乙醇发酵。

表3 不同预处理条件下木薯酒渣的糖化结果Table 3 Effect of pretreatment conditions on enzymatic hydrolysis of cassava residues
将160℃,0.5%稀酸浓度、预浸固液比为2∶1条件下预处理后的木薯酒渣,不经脱毒直接进行30%固体含量的同步糖化与乙醇发酵,其结果如表4所示。预酶解8 h 后接入驯化后的酵母菌,开始进行同步糖化与发酵。接入酵母菌后的40 h 内,葡萄糖基本未被利用,分析体系糠醛的变化可知,在这长达40 h 的时间内,糠醛和5-羟甲基糠醛逐渐被酵母菌代谢至较低的浓度(图1)。从第48 h 开始,体系的葡萄糖浓度急剧降低,伴随着乙醇浓度的快速生成。发酵至第96 h,体系葡萄糖浓度残余2.93 g/L,生成的乙醇浓度达到26.8 g/L,木薯酒渣中乙醇得率为52.1%(表4)。综上所述,在木薯酒渣的预处理过程中生成的大量抑制物对乙醇的发酵过程产生了较为强烈的抑制作用,从而大大增加了酵母发酵过程的延滞期。

表4 预处理后木薯酒渣30%(W/W)固体含量条件下的同步糖化与发酵Table 4 Simultaneous saccharification and ethanol fermentation performance of cassava residues after pretreatment at 30%(W/W) solids loading
2.3 木薯块茎的同步淀粉与纤维素糖化生产乙醇
木薯中含有相当比例的纤维素,发酵木薯淀粉时,可以同时加入淀粉糖化酶和纤维素酶,在利用淀粉糖生产乙醇的同时,发酵纤维素酶解得到的葡萄糖也生产乙醇,从而提高发酵体系最终的乙醇产量和木薯的综合利用率。
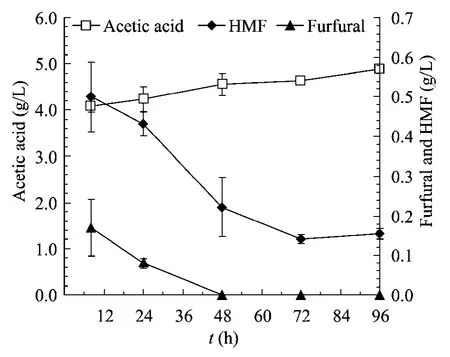
图1 预处理后木薯酒渣30%(W/W)固体含量条件下的同步糖化与发酵过程中抑制物变化曲线Fig.1 Inhibitors variation of the simultaneous saccharification and ethanol fermentation performance of cassava residues after pretreatment at 30%(W/W)solids loading.
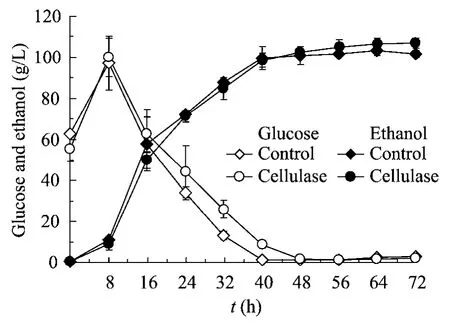
图2 添加纤维素酶对木薯原料高固体含量条件同步糖化与发酵的影响Fig.2 Simultaneous saccharification and ethanol fermentation performance of cassava powder with and without cellulase supplementation at 30%(W/W) solids loading.Experimental condition:26.7% solids loading,liquefaction was at 90°C,for 3 h,with amylase dosage of 22 U/g DM,saccharification was at 55°C,for 0.5 h with glucoamylase dosage of 100 U/g DM (or with cellulase dosage of 15 FPU/g cellulose simultaneously),SSF was at 37°C,pH 5.0,agitation rate 150 r/min.
我们对比了在木薯发酵生产乙醇的过程中,添加纤维素酶与否对乙醇发酵性能的影响,结果见图2及表5。分析图2及表5可知,与未添加纤维素酶的发酵过程相比,以15 FPU/g 纤维素的酶量加入纤维素酶后,葡萄糖的消耗速率有所降低,这可能是因为SSF 过程既有葡萄糖的释放,又有转化葡萄糖生成乙醇两个过程。而加入纤维素酶后,由于木薯中纤维素酶解生成葡萄糖,所以葡萄糖浓度相比未加入纤维素酶的实验要略高,并且最终乙醇浓度为106.95 g/L,未添加纤维素酶的实验组为101.51 g/L。在木薯粉发酵结束后,烘干发酵醪得到的木薯酒渣固形物占总重的比例为8.04%,固体中淀粉含量仅为1.89%,这部分残余淀粉一般属于较难利用的淀粉成分,很难被完全降解。假设这部分残余淀粉完全转化为乙醇,最终的乙醇浓度只能增加1.07 g/L 左右。在添加了纤维素酶的实验组中,最终乙醇浓度比对照组多出5.5 g/L,至少80%以上的乙醇增量来自于纤维素降解。而且,由于纤维素酶的水解位点是β-1,4糖苷键,区别于淀粉α-1,4糖苷键,残余淀粉在非特异性酶(纤维素酶)的作用下降解的程度有限,添加了纤维素酶的实验组的乙醇增量的绝大部分应来自于木薯纤维素降解的葡萄糖发酵。
2.4 木薯酒渣生产乙醇方法的工艺对比
对比三种木薯纤维素转化乙醇的方法,生产单位质量乙醇所需的纤维素酶活如表6所示。对比表中数据可知,由木薯酒渣作为原料进行的高固体含量SSF,所需的纤维素酶活远大于以木薯淀粉为原料进行的SSF 工艺,并且乙醇得率也处在较低水平。这是因为以木薯酒渣为原料,纤维素酶使用效率极低,木薯酒渣成分复杂、木质素含量较高、溶解性差、存在固体杂质、在高固体含量(30%)下混合效果不佳,这都会造成纤维素酶的失活或者浪费,这就需要投入大量的纤维素酶,从而造成生产单位质量乙醇所需的酶活偏高。前两种方法,即木薯纤维素酒渣的直接糖化和乙醇发酵,以及木薯纤维素酒渣预处理后的糖化与乙醇发酵,纤维素酶成本为13602、11659元/t 乙醇,按当前燃料乙醇价格6500元/吨计算,纤维素酶的成本已经超过产品乙醇的收益,因此不具备实用上的可行性。

表5 添加纤维素酶对木薯原料高固体含量条件同步糖化与发酵的影响Table 5 Simultaneous saccharification and ethanol fermentation performance of cassava powder with and without cellulase supplementation at 30%(W/W) solids loading
第三种方法即木薯乙醇发酵中同步淀粉与纤维素糖化以及乙醇发酵,与不加纤维素酶的木薯淀粉发酵的唯一区别在于添加了少量纤维素酶液体。纤维素酶的添加方式是在添加前与糖化酶复配,然后与糖化酶同时添加到液化后的木薯淀粉液浆中,由此增加的操作成本基本可以忽略不计;添加纤维素酶后的乙醇发酵操作与不添加纤维素酶的常规操作没有区别,发酵结束后发酵液的板框压滤固液分离由于固体残渣减少导致操作强度有微弱降低,而发酵液乙醇浓度的提高(约为常规操作的2%)导致精馏能耗有微弱增加,但由此微弱变化导致的成本减低和提高基本可以忽略不计。在木薯粉发酵过程中加入纤维素酶,同时利用淀粉糖与纤维素糖,由于液化后的木薯浆液成分较为单一(大多数为直链聚糖),且为液体状,不易使得纤维素酶失活,所以可以在较低的酶用量下最终提高乙醇浓度。按当前纤维素酶价格(上海尤特尔公司纤维素酶酶活:145×103FPU/kg酶,价格10元/kg)可得生产单位木薯纤维素乙醇(t)需要的纤维素酶成本为3589元,按燃料乙醇6500元/t 的价格计算,此方法利用木薯纤维素生产乙醇具有可行性与经济性。

表6 不同木薯纤维乙醇工艺对比Table 6 Comparison of the different process of cassava cellulose ethanol
3 结论
本文研究了木薯中纤维素组分发酵生产乙醇的三种不同方法,并从纤维素酶的用酶成本对其进行评估。结果表明,这三种方法都能利用木薯纤维素转化为乙醇,其中以木薯发酵残渣为原料直接(或经预处理后)用于高固含量同步糖化与发酵生产乙醇,纤维素酶投入量大,并且乙醇得率偏低,最终造成用酶成本大于产品收益,使得此方法不具有可行性。另一方面,以木薯粉为原料,在木薯乙醇生产中同步糖化与发酵淀粉糖与纤维素糖的方法,木薯纤维乙醇得率最高,发酵结束时的乙醇浓度从101.5 g/L 提高到107.0 g/L,纤维素酶成本为3589元/t 乙醇。综合考虑木薯纤维素乙醇生产工艺的复杂性和纤维素酶的成本,在木薯乙醇生产过程中,同时发酵淀粉糖和纤维素糖生产乙醇的方式是最为简便、最为经济可行的木薯纤维素乙醇转化方式。本研究将为木薯中纤维素组分的深加工和综合利用提供依据。
[1]Yu S,Tao J.Energy efficiency assessment by life cycle simulation of cassava-based fuel ethanol for automotive use in Chinese Guangxi context.Energy,2009,34(1):22−31.
[2]Jansson C,Westerbergh A,Zhang J,et al.Cassava,a potential biofuel crop in (the) People’s Republic of China.Appl Energ,2009,86(1):S95−S99.
[3]Fang X,Shen Y,Zhao J,et al.Status and prospect of lignocellulosic bioethanol production in China.Bioresour Technol,2010,101(13):4814−4819.
[4]Huang RB,Chen D,Wang QY,et al.Fuel ethanol production from cassava feedstock.Chin J Biotech,2010,26(7):888−891(in Chinese).黄日波,陈东,王青艳,等.木薯原料生产燃料乙醇.生物工程学报,2010,26(7):888−891.
[5]Zhang C,Han W,Jing X,et al.Life cycle economic analysis of fuel ethanol derived from cassava in southwest China.Renew Sust Energ Rev,2003,7(4):353−366.
[6]Hao J,Liu G,Zuo FY.Forage value and the application of cassava residue.Feed Res,2007,11:64−66(in Chinese).郝静,刘钢,左福元.木薯渣的饲用价值及应用.饲料研究,2007,11:64−66.
[7]Divya Nair MP,Padmaja G,Moorthy SN.Biodegradation of cassava starch factory residue using a combination of cellulases,xylanases and hemicellulases.Biomass BioEnergy,2011,35:1211−1218.
[8]Ancharida A,Jutarat K,Natchanun L,et al.Evaluation of the waste from cassava starch production as a substrate for ethanol fermentation by Saccharomyces cerevisiae.Ann Microbiol,2011,61:431−436.
[9]Ashok P,Carlos RS,Poonam N,et al.Biotechnological potential of agro-industrial residues.II:cassava bagasse.Biores Technol,2000,74(1):81−87.
[10]Klanarong S ,Rungsima C,Sunee C,et al.Processing of cassava waste for improved biomass utilization.Biores Technol,2000,71:63−69.
[11]Liu JH,Liu WX,Li CL,et al.Method for producing ethanol using cassava as feedstock:CN,101423849A.2009-01-06(in Chinese).刘甲申,刘文信,李春玲,等.采用含木薯渣的原料制备乙醇的方法: CN,101423849A.2009-01-06.
[12]Wang YW,Wang YJ,Zhang WJ,et al.Pretreatment condition for cassava lees by diluted acid.China Brewing,2010,2:146−149(in Chinese).王永伟,王异静,张五九,等.木薯酒糟稀酸预处理条件的研究.中国酿造,2010,2:146−149.
[13]Zhang QH,Tang L,Zhang JH,et al.Optimization of thermal-dilute sulfuric acid pretreatment for enhancement of methane production from cassava residues.Biores Technol,2011,102(4):3958−3965.
[14]Mosier N,Wyman C,Dale B,et al.Features of promising technologies for pretreatment of lignocellulosic biomass.Biores Technol,2005,96(6):673−686.
[15]Hsu TC,Guo GL,Chen WH,et al.Effect of dilute acid pretreatment of rice straw on structural properties and enzymatic hydrolysis.Biores Technol,2010,101(13):4907−4913.
[16]Zhang J,Zhu Z,Wang X,et al.Biodetoxification of toxins generated from lignocellulose pretreatment using a newly isolated fungus,Amorphotheca resinae ZN1,and the consequent ethanol fermentation.Biotechnol Biofuels,2010,3:26.
[17]Shen NK,Wang QY,Lu Y,et al.Study on the high-concentration mash and high-temperature fermentation of cassava.Liquor Making,2009,36(5):47−51(in Chinese).申乃坤,王青艳,陆雁,等.木薯淀粉高温高浓度生产酒精的工艺研究.酿酒,2009,36(5):47−51.
[18]Xie YF,Wu SH,Yi Y,et al.Experimental study on the application of cellulase to improve ethanol yield by cassava ethanol fermentation.Liquor-making Sci Technol,2009,1:30−32(in Chinese).谢玉锋,伍时华,易弋,等.应用纤维素酶提高木薯酒精发酵出酒率的试验研究.酿酒科技,2009,1:30−32.
[19]Zhang J,Wang XS,Chu DQ,et al.Dry pretreatment of lignocellulose with extremely low steam and water usage for bioethanol production.Biores Technol,2011,102(6):4480−4488.
[20]National Renewable Energy Laboratory (NREL).Enzymatic saccharification of lignocellulosic biomass.CO:National Renewable Energy Laboratory,2001,LAP-009.
[21]Zhang J,Chu DQ,Huang J,et al.Simultaneous saccharification and ethanol fermentation at high corn stover solids loading in a helical stirring bioreactor.Biotechnol Bioeng,2009,105(4):718−728.
[22]Zhang J,Chu DQ,Yu ZC,et al.Process strategy for ethanol production from lignocellulose feedstock under extremely low water usage and high solids loading conditions.Chin J Biotech,2010,26(7):1−10(in Chinese).张建,楚德强,于占春,等.低水用量约束下的高固体含量纤维乙醇生物加工技术策略.生物工程学报,2010,26(7):1−10.
[23]National Renewable Energy Laboratory (NREL).Determination of Starch in Solid Biomass Samples by HPLC.CO:National Renewable Energy Laboratory,2005,LAP-016.
[24]Van Soest PJ,Robertson JB,Lewis BA.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition.J Dairy Sci,1991,74(10):3583−3597.
[25]Zhang J,Bao J.A modified method for calculating practical ethanol yield at high lignocellulosic solid scontent and high ethanol titer.Biores Technol,2012,116:74−79.

