创伤后应激障碍大鼠海马和杏仁核中神经元凋亡及Caspase-9的表达及其意义
王海涛,刘 昊,徐爱军,刘继刚
(1.河北联合大学基础医学院组织学与胚胎学教研室,河北 唐山 063000;2.河北联合大学附属医院神经内科,河北 唐山 063000;3.河北省遵化市人民医院口腔科,河北 遵化 064200)
创伤后应激障碍大鼠海马和杏仁核中神经元凋亡及Caspase-9的表达及其意义
王海涛1,刘 昊2,徐爱军1,刘继刚3
(1.河北联合大学基础医学院组织学与胚胎学教研室,河北 唐山 063000;2.河北联合大学附属医院神经内科,河北 唐山 063000;3.河北省遵化市人民医院口腔科,河北 遵化 064200)
目的:探讨创伤后应激障碍(PTSD)大鼠海马和杏仁核神经元凋亡及Caspase-9表达水平的变化,阐明PTSD大鼠海马与杏仁核体积异常的原因。方法:将100只雄性Wistar大鼠随机分为对照组(20只)和PTSD组(80只),利用改良的单一连续应激(SPS&S)制作PTSD大鼠模型。采用Morris水迷宫实验和僵立行为实验检测大鼠行为学表现;TUNEL方法检测大鼠海马和杏仁核神经元凋亡阳性细胞率;流式细胞术(FCM)检测大鼠海马和杏仁核神经元凋亡率;Western blotting法检测大鼠海马和杏仁核中Caspase-9表达水平。结果:PTSD组大鼠逃避潜伏期(EL)和僵立行为百分比显著高于对照组(P<0.05);PTSD后1、4、7和14d大鼠海马和杏仁核TUNEL阳性细胞和凋亡率高于对照组(P<0.05),28d与对照组比较差异无统计学意义(P>0.05);PTSD后1、4、7和14d大鼠海马和杏仁核Caspase-9表达水平高于对照组(P<0.05),28d与对照组比较差异无统计学意义(P>0.05)。结论:PTSD大鼠海马和杏仁核神经元凋亡增加,Caspase-9表达水平上调,提示其凋亡可能是引起海马与杏仁核体积异常的原因之一。
创伤后应激障碍;海马;杏仁核;细胞凋亡
创伤后应激障碍(posttraumatic stress disorder,PTSD)是对创伤等严重应激因素的一种异常精神反应,由异常威胁性或灾难性心理创伤而引起,核心症状为闯入性创伤再体验、警觉性增高和反应麻木。PTSD发病率高、病程长、疗效差,成为当前研究热点之一[1-2],但其详细发病机制尚未完全阐明。在应激性疾病发病过程中,海马、杏仁核等边缘系统具有重要作用。研究[3-4]表明:PTSD患者脑部海马和杏仁核存在结构萎缩、体积缩小现象。国内学者[5-6]利用单一连续应激(single prolonged stress,SPS)复制PTSD模型,从形态学方面探讨其原因的结果提示:PTSD海马和杏仁核部位可见具有凋亡特征的神经元。但尚未见PTSD海马、杏仁核神经元凋亡发生规律及其调控的报道。本实验建立PTSD大鼠模型,检测大鼠海马和杏仁核神经元凋亡发生规律,以揭示海马和杏仁核结构异常的原因,为PTSD发病机制研究提供实验依据。
1 材料与方法
1.1 实验动物
健康雄性Wistar大鼠100只,体质量180~200g(河北联合大学实验动物中心提供,动物合格证编号:SCXK京2009-0004)。实验前大鼠适应性饲养1周。饲养条件:22℃~25℃,昼夜节律(12/12h),自由饮水摄食。
1.2 主要试剂和仪器
原位细胞凋亡检测试剂盒(Roch公司),兔抗鼠Caspase-9一抗(美国Santa Cruz公司),辣根过氧化物酶标记羊抗兔IgG(博士德生物技术公司);流式细胞仪(FACSCalibur,美国B&D公司),Morris水迷宫(淮北正华公司)。
1.3 PTSD模型建立及动物分组
将大鼠分为对照组(20只)和PTSD组(80只)。采用改良的SPS制作PTSD动物模型。具体方法:首先给予大鼠SPS,包括禁锢2h、强迫游泳15min和乙醚麻醉至昏迷;随后给予不可逃避足底电击(single inescapable electric foot shock),电击后静养7d。PTSD组大鼠分别于静养结束后1、4、7、14和28d处死,每个时间点处死5只大鼠,行TUNE法、流式细胞术和Western blotting法检测,共处死75只大鼠。对照组大鼠每天抓取1次,无其他额外刺激。
1.4 大鼠行为学检测
对照组和PTSD组各取5只大鼠用于行为学检测。
1.4.1 Morris水迷宫实验 连续测试3d,每天5个循环,记录大鼠在120s内寻找水面下平台的时间,即逃避潜伏期(escape latency,EL)。取3d的平均测试结果。
1.4.2 僵立行为测定 2组大鼠于电击后7d,放入电击设备箱内,检测大鼠4min僵立行为。每10s测1次,表现为僵立行为判定为阳性,所得阳性次数之和占总次数的百分比为僵立行为百分比。
1.5 TUNEL法检测大鼠海马和杏仁核神经元凋亡阳性率
对照组和PTSD组各时间点分别取5只大鼠,麻醉后断头取脑,常规石蜡包埋,做石蜡切片(5μm)。按照试剂盒说明书进行TUNEL染色,检测海马和杏仁核神经元凋亡。每张切片分别随机取5个高倍镜视野进行计数,计算凋亡阳性细胞率。阳性细胞率=(TUNEL阳性神经元数/视野内神经元总数)×100%。
1.6 流式细胞术检测大鼠海马和杏仁核神经元凋亡率
对照组和PTSD组各时间点分别取5只大鼠,麻醉后断头取脑,分离海马和杏仁核。将海马和杏仁核组织用0.25%胰酶37℃恒温消化为细胞悬液。经过滤纯化,用PBS调整细胞浓度为(5~10)×105mL-1。取1mL细胞,1 000r·min-1、4℃离心10min,弃上清,加入1mL预冷PBS,振荡使细胞悬浮。重复操作3次,弃上清。将细胞重悬于200μL Binding Buffer液中,加入10μL Annexin V-FITC和5μL Propidium Iodide,轻轻混匀,避光室温反应15min。加入300μL Binding Buffer液,上机检测。计算早期凋亡细胞占存活细胞的比例,即神经元凋亡率。
1.7 Western blotting法检测Caspase-9表达水平
对照组和PTSD组各时间点分别取5只大鼠,麻醉后断头取脑,冰上快速分离海马和杏仁核,加入RIPA裂解液,提取组织总蛋白,定量后按照30μg蛋白量上样,进行10%SDS-PAGE电泳,PVDF膜电转印,脱脂奶粉封闭,Caspase-9一抗(1∶500)4℃孵育过夜,二抗IgG(1∶5 000)室温孵育1h,增强化学发光法(ECL)显色。内参照β-actin的 Westen blotting分析方法同上。以目的条带与内参照的光密度比值表示蛋白表达水平。
1.8 统计学分析
采用SPSS 13.0统计软件进行统计分析。大鼠平均EL、僵立行为百分比、TUNEL阳性率、神经元凋亡率和Caspase-9表达水平以±s表示。大鼠平均EL、僵立百分比组间比较采用t检验,TUNEL阳性细胞率、神经元凋亡率和Caspase-9表达水平组间比较采用单因素方差分析。
2 结 果
2.1 2组大鼠平均EL
对照组与PTSD组大鼠平均EL分别为(15.63±1.09)s和(72.76±5.84)s,PTSD组显著高于对照组(P<0.05)。Morris水迷宫轨迹图见图1。
2.2 2组大鼠僵立行为百分比
PTSD组大鼠再次放入电击设备箱后(重新面临恐惧情景时),大鼠表现为明显的僵立行为,活动明显减少,主要为刻板的蹲伏行为,仅头部有轻微的转动,背部拱起。对照组大鼠表现为自由运动。对照组大鼠僵立行为百分比为(12.5±4.2)%,PTSD组大鼠为(60.0±7.6)%,2组比较差异有统计学意义(P<0.05)。

图1 Morris水迷宫实验轨迹图Fig.1 The locus result of Morris water maze test
2.3 2组大鼠海马和杏仁核神经元凋亡
镜下可见:对照组大鼠TUNEL阳性细胞较少,凋亡率低,PTSD组各时间点阳性细胞率明显上调。与对照组比较,PTSD后1d大鼠海马和杏仁核组织凋亡细胞明显增多,凋亡率增高,4d继续增多,7d达到高峰,14d开始下降,但仍明显高于对照组 (P<0.05)。PTSD后28d,阳性细胞率和凋亡率与对照组比较差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠海马和杏仁核神经元凋亡Tab.1 Neuronal apoptosis in rat hippocampus and amydala in various groups [η/(±s)%)]
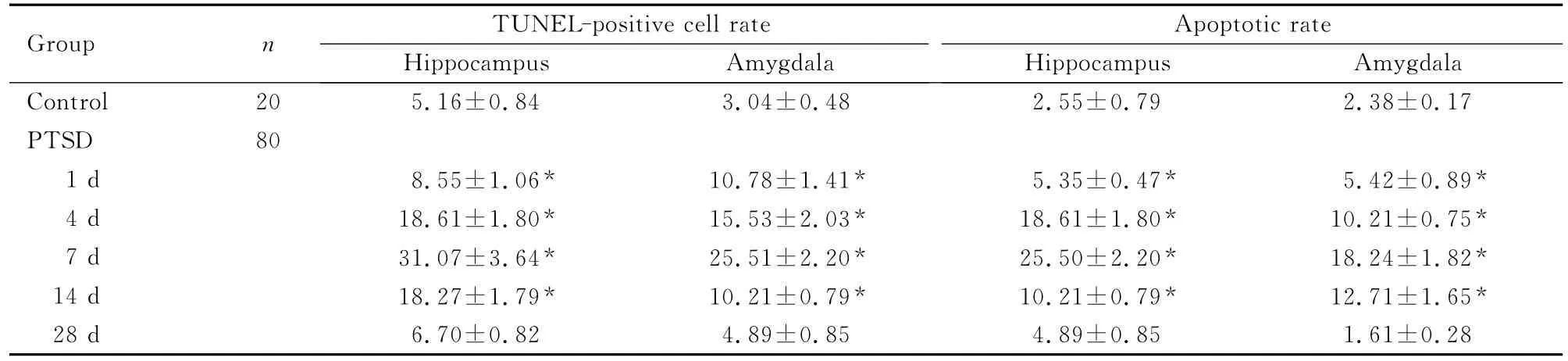
表1 各组大鼠海马和杏仁核神经元凋亡Tab.1 Neuronal apoptosis in rat hippocampus and amydala in various groups [η/(±s)%)]
*P<0.05compared with control group.
Group n TUNEL-positive cell rate Hippocampus Amyg 8±0.17 PTSD 80 1d 8.55±1.06* 10.78±1.41* 5.35±0.47* 5.42±0.89*4d 18.61±1.80* 15.53±2.03* 18.61±1.80* 10.21±0.75*7d 31.07±3.64* 25.51±2.20* 25.50±2.20* 18.24±1.82*14d 18.27±1.79* 10.21±0.79* 10.21±0.79* 12.71±1.65*Apop dala Control 20 5.16±0.84 3.04±0.48 2.55±0.79 2.3 dala totic rate Hippocampus Amyg 28d 6.70±0.82 4.89±0.85 4.89±0.85 1.61±0.28
2.4 大鼠海马和杏仁核Caspase-9表达水平
与对照组比较,PTSD后1、4、7和14d大鼠海马和杏仁核Caspase-9蛋白表达水平均明显增高 (均P<0.05)。PTSD后28dCaspase-9蛋白表达水平与对照组比较差异无统计学意义 (P>0.05)。见图2和表2。
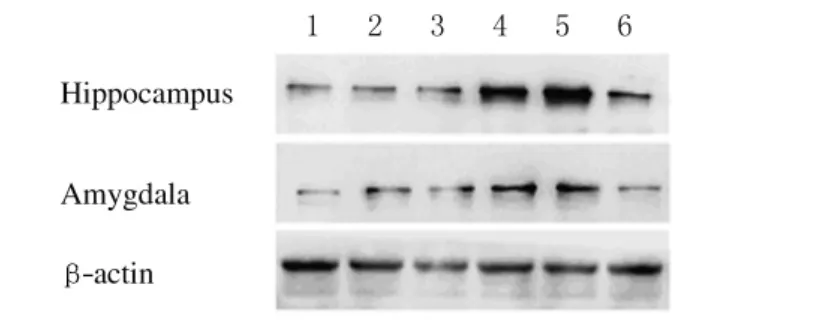
图2 大鼠海马和杏仁核Caspase-9的表达电泳图Fig.2 Electrophoregram of expressions of Caspase-9in hiappocampus and amygdala of rats
表2 2组大鼠海马和杏仁核Caspase-9表达水平Tab.2 The expression levels of Caspase-9in hippocampus and amygdala of rats in two groups (±s)

表2 2组大鼠海马和杏仁核Caspase-9表达水平Tab.2 The expression levels of Caspase-9in hippocampus and amygdala of rats in two groups (±s)
*P<0.05compared with control group.
Group n Expression levels of Caspase-9 Hippocampus Amygdala Control 20 0.43±0.04 0.43±0.02 PTSD 80 1d 15 0.66±0.07* 0.68±0.03*4d 15 1.00±0.11* 0.98±0.13*7d 15 1.23±0.10* 1.18±0.08*14d 15 1.09±0.12* 1.05±0.08*28d 15 0.57±0.10 0.59±0.09
3 讨 论
PTSD是由异常威胁性或灾难性心理创伤而导致的延迟出现持续的精神障碍,是对创伤等严重刺激因素的一种异常精神反应,是应激疾病中最为典型的一种。随着战争、社会暴力事件、重大交通事故和自然灾害等创伤意外事件不断增多,PTSD发生率越来越高,严重影响患者生活质量和社会稳定。对PTSD的基础研究得益于动物模型的建立。研究[7]表明:在大鼠接受SPS后立即给予不可逃避的足底电击,能使大鼠表现出PTSD临床症状,是研究PTSD较好的动物模型。本研究行为学检测结果显示:PTSD组大鼠寻找平台的逃避潜伏期显著高于对照组,说明SPS&S应激能损伤大鼠的空间记忆能力。恐怖记忆行为测定结果显示:模型组僵立行为百分比显著高于对照组,表明SPS&S可使大鼠获得对恐惧情景的记忆,上述结果表明该模型较好地模拟了PTSD的核心症状即病理性恐惧记忆增强。
PTSD详细发病机制目前尚未被阐明。在严重创伤应激急性期,中枢神经系统皮质边缘区,特别是大鼠海马和杏仁核等部位是中枢神经系统应激应答敏感区,其功能正常与否与PTSD发病密切相关。海马是学习记忆的重要脑区,杏仁核是恐惧形成和表达的关键中枢,杏仁基底外侧核和中央核被认为是恐惧学习和记忆中重要的中枢,在介导应激相关的记忆损害尤其是闯入性记忆中起重要作用[8],而且海马和杏仁核的功能密切相关,海马的部分功能可由杏仁核的调节而实现[9]。PTSD患者和动物模型均发现脑部海马和杏仁核存在结构萎缩、体积缩小现象[3-4]。上述研究结果提示:在PTSD发病过程中,海马和杏仁核部位神经元存在丢失或死亡等病理改变。细胞凋亡为细胞程序性死亡,是细胞为维持内部环境稳定,由基因活动指导下的主动性死亡。国内学者[10-12]采用SPS应激复制PTSD大鼠模型时发现:大鼠海马和杏仁核部位存在神经元凋亡现象。本实验结果提示:SPS&S应激后大鼠海马和杏仁核存在明显的细胞凋亡,提示神经元凋亡可能与PTSD大鼠海马、杏仁核体积异常有关。Caspase家族是凋亡的主要执行者,其中Caspase-9与凋亡启动有关。本研究中Caspase-9在PTSD大鼠海马和杏仁核组织中表达上调,提示Caspase-9可能是PTSD记忆减退、警觉增高和恐惧异常形成的病理生理基础之一。
综上所述,PTSD大鼠海马和杏仁核存在细胞凋亡,但这些部位神经元凋亡的信号转导机制以及PTSD的详细发病机制尚需进一步研究探讨。
[1]North CS,Pfefferbaum B,Kawasaki A,et al.Psychosocial adjustment of directly exposed survivors 7years after the Oklahoma City bombing [J].Compr Psychiatry,2011,52 (1):1-8.
[2]Petersen T,Elklit A,Olesen JG.Victimization and PTSD in a Faroese youth total-population sample[J].Scand J Psychol,2010,51 (1):56-62.
[3]Golub Y,Kaltwasser SF, Mauch CP,et al. Reduced hippocampus volume in the mouse model of posttraumatic stress disorder[J].J Psychiatry Res,2011,45 (5):650-659.
[4]Schmahl C,Berne K,Krause A,et al.Hippocampus and amygdala volumes in patients with borderline personality disorder with or without posttraumatic stress disorder[J].J Psychiatry Neurosci,2009,34 (4):289-295.
[5]李晓明,韩 芳,石玉秀.创伤后应激障碍大鼠海马神经元凋亡的形态学变化及相关基因表达 [J].解剖学报,2008,38 (5):631-635.
[6]刘冬娟,韩 芳,刘宁宇,等.PTSD大鼠杏仁核神经元和突触的超微结构研究 [J].解剖科学进展,2009,15 (1):17-20.
[7]Wang W,Liu Y,Zheng H,et al.A modified singleprolonged stress model for post-traumatic stress disorder[J].Neurosci Lett,2008,441 (2):237-241.
[8]Cui H,Sakamoto H,Higashi S,et al.Effects of singleprolonged stress on neurons and their afferent inputs in the amygdala[J].Neuroscience,2008,152 (3):703-712.
[9]Roozendaal B, Griffith QK,Buranday J,et al. The hippocampus mediates glucocorticoid-induced impairment of spatial memory retrieval:dependence on the basolateral amygdala[J].Proc Natl Acad Sci USA,2003,100 (3):1328-1333.
[10]Ding JL,Han F,Shi YX.Single-prolonged stress induces apoptosis in the amygdale in a rat model of posttraumatic stress disorder [J].J Psychiatry Res,2010,44 (1):48-55.
[11]Li XM,Han F,Liu DJ,et al.Single-prolonged stress induced mitochondrial-dependent apoptosis in hippocampus in the rat model of post-traumatic stress disorder[J].J Chem Neuroanat,2010,40 (3):248-255.
[12]Li X,Han F,Liu D,et al.Changes of Bax,Bcl-2and apoptosis in hippocampus in the rat model of post-traumatic stress disord er[J].Neurol Res,2010,32 (6):579-586.
Neuronal apoptosis and expressions of Caspase-9in hippocampus and amygdala of PTSD rats and their significances
WANG Hai-tao1,LIU Hao2,XU Ai-jun1,LIU Ji-gang3
(1.Department of Histology and Embryology,College of Basic Medicine,Hebei United University,Tangshan 063000,China;2.Department of Neurology,Affiliated Hospital,Hebei United University,Tangshan 063000,China;3.Department of Stomatology,Zunhua People’s Hospital,Hebei Province,Zunhua 064200,China)
Objective To observe the changes of neuronal apoptosis and expression levels of Caspase-9in hippocampus and amygdala of posttraumatic stress disorder(PTSD)rats,and to disscus the mechanism of the volume abnormalities of hippocampus and amygdala.Methods 100male Wistar rats were divided into control group(n=20)and PTSD group(n=80).The PTSD rat model was produced by giving the rats single-prolonged stress followed a single inescapable electric foot shock(SPS & S).The behavior changes of rats were examined using Morris water maze test and freezing behavior test.The positive apoptotic rates of cells and apoptotic rates in hippocampus and amygdala were detected by TUNEL-staining and flow cytometry(FCM).The expression level of Caspase-9was detected by Western blotting method.Results The excape latency (EL)time and percentage of freezing behavior in PTSD group were higher than those in control group(P<0.05).The percentages of TUNEL-positive cells and the apoptotic rates in hippocampus and amygdala of PTSD 1,4,7and 14drats were higher than those in control group(P<0.05),but there was no significant difference between PTSD 28drats and control rats(P>0.05).The expression levels of Caspase-9in hippocampus and amygdala of PTSD 1,4,7and 14drats were higher than those in control group(P<0.05).Conclusion The apoptosis of neurons and expression levels of Caspase-9in hippocampus and amygdala of PTSD rats are increased,which indicates that apoptosis may be duced to the volume abnormalities of hippocampus and amygdala of PTSD.
posttraumatic stress disorder;hippocampus;amygdala;apoptosis
R322.81
A
1671-587Ⅹ(2013)03-0427-05
10.7694/jldxyxb20130301
2012-10-31
国家自然科学基金资助课题 (81201048);河北省自然科学基金资助课题 (H2012401009)
王海涛 (1972-),男,山东省郓城县人,副教授,医学博士,主要从事应激性疾病方面的研究。
王海涛 (Tel:0315-3725754,E-mail:wht92725@163.com)
时间:2013-04-23 18:40
网络出版地址:http://www.cnki.net/kcms/detail/22.1342.R.20130423.1840.002.html

