pH对锡-银-铜三元合金共沉积的影响
张莹莹,石秀敏,高学朋,贺岩峰*
(长春工业大学化学工程学院,吉林 长春 130012)
传统电子封装工艺广泛使用Sn-Pb 合金镀层作为可焊性镀层。然而由于欧盟法律禁止在电子产品中使用铅及含铅化合物,因此,开发可与Sn-Pb 合金镀层性能相媲美的无铅可焊性镀层成为目前电子电镀领域的研究热点之一。已经开发出纯Sn 和Sn-Bi、Sn-Cu、Sn-Zn、Sn-Ag 等无铅可焊性镀层。Sn-Ag-Cu 三元合金由于具有锡晶须风险低、与无铅焊料相容性好、可焊性好和熔融温度较低等优点,以其作为电子电镀中的无铅可焊性镀层具有良好的发展前景[1-3]。
但锡、银和铜的电极电位[4]相差很大,需要添加合适的配位剂使其沉积电位接近,才能得到Sn-Ag-Cu合金镀层。目前应用于Sn-Ag-Cu 共沉积的配位体系有碘化钾-焦磷酸钾体系[5]、碘化钾-焦磷酸钾-三乙醇胺体系[3]和硫脲体系[2]等。本课题组采用N-羟乙基乙二胺三乙酸(HEDTA)作配位剂实现了Sn-Ag-Cu 的共沉积[6],对配位剂和辅助配位剂的作用机理,不同因素对Sn-Ag-Cu 三元合金共沉积的影响,镀层和镀液的性能等进行了研究[6-7]。
电沉积过程中,镀液pH 是一个重要参数,对电沉积过程和电沉积层性能都有显著影响。目前有关pH 对Sn-Ag-Cu 电沉积影响的研究尚较少。本文详细地研究了在以HEDTA 为配位剂的镀液中pH 对Sn-Ag-Cu 合金共沉积的影响,从电化学性能、表面形貌及结晶结构等方面探讨pH 的影响并确定适宜的pH 范围。
1 实验
1.1 试剂
HEDTA,日本东京化成工业株式会社(TCI)生产;甲基磺酸、甲基磺酸锡[Sn(CH3SO3)2]和甲基磺酸铜[Cu(CH3SO3)2],上海新阳半导体材料股份有限公司生产;烷基糖苷(APG)为上海发凯精细化工有限公司生产;其他试剂均为国药集团上海化学试剂公司的分析纯试剂。
1.2 基材
采用铁镍合金引线框架(FeNi42)作基体材料,纯度为99%的纯锡板作阳极。在自制的1 L 电镀槽中进行,采用IT6123 型高速高精度可编程电源(美国Itech Electronics)。
1.3 工艺流程
基体─除油─水洗─去氧化─水洗─电沉积─水洗─中和─水洗─吹干。
1.4 配方与工艺
1.4.1 除油
Na2CO330 g/L
Na3PO430 g/L
壬基酚聚氧乙烯醚 5 g/L
θ60 °C
t2 min
1.4.2 去氧化
硫酸 10%(体积分数)
H2O25%(体积分数)
θ常温
t30~60 s
1.4.3 中和
Na2CO33 g/L
θ50 °C
t1 min
1.4.4 电镀
Sn(CH3SO3)20.18 mol/L
Ag2O 0.0035 mol/L
Cu(CH3SO3)20.0012 mol/L
HEDTA 1.0 mol/L
硫脲 0.06 mol/L
APG 0.0013 mol/L
θ25 °C
Jk10 mA/cm2
1.5 性能检测
所有电化学测试采用传统的三电极体系,在CHI660D 型电化学工作站(上海辰华仪器公司)上进行,工作电极为直径2 mm 的铂盘电极,对电极为铂丝电极,参比电极为饱和甘汞电极(SCE)。铂盘电极依次用粒径为1.0、0.3 和0.05 µm 的三氧化二铝粉(美国CH Instruments)抛光,再用去离子水清洗。线性扫描曲线(LSV)的扫描速率为0.01 V/s。
采用日本电子JSM-5600 型扫描电子显微镜观察试样表面形貌(SEM);采用XD-2 型X 射线衍射仪(北京普析通用,XRD)观察试样的构相,Cu 靶,Kα 射线,步长0.02°。采用美国热电的ThermoiCAP 6300 型电感耦合等离子体发射光谱仪(ICP)测定镀层各组分的质量分数。采用德国Helmut Fischer GmbH 的XDLM-PCB X 射线能谱仪测定镀层厚度,算得一定时间内的沉积速率。
2 结果与讨论
2.1 电沉积过程
图1为pH 不同时Sn-Ag-Cu 合金共沉积的极化曲线。pH 为2.32 时,起始沉积电位为-0.8 V;pH 为3.22~4.81 时,随pH 增大,起始沉积电位从-0.87 V变为-0.98 V;pH 为4.81~7.74 时,随pH 增大,起始沉积电位的降低趋势变缓,电位从-0.98 V 变为-1.02 V。由此说明pH 对起始沉积电位有很大影响,但在达到一定pH 后,影响程度下降。
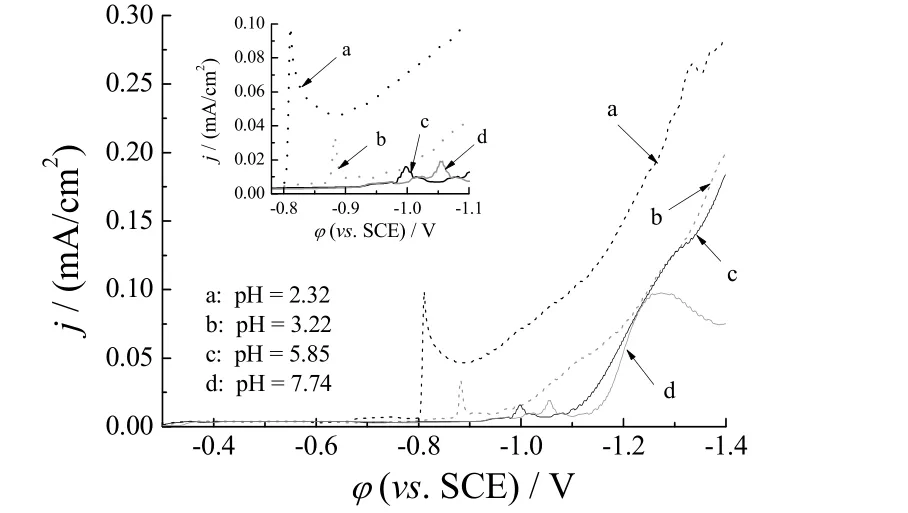
图1 镀液pH 不同时Sn-Ag-Cu 合金共沉积的极化曲线Figure 1 Polarization curves for codeposition of Sn-Ag-Cu alloy at different bath pHs
从电镀效果来看,在pH 为2.32 时得到的镀层结晶粗大且不平整;pH 增大至3.22 时,起始沉积电位负移至-0.87 V,电镀得到的镀层结晶细致平整。所以,起始沉积电位影响Sn-Ag-Cu 共沉积是显而易见的。这是因为起始沉积电位与配位剂对金属离子配位的程度相对应,从而影响Sn-Ag-Cu 的电沉积过程。
图2是恒定电位为-1.2 V 时,pH 对Sn-Ag-Cu 合金电沉积速率影响的曲线。pH 为5.00~6.00 时,沉积速率达到峰值,之后随pH 升高,沉积速率急剧下降。这可能是高pH 下电镀液的电导率降低所致。由图1可知,在相同电位下,pH 为2.32 时的电流密度明显高于其他pH。但从图2可知,pH 为2.32 时,其沉积速率与其他pH 下的沉积速率相似,这意味着在低pH 下Sn-Ag-Cu 的共沉积过程大量析氢。因此,在HEDTA电镀液中Sn-Ag-Cu 合金共沉积的适宜pH 范围是3.00~6.00,最适宜的是5.00~6.00。

图2 pH 对Sn-Ag-Cu 合金沉积速率的影响Figure 2 Effects of pH on deposition rate of Sn-Ag-Cu alloy
2.2 表面形貌
镀液pH 不同时,Sn-Ag-Cu 合金镀层的SEM 照片见图3。从图3a可以看出,pH 为2.32 时,镀层结晶粗大,晶粒之间有空隙,表面不平整。这可能是因为镀液pH 太低时析氢严重。pH 在3.22~5.85 范围内时,镀层的SEM 照片相似,结晶细致,表面平整(如图3b所示)。pH 在6.44~7.74 范围内时,镀层的SEM照片也相似(见图3c),镀层较为平整,结晶细致,但存在较多空隙和不规则晶粒。

图3 不同pH 下所得Sn-Ag-Cu 合金镀层的SEM 照片Figure 3 SEM images of Sn-Ag-Cu alloy coatings obtained at different pHs
2.3 构相
图4为pH 不同时所得Sn-Ag-Cu 三元合金镀层的XRD 谱图。从图4可知,不同pH 下制得的合金镀层其主要衍射峰均为Sn,Ag 和Cu 则是以金属间化合物Cu6Sn5、Ag3Sn 的形式存在。不存在游离态的Ag 和Cu,金属间化合物的存在可能与Sn、Ag 和Cu 的固相反应有关[8]。
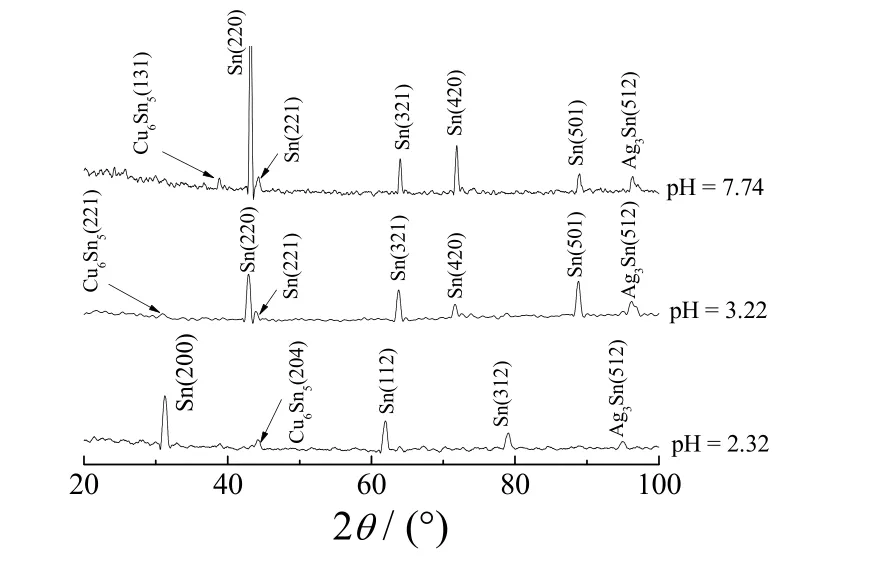
图4 不同pH 下所得Sn-Ag-Cu 合金镀层的XRD 谱图Figure 4 XRD spectra for Sn-Ag-Cu alloy coatings obtained at different pHs
Sn-Ag-Cu 合金镀层的相结构往往与块状的同类金属不同,pH 对镀层的结晶取向有较大影响。从图4可知,pH 为2.32 时,镀层的结晶取向以Sn(200)晶面占优;pH 为3.22 时,镀层的结晶取向则以Sn(220)晶面占优,且峰Sn(112)消失,出现了Sn(420)和Sn(501)衍射峰;pH 在3.22~7.74 范围内变化时,镀层的结晶取向基本没有发生变化,但峰Sn(321)和Sn(501)变弱。
2.4 元素组成
图5为pH 对镀层元素组成的影响。从图5可知,pH 从2.32 升至7.74 时,镀层中Sn 的质量分数由94.34%变成95.65%,Ag 的质量分数由4.27%变为2.90%,Cu的质量分数从1.39%变成1.45%;pH 低于5.00 时,镀层组成的波动较大;pH 在5.00~6.00 范围内变化时,所得镀层的元素组成为95.57%Sn-3.69%Ag-0.74%Cu,接近共晶合金的元素组成[Sn-(2.5%~4.2%)Ag-(0.7%~1.5%)Cu][5]。由此可见,最佳的pH 范围为5.00~6.00。
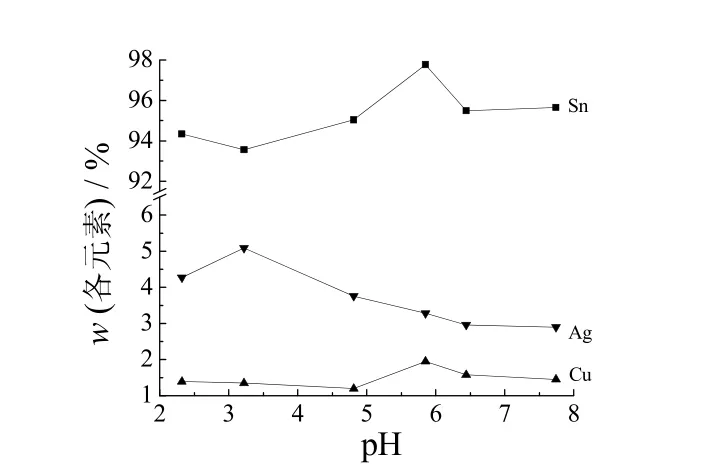
图5 pH 对Sn-Ag-Cu 合金镀层元素组成的影响Figure 5 Effect of pH on elemental composition of Sn-Ag-Cu alloy coating
3 结论
(1) pH 对HEDTA 体系Sn-Ag-Cu 合金的电沉积过程有显著影响,随pH 升高,起始沉积电位负移。
(2) pH 为2.32 时,镀层结晶粗大、不平整,晶粒之间有空隙;pH 为3.22~7.74 时,镀层结晶细致,表面平整;pH 为6.44~7.74 时,镀层存在不规则晶粒和空隙。
(3) pH 对Sn-Ag-Cu 合金镀层的结晶取向有显著影响,pH 为5.00~6.00 时所得Sn-Ag-Cu 镀层的元素组成与共晶合金接近。
(4) HEDTA 体系电沉积Sn-Ag-Cu 合金镀层的适宜pH 为3.00~6.00,最优范围是5.00~6.00。
[1]HAN C F,LIU Q,LVEY D G.Electrochemical composite deposition of Sn-Ag-Cu alloys [J].Materials Science and Engineering:B,2009,164 (3):172-179.
[2]JOSEPH S,PHATAK G J.Effect of additives on the co-electrodeposition of Sn-Ag-Cu lead-free solder composition [J].Materials Science and Engineering:B,2010,168 (1/3):219-223.
[3]ZHANG J Q,AN M Z,CHANG L M.Study of the electrochemical deposition of Sn-Ag-Cu alloy by cyclic voltammetry and chronoamperometry [J].Electrochimica Acta,2009,54 (10):2883-2889.
[4]SPEIGHT J G.Lange’s Handbook of Chemistry [M].16th ed.New York:McGraw-Hill,2005:1380-1392.
[5]QIN Y,WILCOX G D,LIU C Q.Electrodeposition and characterisation of Sn-Ag-Cu solder alloys for flip-chip interconnection [J]Electrochimica Acta,2010,56 (1):183-192.
[6]HE Y F,GAO X P,ZHANG Y Y,et al.Electrodeposition of Sn-Ag-Cu ternary alloy from HEDTA electrolytes [J].Surface and Coatings Technology,2012,206 (19/20):4310-4315.
[7]高学朋,张莹莹,贺岩峰.HEDTA对甲基磺酸盐镀液中锡-银-铜三元合金共沉积的影响[J].电镀与涂饰,2013,32 (3):5-8.
[8]FUJIWARA Y,ENOMOTO H.Intermetallic phase formation in electrochemical alloy deposition [J].Journal of Solid State Electrochemistry,2004,8 (3):167-173.

