黄连素灌胃对非酒精性脂肪性肝炎小鼠肠道菌群的影响*
曹 毅 徐雷鸣 潘 勤 王晓颖 沈 峰 陈光榆 范建高
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的疾病谱包括非酒精性单纯性脂肪肝(nonalcoholic simple fatty liver,NSFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)及其相关的肝硬化和肝细胞癌。近来有研究报道认为肠道菌群与肥胖和胰岛素敏感性相关,因考虑到NASH与胰岛素抵抗(IR)和肥胖等之间的联系,推测调节肠道菌群可能对NASH的发生发展存在一定的影响。由于黄连素通过肠道吸收量有限[1,2],故我们选用这一在临床中常用治疗腹泻的中成药来调节肠道菌群,以观察其对NASH动物的治疗作用,现将结果报道如下。
材料与方法
一、动物及模型制备 7~8周龄清洁级雄性Babl/c小鼠35只,体重18~22g,购于上海斯莱克公司。在SPF级动物房,将小鼠随机分7笼饲养,每笼5只。室温保持在22±2℃,相对湿度65%,按正常昼夜节律调节光照时间。在观察期内,动物自由饮水及进食。在普通饲料适应性饲养2周后,将动物随机分为对照组(n=10)、模型组(n=10)和干预组(n=15)。对照组动物予以普通饲料,模型组和干预组持续给予高脂饲料(10%猪油+2%胆固醇+88%基础饲料)。高脂饲料热量构成比为:52%碳水化合物,30%脂肪,18%蛋白质,总热卡为4.8 kcal/g。普通饲料热量构成比为:67%碳水化合物,10%脂肪,23%蛋白质,总热卡为3.6 kcal/g[3]。自高脂饮食第5周开始,给予给药组小鼠黄连素(美国Sigma公司,溶于蒸馏水中)200mg.kg-1.d-1灌胃;对照组和模型组每日给予等量蒸馏水,持续灌胃9周。高脂饮食喂养共13周后,动物隔夜禁食,次日经眼眶静脉取血,颈椎脱臼处死小鼠。血液经3000rpm离心15分钟,取血清冻存于-80℃冰箱。剖腹,取肝脏和盲肠内容物。部分肝脏用中性甲醛固定,制备石蜡切片,常规HE染色。其余组织置-80℃冰箱保存。
二、血生化指标的测定 使用生化分析仪测定各项生化指标。计算胰岛素抵抗指数(HOMA-IR),即空腹血浆胰岛素(μU/ml)×空腹血糖(mmol/L)/22.5。
三、肝组织病理学观察 采用NAS积分进行NAFLD活动度评分(0~8分):肝细胞脂肪变性程度为0~3分,肝小叶炎症为0~3分,肝细胞气球样变为0~2分。总分≥5分为NASH。评分方法参考文献进行[4]。
四、肝组织炎性因子mRNA水平检测 称量约50mg肝组织,使用Trizol试剂(日本TAKARA公司)提取肝组织总RNA,采用RT-PCR法转录成cDNA。按 50ng/μl的浓度经过荧光定量 PCR扩增,以RPL19为内参照,采用荧光定量PCR法检测CD14、TNF-α、IL-1和IL-6mRNA的相对表达水平。引物序列选自参考文献[5,6],由上海生工公司合成。
五、肠道菌群数量的检测 称量150~200mg盲肠内容物,使用粪便DNA抽提试剂盒(德国Qiagen公司)提取DNA。稀释至30ng/μl后,以通用细菌为内参照,采用荧光定量PCR法相对定量乳酸菌和双歧杆菌核酸。引物序列选自参考文献[7,8],由上海生工公司合成。
六、统计学处理 应用SPSS 17.0软件,所有数据均用±s 表示,采用单因素方差分析,然后用LSD法进行两两比较,P<0.05为有统计学差异,P<0.01为有显著性统计学差异。
结 果
一、小鼠一般情况及NAS积分 在实验过程中因灌胃导致动物死亡5只,在实验结束时,对照组存活小鼠9只,模型组10只,干预组11只。与对照组比,模型组动物体重增加(P<0.05),睾脂指数显著上升(P<0.01),NAS积分明显高于对照组(P<0.01);与模型组比,干预组动物体重下降(P<0.05),睾脂指数呈下降趋势,NAS积分明显减少(P<0.01)。而在饮食方面,三组摄入热卡量无统计学差异,考虑体重的变化与热量摄入量无关。根据NAFLD活动度评分判断,模型组有6只小鼠NASH模型造模成功,即从该6只小鼠采集样本检测以下指标,对照组及干预组各随机抽取6只小鼠进行检测,见表1。
二、肝功能和糖代谢情况 与对照组比,模型组AST和胰岛素升高(P 均<0.05),ALT、空腹血糖及HOMA-IR显著上升(P 均<0.01);与模型组比,干预组空腹血糖及胰岛素水平降低(P 均<0.05),ALT和HOMA-IR明显下降(P 均 <0.01),见表2。
表1 各组小鼠有关指标和NAS积分(±s)的比较

表1 各组小鼠有关指标和NAS积分(±s)的比较
与对照组比,①P<0.05,②P<0.01;与模型组比,③P<0.05,④P<0.01
只数 热量(kcal/d)体重(g)睾脂指数 NAS积分对照组 9 18.57±2.90 28.67±1.58 1.02±0.12 0.44±0.53模型组 10 18.70±2.48 30.70±1.83① 1.49±0.37② 4.60±1.07②干预组 11 18.33±4.89 28.64±2.25③ 1.28±0.34 2.73±0.90②④
三、肝组织炎症因子mRNA水平变化 与对照组比,模型组CD14mRNA水平呈升高趋势,IL-6、IL-1和TNF-α mRNA水平均显著升高(P 均<0.01);与模型组比,干预组 CD14、IL-6、IL-1和 TNF-α mRNA水平明显降低(P 均 <0.01),见表3。
表2 小鼠血清生化指标(±s)的比较

表2 小鼠血清生化指标(±s)的比较
与对照组比,①P<0.05,②P<0.01;与模型组比,③P<0.05,④P<0.01
只数 ALT(U/L)AST(U/L)FBG(mmol/L)胰岛素(pmol/L)HOMA-IR对照组 6 120.00±10.22 65.00±3.63 4.69±0.75 0.45±0.36 13.47±11.18模型组 6 346.00±142.01② 137.50±88.50① 7.56±1.38② 1.67±0.95① 76.67±38.12②干预组 6 175.00±20.14④ 88.50±11.18 6.13±0.89①③ 0.46±0.33③ 18.34±12.45④
表3 各组小鼠肝组织炎症因子mRNA水平(±s)的比较

表3 各组小鼠肝组织炎症因子mRNA水平(±s)的比较
与对照组比,①P<0.05,②P<0.01;与模型组比,③P<0.05,④P<0.01
只数 CD14 IL-1 IL-6 NAS积分对照组 6 0.261±0.032 0.421±0.083 0.258±0.084 1.336±0.156模型组 6 0.321±0.106 1.539±0.437② 0.580±0.083② 4.482±0.820②干预组 6 0.045±0.006②④ 0.243±0.067④ 0.249±0.046④ 0.553±0.553①④
四、肝组织学改变 在光镜下,对照组小鼠肝小叶结构完整,肝细胞在中央静脉周围呈放射状排列,肝细胞内未见脂滴(图1A);模型组肝细胞脂肪变,胞质内充满大量脂肪空泡,大小不一,细胞间有炎性细胞浸润,可见炎症坏死灶融合成片(图1B);干预组肝细胞脂肪变减轻,少见炎性细胞浸润,仍有气球样变(图1C)。
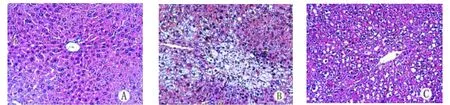
图1 各组小鼠肝组织学表现 (HE,200×)
五、盲肠内容物乳酸菌和双歧杆菌变化 与对照组比,模型组盲肠内容物中乳酸菌和双歧杆菌数量明显下降(P 均<0.05);与模型组比,干预组乳酸菌呈回升趋势,双歧杆菌则明显升高(P<0.01),见表4。
表4 小鼠盲肠内容物中乳酸菌和双歧杆菌数量(±s)的比较

表4 小鼠盲肠内容物中乳酸菌和双歧杆菌数量(±s)的比较
与对照组比,①P<0.05,②P<0.01;与模型组比较,③P<0.05,④P<0.01
只数 乳酸菌 双歧杆菌对照组 6 94.682±64.089 1.334±0.709模型组 6 0.010±0.006① 0.495±0.082①干预组 6 13.615±16.394 2.160±0.629①④
讨 论
本实验结果显示,模型组粪便中乳酸菌和双歧杆菌等益生菌数量显著低于对照组,而口服黄连素的干预组动物乳酸菌数量呈上升趋势,其双歧杆菌数甚至超过对照组。双歧杆菌和乳酸菌是人体肠道正常菌群中的优势菌种,与其他厌氧菌一起共同形成一个生物学屏障,构成肠道的定植抗力,阻止致病菌、条件致病菌的定制和入侵,减少肠源性内毒素的来源,降低血中内毒素水平。Cani等[9]发现由于双歧杆菌与紧密连接mRNA水平和蛋白表达有一定的联系,肠菌中双歧杆菌数量上升对改善体内肠通透性的效果明显。 乳酸菌可以抵制大肠杆菌引起的紧密连接蛋白重新分布,保护肠上皮的屏障功能[10,11]。高脂饮食饲养小鼠的肠菌中双歧杆菌和乳酸菌数量相对正常组下降,予抗生素后两菌回升的同时,伴随着代谢性内毒素血症的减轻[5]。
内毒素是革兰阴性细菌细胞壁外膜上的一种脂多糖(lipopolysaccharide,LPS)与微量蛋白质的复合物。LPS是内毒素活性成分,肠源性LPS结合脂多糖绑定蛋白,通过膜表面受体CD14,激活库普弗细胞并活化核因子,引起肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-1(interleukin,IL-1)、IL-6等促炎性因子活化。CD14是库普弗细胞膜表面的LPS受体,给CD14沉默小鼠注射LPS则不出现肝细胞脂肪变和炎症[12];TNF-α 由激活的库普弗细胞分泌,是参与NASH发生的关键介质,高脂喂养的ob/ob小鼠若同时予以抗-TNF-α 抗体,4周后可发现肝组织学改善,伴肝炎指标下降、IR减轻以及肝脏脂肪酸减少[13];IL-1介导肝内巨噬细胞调节肝内甘油三酯储存及肝内慢性炎症反应[14];IL-6激活T淋巴细胞,诱导B淋巴细胞分化,以旁分泌、自分泌方式作用于组织细胞,肝炎患者体内IL-6活性与肝细胞损伤程度呈正相关[15]。本实验模型组肝脏CD14、TNF-α、IL-1、IL-6mRNA水平升高,而给药后肝组织炎症性因子则明显降低,提示黄连素作用于肠道内容物后肠源性内毒素减少,这可能与干预组肝组织学炎症减轻以及肝酶下降密切相关。
我们的研究发现,经过13周高脂饮食喂养后,模型组小鼠体重明显高于对照组,口服黄连素的干预组体重减轻接近对照组。国外也有研究表明,肠道菌群数量和结构改变与肥胖的发生发展有一定的联系。Backhed等[16]研究显示肠道菌群可调节宿主能量储备,无菌小鼠经移植普通小鼠的肠菌后,在不改变饲料摄取和能量消耗的条件下体重明显增加。Kalliomaki等[17]对婴幼儿的研究随访发现,超重/肥胖组相比正常组出生婴儿,肠道双歧杆菌减少,提示肠道菌群异常的出现早于肥胖的发生。
IR是NASH发病的主要影响因素之一。它们不仅参与肝细胞脂肪变的发生,而且促进肝细胞损伤和炎症发展[12]。本研究结果显示,模型组空腹血糖、胰岛素及HOMA-IR均明显高于对照组和干预组,而干预组空腹血糖、胰岛素和HOMA-IR与对照组相比未见统计学差异。考虑肠道菌群经黄连素调整后IR得以改善。近来国外研究同样发现,肠源性内毒素血症参与IR的发病,高脂饮食饲养小鼠出现代谢性内毒素血症,促使体重增加和IR[18]。无菌小鼠相对普通小鼠糖耐量提高,胰岛素水平降低,并可抵抗高脂饮食导致的IR[19]。将普通小鼠的菌群植入无菌小鼠肠道后,在饮食不变情况下无菌小鼠可出现明显的IR[16]。通过抗生素调整高脂饮食饲养小鼠的肠道菌群,结果代谢性内毒素血症得以缓解,表现为糖耐量改善和体重减轻[5]。
本实验证实通过利用黄连素调控肠道菌群,对高脂饮食所致的肝小叶炎症及其主要诱发因素皆有一定的改善作用。因此,我们推测,对肠道菌群更深入研究,不仅可以更全面地阐明NASH发病机制,而且可能成为预防及治疗NASH的新方向。
[1]李艺,游雪甫,蒋建东.小檗碱的药动学研究进展.中国新药杂志,2009,17(9):733-738.
[2]Kong W,Wei J,Abidi P,et al.Berberine is a novel cholesterol-lowering drug working through a unique mechanism distinct from statins.Nat Med,2004,10(12):1344-1351.
[3]Xu ZJ,Fan JG,Ding XD,et al.Characterization of high-fat,diet-induced,non-alcoholic steatohepatitis with fibrosis in rats.Dig Dis Sci,2010,55(4):931-940.
[4]Brunt EM,Kleiner DE,Wilson LA,et al.Nonalcoholic fatty liver disease(NAFLD)activity score and the histopathologic diagnosis in NAFLD:distinct clinicopathologic meanings.Hepatology,2011,53(3):810-820.
[5]Cani PD,Bibiloni R,Knauf C,et al.Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet induced obesity and diabetes in mice.Diabetes,2008,57(6):1470-1481.
[6]Brun P,Castagliuolo I,Di Leo V,et al.Increased intestinal permeability in obese mice:new evidence in the pathogenesis of nonalcoholic steatohepatitis.Am J Physiol Gastrointest Liver Physiol,2007,292(2):G518-G525.
[7]Lu H,Wu Z,Xu W,et al.Intestinal microbiota was assessed in cirrhotic patients with hepatitis B virus infection.Microb Ecol,2011,61(3):693-703.
[8]Xie W,Gu D,Li J,et al.Effects and action mechanisms of berberine and rhizoma coptidis on gut microbes and obesity in high-fat diet-fed C57BL/6J mice.PloS one,2011,6(9):e24520.
[9]Cani PD,Possemiers S,Van de Wiele T,et al.Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability.Gut,2009,58(8):1091-1103.
[10]Parassol N,Freitas M,Thoreux K,et al.Lactobacillus casei DN-114 001 inhibits the increase in paracellular permeability of enteropathogenic Escherichia coli-infected T84 cells.Res Microbiol,2005,156(2):256-262.
[11]Johnson-Henry K,Donato K,Shen-Tu G,et al.Lactobacillus rhamnosus strain GG prevents enterohemorrhagic Escherichia coli O157:H7-induced changes in epithelial barrier function.Infect Immun,2008,76(4):1340-1348.
[12]Farrell GC.Signalling links in the liver: knitting SOCS with fat and inflammation.J Hepatol,2005,43(1):193-196.
[13]Iacono A,Raso GM,Canani RB,et al.Probiotics as an emerging therapeutic strategy to treat NAFLD: focus on molecular and biochemical mechanisms.J Nutr Biochem,2011,22(8):699-711.
[14]Stienstra R,Saudale F,Duval C,et al.Kupffer cells promote hepatic steatosis via interleukin-1 beta-dependent suppression of peroxisome proliferator-activated receptor alpha activity.Hepatology,2010,51(2):511-522.
[15]Yeo W,Mo FKF,Chan SL,et al.Hepatitis B viral load predicts survival of HCC patients undergoing systemic chemotherapy.Hepatology,2007,45(6):1382-1389.
[16]Backhed F,Ding H,Wang T,et al.The gut microbiota as an environmental factor that regulates fat storage.Science's STKE,2004,101(44):15718.
[17]Kalliomaki M,Collado MC,Salminen S,et al.Early differences in fecal microbiota composition in children may predict overweight.Am J Clin Nutr,2008,87(3):534-538.
[18]Cani PD,Amar J,Iglesias MA,et al.Metabolic endotoxemia initiates obesity and insulin resistance.Diabetes,2007,56(7):1761-1772.
[19]Rabot S,Membrez M,Bruneau A,et al.Germ-free C57BL/6J mice are resistant to high-fat-diet-induced insulin resistance and have altered cholesterol metabolism.FASEB J,2010,24(12):4948-4959.

