DNS比色法测定白芸豆中α-淀粉酶抑制剂活性的方法研究
赵 蓉, 李多伟, 任 涛, 林 芳, 林道发
(1.陕西省环境科学研究院,陕西西安 710061;2.西北大学生命科学学院,陕西西安 710069)
DNS比色法测定白芸豆中α-淀粉酶抑制剂活性的方法研究
赵 蓉1, 李多伟2*, 任 涛2, 林 芳2, 林道发2
(1.陕西省环境科学研究院,陕西西安 710061;2.西北大学生命科学学院,陕西西安 710069)
目的 建立DNS比色法测定从白芸豆中分离纯化α-淀粉酶抑制剂活性的方法。方法 通过测定波长、DNS的用量及显色反应时间的试验,确定研究方法。结果 确定最佳条件为检测波长470 nm,α-淀粉酶抑制剂与等量α-淀粉酶溶液37℃预温15 min,加入2%可溶性淀粉溶液,准确反应5 min。再加入DNS试剂2 mL,沸水浴5 min后流水冷却。该方法平均回收率为99.95%(n=9),精密度实验RSD=1.01%。结论 该方法具有简便、快捷、重复性良好等特点。适用于常规α-淀粉酶抑制剂的活性测定。
白芸豆;DNS比色法;α-淀粉酶抑制剂活性
α-淀粉酶抑制剂 (α-amylase inhibitor,简称 α-AI),属于糖苷水解酶。α-AI能抑制胃肠道内唾液、胰淀粉酶的活性,阻碍或延缓人体对食物中主要的碳水化合物的水解和消化,降低食物中淀粉糖类物质的分解吸收,起到降低血糖、血脂的作用,抑制血糖浓度的升高,从而有利于糖尿病患者的饮食治疗。对于肥胖患者,可减少糖向脂肪转化,延缓肠道排空,增加脂肪消耗以减轻体质量[1],国外已将α-淀粉酶抑制剂作为减肥保健食品进行应用[2-3]。因此,α-AI可以用来防治肥胖症、脂肪过多症、动脉硬化症、高血脂及糖尿病等疾病。α-AI还可以制成生物农药或作为抗虫基因,改良植物抗虫性[4]。在酶学研究方面,α-AI可作为探究 α-淀粉酶活性部位的分析工具,作为通过选择作用测定α-淀粉酶同工酶的反应物[5]。一些特异性抑制谷物萌发过程中合成的α-AI,也将会在烤制工业中发挥重要作用[6]。
Bowman(1945年)首次报道从白芸豆中获得α-AI[7],与其他种类相比具有高效价,因其含有特殊类型的抑制剂 (耐热和不耐热[8])而倍受关注。
现有的测定α-淀粉酶抑制剂活性的方法是将淀粉降解产物在特定条件下比色,测定其含有量,通过标准曲线计算酶活性。本实验在现有分析方法的基础上做出有效的改进,对DNS(3,5-二硝基水杨酸)比色法[9]测定白芸豆中分离纯化的α-淀粉酶抑制剂活性的操作条件进行系列试验确定。
1 材料
1.1 仪器 日本岛津UV-1700紫外可见光分光光度计;上海光地恒温水浴锅;上海实验仪器101A-3E烘箱;上海精密科学仪器BP211D电子天平。
1.2 药品与试剂 DNS试剂[10]:取3,5-二硝基水杨酸精确称取6.5 g溶解于400 mL蒸馏水中,在加入325 mL 2 mol/L的氢氧化钠、15 mL丙三醇,充分溶解后定容至1 000 mL,于棕色试剂瓶保存,冰箱中放置一周后使用。葡萄糖标准溶液 (3 mg/mL):取经105℃烘至恒定质量的分析纯葡萄糖精确称取300 mg,用水溶解并定容至100 mL,保存于4℃冰箱中,备用。2%可溶性淀粉溶液:精确称取可溶性淀粉2 g,用少量蒸馏水调匀,倾入已沸蒸馏水,在加热煮沸至透明,冷却后定容至100 mL。其他试剂有北京奥特星α-淀粉酶 (BR)。供试品α-AI,按以下方法从白芸豆中获得[11]:粉碎白芸豆,经过水浸提、硫酸铵盐析、透析、DEAE-纤维素柱层析、冷冻干燥,得到产品 (白色粉未状)[12]。
2 方法与结果
2.1 测定原理 α-AI能特异性地抑制α-淀粉酶,减少α-淀粉酶对淀粉的水解,使其淀粉降解产物还原糖减少,还原糖可与3,5-二硝基水杨酸共热被还原成棕红色的氨基化合物,显红棕色,在一定波长下有最大吸收峰,且在此波长下还原糖含有量与吸光值呈线性关系。对添加抑制剂前后生成还原糖的量进行定量测定,可从前后变化测得α-AI的活性。
2.2 测定条件的选择
2.2.1 吸收波长的测定 分别取0.5 mL葡萄糖标准液和蒸馏水,再加1 mL DNS试剂,沸水浴加热5 min,流水冷却,稀释适当倍数。分别在波长300~500 nm和400~600 nm范围内,对DNS试剂本身 (蒸馏水调零),未加α-AI的DNS显色反应液以及DNS显色反应液 (空白调零)的吸收光谱进行扫描,结果见图 1。比较可知,DNS试剂(λmax=370 nm)在显色反应测定波长处 (λmax=470 nm)无明显吸收,可排除本底干扰,故选λmax=470 nm为检测波长。

图1 吸收光谱Fig.1 Absorption spectrum
2.2.2 DNS试剂用量的选择 在系列已加入1.0 mL葡萄糖标准溶液的试管中,分别加入DNS显色剂0.5、1.0、1.5、2.0、2.5、3.0 mL,在沸水浴中加热5 min,迅速流水冷却,适当稀释。在相同条件下,不加葡萄糖标准溶液作空白,在470 nm波长下测定不同DNS显色剂用量下的吸收值。
从图2可以看出,随DNS显色剂用量的增加,反应液吸收值显著增大,但在2 mL以后,吸收值增加缓慢,且趋于平缓。故选2 mL作为DNS显色剂的用量。
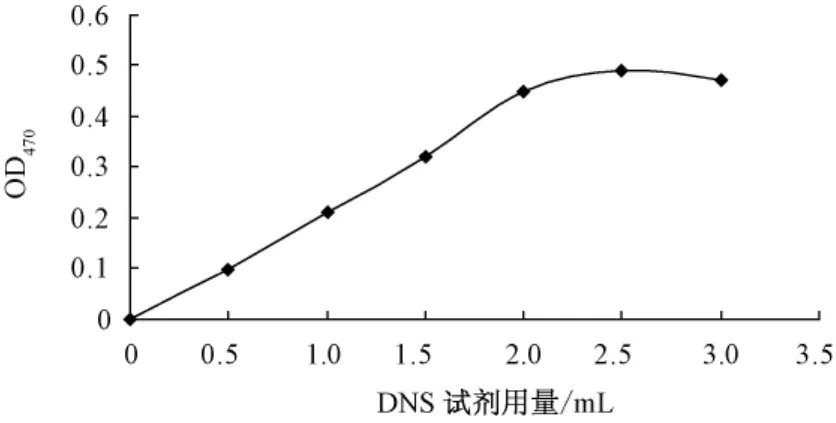
图2 DNS显色剂用量对吸收值的影响Fig.2 Impact of DNS reagent dosage on the absorption value
2.2.3 显色反应时间的选择 在系列加入葡萄糖标准液1.0 mL的试管中,分别加入DNS显色剂2 mL,在沸水浴中分别加热反应1、3、5、7、9、11 min后取出,迅速流水冷却,适当稀释。在相同条件下,以不加葡萄糖标准溶液作空白,在470 nm波长下测定不同加热反应时间下的吸收值。从图3可以看出,显色反应吸收值随时间的增加而增大,5 min后吸收值变化趋于平稳。故选5 min作为显色反应时间。
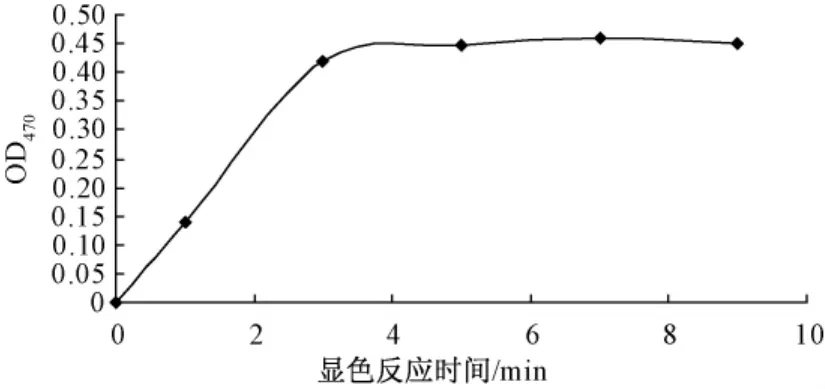
图3 显色反应时间对吸收值的影响Fig.3 Impact of reaction time on the absorption value
2.3 标准曲线的绘制 取6只试管依次加入0、0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准溶液,加入2 mL DNS显色剂后充分混匀,在沸水浴中反应5 min,迅速流水冷却,适当稀释。以管1做为空白对照在470 nm波长下测各管的吸收值。以葡萄糖标准溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线,得回归方程为:Y=0.817 4X+0.001 6,R2=0.999 6。表明在0.6~3 mg/mL范围内,葡萄糖浓度和相应的吸收值具有良好的线性关系。
2.4 稳定性试验 精密吸取质量浓度1.2 mg/mL葡萄糖标准溶液,加入DNS显色剂2 mL,于沸水浴中反应5 min,迅速流水冷却,分别放置30、60、90、120 min后在470 nm波长下测各管的吸收值,RSD=0.37%。图4表明该测定方法下120 min内稳定。
2.5 精密度测定 按1.2项中所述方法制备后,精密吸取样品溶液500 μL,依照2.4项的DNS比色法,连续6次重复测定,结果表明该方法测定α-AI精密度良好,RSD=1.01%(n=6)。
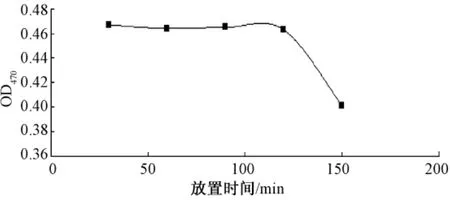
图4 放置时间对吸收值的影响Fig.4 Impact of standing time on the absorption value
2.6 重复性试验 取同批次样品,精密称取6份按照DNS比色法进行测定,结果表明该测定方法重复性良好,RSD=0.94%(n=6)。
2.7 加样回收率试验 精密量取已知量的样品溶液500 μL,共9份。分别准确加入葡萄糖标准溶液,按2.4项的DNS比色法测定,测得低、中、高3种加入量的回收率 (n=3)分别为100.3%、99.79%、99.84%;RSD分别为0.86%、0.68%、0.81%,平均回收率为99.95%(n=9)。
2.8 样品测定
2.8.1 样品管 精确吸取0.5 mL从白芸豆中提取的α-AI和0.5 mLα-淀粉酶溶液,充分混匀,在37℃水浴中反应15 min,然后加入1 mL 2%可溶性淀粉溶液,在37℃水浴中准确反应5 min。再加入2 mL DNS显色剂,在沸水浴中反应5 min,之后立即用流动自来水冷却 (终止反应),用蒸馏水稀释并定容至25 mL,再精确吸取1 mL用蒸馏水稀释定容至25 mL,在470 nm波长下测定吸收度,记为OD。
2.8.2 对照管 用蒸馏水代替α-AI,其他同上,记为 OD′。
2.8.3 空白管 用蒸馏水代替α-AI和α-淀粉酶溶液,其他同上。
α-淀粉酶抑制剂抑制率的计算公式为
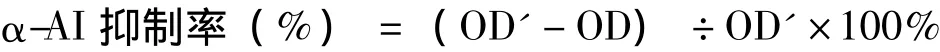
按照上述测定方法,对样品进行α-AI活性测定,结果见表1。

表1 样品测定(n=3)Tab.1 Sample determination(n=3)
3 结论
通过对显色反应的测定波长、DNS显色剂的用量以及显色反应的时间等一系列试验条件的研究,对白芸豆中分离纯化的α-淀粉酶抑制剂的DNS比色法测定,确定的最佳条件为:在470 nm波长下检测,α-AI与等量α-淀粉酶溶液在37℃反应15 min,加入2%可溶性淀粉溶液在准确反应5 min,再加入2 mL DNS显色剂沸水浴中显色5 min,迅速流水冷却。此方法精密度 RSD为1.01%,平均回收率为99.95%(n=9)。该方法具有简便、快捷、重复性好等特点,是对已有方法的完善和改进,试图探寻测定α-淀粉酶抑制剂活性的最佳方法和条件,适用于α-淀粉酶抑制剂活性的常规测定。该方法可作为筛选抗糖尿病药物的有效方法。
[1]张晓琦,杨明琰.白豆中α-淀粉酶抑制剂糖蛋白的提取纯化及降血糖活性研究[J].药物生物技术,2007,14(6):406-410.
[2]Sharma A,Gupta M N.Three phase partitioning as a large scale separation method for purification of a wheat geim bifunctional protease/amylase inhibitor[J].Process Biochem,2001,137(2):193-198.
[3]杨秀芳,吴明鑫.白豆中α-淀粉酶抑制剂的提取及其酶学性质的研究[J]. 应用化工,2007,36(8):145-147.
[4]赫卫清,潘一廷,唐益雄.淀粉酶抑制剂与抗虫的研究进展[J]. 生命的化学,2002,22(2):172-173.
[5]Uchida R,Nasu A,Tokutatk S,et al.New enzymatic synthesis of 6-modified maltooligosaccharides and their inhibitory activities for human α-amylases[J].Carbohydr Res,1998,307(1/2):69-76.
[6]Munck L,Mundy L,Vaag P.Characterization of enzyme ihibitiors in barley and their tentative role in malting and brewing[J].J Am Soc Brew Chem,1985,43(1):35-38.
[7]Gibbs F B,Alli I.Characterization of a purified α-amylase inhibitor from white kidney beans(Phaseolus vulgansis)[J].Food Research International,1998,31(3):217-225.
[8]Seltzer R D.Strymryer D H.Purification and characterization of esculentamin,a proteinaceous alpha-amylase inhibitor from the taro root,Colocasia esculenta[J].Food Biochem,1990,14(3):199-217.
[9]刘华珍,江宏磊.微生物生产的淀粉酶抑制剂研究Ⅱ发酵、分离与理化性质[J].中国抗生素,1994,99(10):12-16.
[10]赵 凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科技,2008,29(08):534-536.
[11]Ho F M,Whitaker J R.Purification and partial characterization of white kidney bean(Phaseolus vulgaris)alpha-amylase inhibitor from two experimental cultivars[J].J Food Biochem,1993,17(1):15-33.
[12]寇秀颖,徐 勇.白腰豆中α-淀粉酶抑制剂提取条件的优化[J]. 粮油加工,2010(11):131-132.
Activity determination of Phaseolus vulgaris α-amylase inhibitor by DNS colorimetry
ZHAO Rong1, LI Duo-wei2*, REN Tao2, LIN Fang2, LIN Dao-fa2
(1.Shaanxi Provincial Institute of Environmental Science,Xi'an 710069,China;2.Life Science College,Northwest University,Xi'an 710069,China)
Phaseolus vulgaris;DNS colorimetry;α-amylase inhibitor activity
R284. 1;Q55
A
1001-1528(2013)03-0573-04
10.3969/j.issn.1001-1528.2013.03.034
2012-04-17
赵 蓉 (1984—),女,硕士生,主要从事环境科学研究。Tel:13572059463,E-mail:zrjbw@hotmail.com
*通信作者:李多伟 (1959—),男,副教授,硕士生导师,主要从事天然动植物资源提取、分离与植物细胞工程研究。Tel:13227796618,E-mail:duoweili@163.com

