芎麻滴丸对血管性认知障碍过程中Cyto C、Bcl-2、Bax的影响
刘 琳,盖祥云,赵 瑛
(哈尔滨商业大学药学院,黑龙江 哈尔滨 150076)
血管性认知功能障碍是由血管因素导致或与之伴随的认知功能损害[1]。近年来,关于脑缺血后细胞凋亡的研究已成为许多学者关注的热点[2-3]。虽然许多研究都已证明海马神经元细胞凋亡与认知功能障碍的产生密切相关[4],但多是针对凋亡产生机制的研究,而关于血管性认知功能障碍产生的过程中海马神经元蛋白的动态变化规律的研究却鲜有报道。因此本实验着重研究和动态观察血管性认知功能障碍发病过程与海马神经元细胞蛋白Cyto C、Bcl-2、Bax之间的关系,为开发具有针对性的血管性认知功能障碍预防用药提供实验方法。为此,本实验选用双侧颈总动脉结扎法建立血管性认知功能障碍模型,通过免疫组化法检测脑组织蛋白细胞色素C(Cyto C)、Bcl-2、Bax的表达,探讨血管性认知功能障碍发病过程与细胞蛋白变化之间的关系。同时,使用改善大鼠学习记忆功能的药物——芎麻滴丸进行预防用药,研究其对蛋白Cyto C、Bcl-2、Bax表达的影响,探讨预防血管性认知功能障碍的作用机制。
1 材料
1.1 动物 成年健康SD雄性大鼠 (12~14周龄)120只,体质量为300 g~350 g,由黑龙江中医药大学实验动物中心提供。合格证号:SCXK(黑)2009-10。
1.2 药品及试剂 芎麻滴丸成型前液体:哈尔滨商业大学药学院实验室制备 (川芎总酚酸和天麻总苷质量分数≥37.77%)。浓缩制成相当于1 g/mL生药的溶液,保存于4℃冰箱备用。银杏叶片 (产品批号:0907081)购自广西亿康药业股份有限公司;Cyto C兔抗大鼠多克隆抗体 (产品批号:09K01)、Bcl-2兔抗大鼠多克隆抗体 (产品批号:09L02)均购自武汉博士德生物工程有限公司;Bax兔抗大鼠多克隆抗体 (产品批号:09X01)购自中杉金桥生物技术有限公司。
1.3 仪器 Leica RM2135石蜡切片机 (德国莱卡公司);光学显微镜 (日本Olympus BH-2型)。
2 方法
2.1 血管性认知功能障碍模型的建立 采用永久性结扎双侧颈总动脉的方法建立血管性认知功能障碍大鼠模型[5],将大鼠术前12 h禁食、4 h禁水。用10%水合氯醛腹腔注射麻醉,仰卧固定,颈前部去毛消毒后沿颈正中切开,分离暴露左、右侧颈总动脉,套以0号丝线双重结扎,逐层缝合。假手术组大鼠除不结扎颈总动脉,其余同手术组。术中大鼠肛温保持在36.5~37.5℃,术毕给予注射青霉素钠水溶液适量局部涂敷,放入笼中饲养,每日肌注青霉素钠2×105U/只,连用3 d,防治感染。
2.2 实验动物分组及给药 按照动物体质量及跳台成绩将动物随机分为模型组 (生理盐水10 mL/kg)、芎麻滴丸高剂量组 (相当于生药1.5 g/kg)、中剂量组 (相当于生药0.75 g/kg)、低剂量组 (相当于生药0.375 g/kg)[7]、银杏叶片组 (61.359 mg/kg),另加假手术组 (生理盐水10 mL/kg),共6组。每组动物又分别分为4个亚组,即造模后7 d、14 d、28 d、42 d(每组5只)。于模型建立前3 d开始灌胃给药,每天灌胃两次,给药持续至动物处死当天。
2.3 免疫组化法分别检测大鼠海马中Cyto C、Bcl-2及Bax的量 按兔二步法免疫组化试剂盒操作,3%H2O2孵育10 min,蒸馏水洗3次。抗原高压热修复2 min。冷却至室温,0.01 mol/L PBS洗5 min,共3次。分别滴加Cyto C兔抗大鼠多克隆抗体 (1∶50);Bcl-2兔抗大鼠多克隆抗体 (1∶50);Bax兔抗大鼠多克隆抗体 (1∶50),阴性对照采用PBS代替一抗,4℃过夜。PBS洗三次每次5 min。滴加生物素化二抗,20℃ ~37℃ 20 min。PBS洗3次每次5 min。DAB显色,苏木素复染,封片,镜检。免疫组化阳性细胞显色棕黄色或棕褐色,采用BI-2000免疫组化图像分析系统选择 (400×)10个不同视野进行平均光密度值分析,取其平均值为该样本平均光密度值。
2.5 统计方法 采用SPSS 17.0 For Windows统计软件中单因素方差分析进行多组间比较,计量结果均以平均值±标准差表示。P<0.05为有显著性差异;P<0.01为有非常显著性差异。
3 结果
3.1 各组大鼠脑组织海马区Cyto C阳性表达 Cyto C免疫组化结果显示,造模 7 d、14 d、28 d、42 d,模型组海马区大量神经元细胞胞浆中均出现黄色或者棕黄色表达,芎麻滴丸低、中、高剂量组和银杏叶片组均可不同程度地降低阳性表达。与假手术组相比,模型组动物在造模7 d、14 d、28 d、42 d时的Cyto C阳性表达显著升高 (P<0.01),且以14 d和28 d升高更为明显 (P<0.01);与模型组相比,芎麻滴丸低、中、高剂量组和银杏叶片组动物在造模7 d、14 d、28 d、芎麻滴丸低、中剂量组动物早造模42 d时的Cyto C阳性表达显著降低 (P<0.01),且以7 d时降低Cyto C表达作用更为明显 (P<0.01)。结果见表1。
表1 各组大鼠脑组织海马Cyto C阳性表达结果(,n=5)
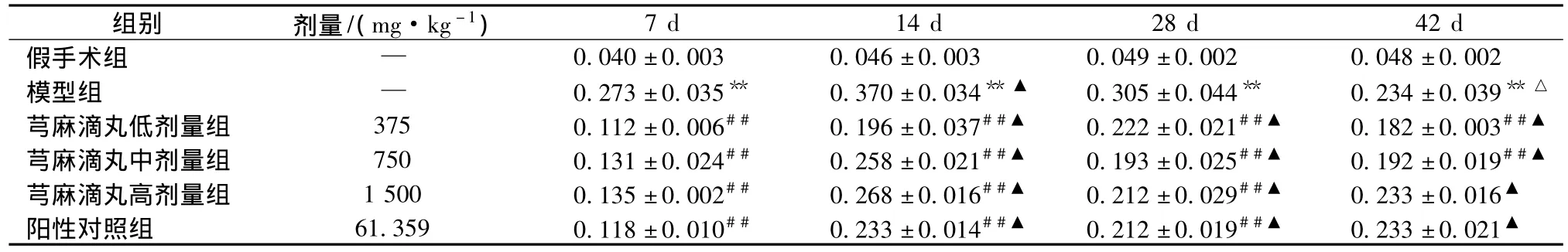
表1 各组大鼠脑组织海马Cyto C阳性表达结果(,n=5)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与7 d比较,▲P<0.05;与14 d比较,△P<0.05。
组别 剂量/(mg·kg-1)7 d 14 d 28 d 42 d假手术组 — 0.040±0.003 0.046±0.003 0.049±0.002 0.048±0.002模型组 — 0.273±0.035** 0.370±0.034**▲ 0.305±0.044** 0.234±0.039**△芎麻滴丸低剂量组 375 0.112±0.006## 0.196±0.037##▲ 0.222±0.021##▲ 0.182±0.003##▲芎麻滴丸中剂量组 750 0.131±0.024## 0.258±0.021##▲ 0.193±0.025##▲ 0.192±0.019##▲芎麻滴丸高剂量组 1500 0.135±0.002## 0.268±0.016##▲ 0.212±0.029##▲ 0.233±0.016▲阳性对照组 61.359 0.118±0.010## 0.233±0.014##▲ 0.212±0.019##▲ 0.233±0.021▲
3.2 各组大鼠脑组织海马区Bcl-2阳性表达 Cyto C免疫组化结果显示,假手术组大鼠脑组织海马内可见大量胞浆着色为黄色或者棕黄色的神经元细胞,在造模7 d、14 d、28 d、42 d时,模型组大鼠脑组织海马内可见少量胞浆着色为浅黄色的神经元细胞,芎麻滴丸低、中、高剂量组和银杏叶片组可不同程度的提高蛋白表达。与假手术组相比,7 d、14 d、28 d、42 d模型组Bcl-2阳性表达均显著降低(P<0.01);与模型组相比,7 d、14 d、28 d和42 d芎麻滴丸低剂量组Bcl-2阳性表达显著升高 (P<0.01),7 d、28 d和42 d芎麻滴丸中剂量组Bcl-2阳性表达显著升高(P<0.01),7 d、14 d银杏叶片组Bcl-2阳性表达显著升高(P<0.01)。结果见表2。
3.3 各组大鼠脑组织海马区Bax阳性表达 Bax免疫组化结果显示,假手术组大鼠脑组织海马区可见少量胞浆着色弱阳性的神经细胞。7 d、14 d、28 d、42 d模型组大鼠脑组织海马区均可见大量胞浆着色强阳性的神经细胞;与模型组相比,芎麻滴丸低、中、高剂量组和银杏叶片组均可不同程度的降低大鼠脑组织海马Bax阳性表达。与模型组相比,7 d、14 d、28 d、42 d芎麻滴丸低、中、高剂量组和银杏叶片组 阳性表达显著降低 (P<0.05,P<0.01)。结果见表3。
表2 各组大鼠脑组织海马Bcl-2阳性表达结果 (,n=5)
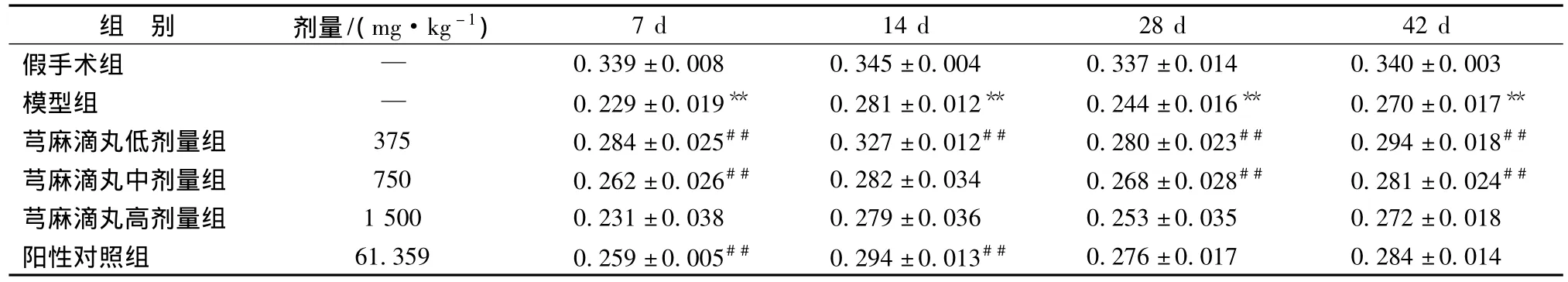
表2 各组大鼠脑组织海马Bcl-2阳性表达结果 (,n=5)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01。
组 别 剂量/(mg·kg-1)7 d 14 d 28 d 42 d假手术组 — 0.339±0.008 0.345±0.004 0.337±0.014 0.340±0.003模型组 — 0.229±0.019** 0.281±0.012** 0.244±0.016** 0.270±0.017**芎麻滴丸低剂量组 375 0.284±0.025## 0.327±0.012## 0.280±0.023## 0.294±0.018##芎麻滴丸中剂量组 750 0.262±0.026## 0.282±0.034 0.268±0.028## 0.281±0.024##芎麻滴丸高剂量组 1500 0.231±0.038 0.279±0.036 0.253±0.035 0.272±0.018阳性对照组 61.359 0.259±0.005## 0.294±0.013##0.276±0.017 0.284±0.014
表3 各组大鼠脑组织海马Bax阳性表达结果 (,n=5)
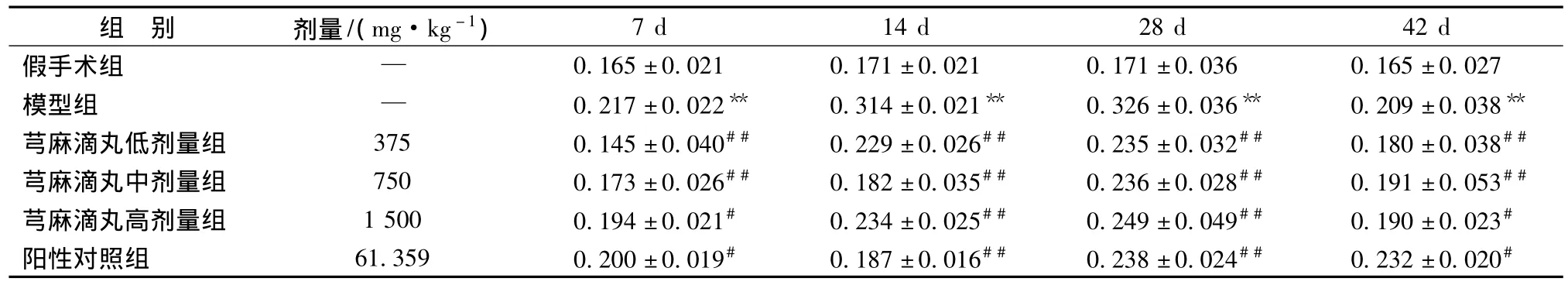
表3 各组大鼠脑组织海马Bax阳性表达结果 (,n=5)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组 别 剂量/(mg·kg-1)7 d 14 d 28 d 42 d假手术组 — 0.165±0.021 0.171±0.021 0.171±0.036 0.165±0.027模型组 — 0.217±0.022** 0.314±0.021** 0.326±0.036** 0.209±0.038**芎麻滴丸低剂量组 375 0.145±0.040## 0.229±0.026## 0.235±0.032## 0.180±0.038##芎麻滴丸中剂量组 750 0.173±0.026## 0.182±0.035## 0.236±0.028## 0.191±0.053##芎麻滴丸高剂量组 1500 0.194±0.021# 0.234±0.025## 0.249±0.049## 0.190±0.023#阳性对照组 61.359 0.200±0.019# 0.187±0.016## 0.238±0.024## 0.232±0.020#
与假手术组相比,7 d、14 d、28 d、42 d模型组阳性表达均显著降低 (P<0.01);与模型组相比,7 d芎麻滴丸低、中剂量组和银杏叶片组Bcl-2/Bax显著升高 (P<0.01);14 d、28 d芎麻滴丸低、中、高剂量组和银杏叶片组Bcl-2/Bax显著升高 (P<0.05,P<0.01);42 d芎麻滴丸低、中剂量组Bcl-2/Bax显著升高 (P<0.01)。结果见表4。
表4 各组大鼠脑组织海马Bcl-2/Bax结果 (,n=5)
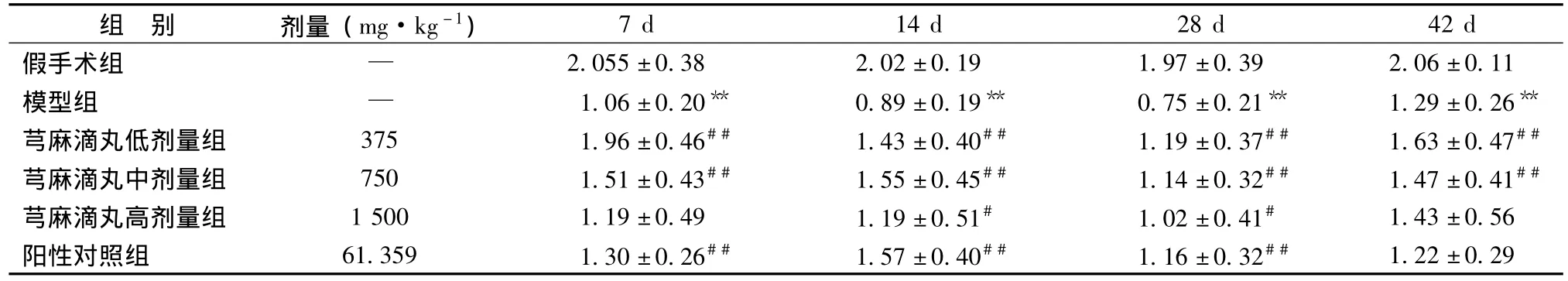
表4 各组大鼠脑组织海马Bcl-2/Bax结果 (,n=5)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组 别 剂量 (mg·kg-1)7 d 14 d 28 d 42 d假手术组 —2.055±0.38 2.02±0.19 1.97±0.39 2.06±0.11模型组 — 1.06±0.20** 0.89±0.19** 0.75±0.21** 1.29±0.26**芎麻滴丸低剂量组 375 1.96±0.46## 1.43±0.40## 1.19±0.37## 1.63±0.47##芎麻滴丸中剂量组 750 1.51±0.43## 1.55±0.45## 1.14±0.32## 1.47±0.41##芎麻滴丸高剂量组 1500 1.19±0.49 1.19±0.51# 1.02±0.41# 1.43±0.56阳性对照组 61.359 1.30±0.26## 1.57±0.40## 1.16±0.32##1.22±0.29
4 讨论
血管性认知功能障碍是由血管因素导致或与之伴随的认知功能损害,许多研究也表明慢性脑缺血血流减少是导致血管性认知功能障碍的重要因素。经过多年研究实践,双侧颈总动脉结扎法建立脑缺血动物模型已被广泛采用,已有研究表明模型制作6周后,大鼠出现明显的认知功能障碍[6]。本研究发现采用双侧颈总动脉结扎法法建立大鼠血管性认知功能障碍模型7 d后即出现了Cyto C高表达,Bcl-2/Bax降低。随着时间的延长,在模型建立后的14 d及28 d时,Cyto C高表达及Bcl-2/Bax降低达到高峰,此后有所恢复。本课题组同期研究表明:双侧颈总动脉结扎法法建立大鼠血管性认知功能障碍模型后28 d,海马神经元细胞凋亡也达到高峰,这一结果提示脑缺血会引起线粒体膜通透性增强,使得Cyto C释放,而造成海马CA1区神经元细胞发生凋亡。
芎麻滴丸是传统中药复方芎麻汤经现代工艺提取分离并纯化的中药复方现代制剂,前期实验表明芎麻滴丸可以改善双侧颈总动脉结扎法所致的大鼠学习记忆障碍[7]。而在预实验中发现,本实验所选用剂量为芎麻滴丸改善学习记忆障碍的最佳剂量,而中剂量为人体折算剂量。本研究发现,芎麻滴丸可以改善大鼠脑缺血后所产生的Cyto C高表达和Bcl-2/Bax降低,其中以芎麻滴丸低、中剂量效果最为显著,与前期研究结果一致[7]。结果提示芎麻滴丸可能是通过线粒体途径,抑制Cyto C,增加Bcl-2/Bax,抑制细胞凋亡而发挥预防血管性认知功能障碍的作用。
本研究结果同时还发现,芎麻滴丸及银杏叶片在抑制Cyto C高表达的过程中以7 d组效果最为显著,这很可能是由于药物无法拮抗脑缺血14 d时Cyto C的过度高表达而造成的,而在芎麻滴丸升高Bcl-2/Bax的过程中却不存在这样的现象。此结果提示芎麻滴丸可能还会通过其他途径增加血管性认知功能障碍大鼠脑内Bcl-2/Bax,从而抑制细胞凋亡而发挥预防作用。
[1]Hachinski V,Ladecola C,Petersen R C,et al.National institute of neurological disorders and stroke-canadian stroke network vascular cognitive impairment harmonization standard[J].Stroke,2006,37(9):2220-2241.
[2]Yoon K J,Lee Y T,Han T R.Mechanism of functional recovery after repetitive transcranial magnetic stimulation(rTMS)in the subacute cerebral ischemic rat model:neural plasticity or antiapoptosis?[J].Exp Brain Res,2011,214(4):549-556.
[3]Hu Y Y,Huang M,Dong X Q.Ginkgolide B reduces neuronal cell apoptosis in the hemorrhagic rat brain:Possible involvement of Toll-like receptor 4/nuclear factor-kappa B pathway[J].J Ethnopharmacol,2011,137(3):1462-1468.
[4]Lznerowicz A,Chudoba P,Kamińska D,et al.Duration of brain death and cold ischemia time,but not warm ischemia time,increases expression of genes associated with apoptosis in transplanted kidneys from deceased donors[J].Transplant Proc,2011,43(8):2887-2890.
[5]Melani A,Cipriani S,Corti F,et al.Effect of intravenous administration of dipyridamole in a rat model of chronic cerebral ischemia[J].Ann N Y Acad Sci,2010,1207:89-96.
[6]冉 鸿,陈康宁,黄河清.鼠颈动脉狭窄导致认知功能障碍机制的初步实验研究[C]//第九次全国神经病学学术大会论文汇编,2006:387.
[7]赵 瑛,滕厚军,祖 莹,等.芎麻滴丸对血管性痴呆大鼠学习记忆功能的影响[J].实用医学杂志,2009,25(5):708-711.

