葡萄糖与极化液对经皮冠状动脉介入治疗术后心肌损伤的随机对照研究
杨士伟, 周玉杰, 杨 清, 刘宇扬, 赵迎新, 张建维, 贾德安, 胡 宾, 韩红亚,马 茜, 高 霏, 申 华
(首都医科大学附属北京安贞医院心内科, 北京市心肺血管疾病研究所, 教育部心血管重构相关疾病重点实验室, 北京 100029)
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后心肌损伤是其常见的并发症之一,定义为心肌标记物肌酸磷酸激酶同工酶(creatine phosphokinase isoenzyme MB,CK-MB)和肌钙蛋白I(cardiac troponin I,cTnI)升高,具有较高的发生率[1-4]。多项长期随访研究表明,心肌标记物升高,显著增加患者PCI术后心血管事件的发生率[1-4]。如何减少PCI术后心肌损伤是近年来心血管研究领域极为关注的热点问题。1962年,Sodi-Pallares等首次提出,葡萄糖-胰岛素-钾(glucose-insulin-potassium,GIK)溶液,即极化液,可用于治疗缺血损伤的心肌细胞。1970年,Opie等进一步阐释了其心肌保护作用的机制,提出了代谢治疗的概念,即促进受损心肌细胞糖酵解并抑制对血清游离脂肪酸的摄取和利用。但随着近年来大量基础和临床研究,对GIK有了新的认识,整体而言人们对其疗效仍存在争议,机制也不明确[5,6]。我们的前期研究表明,高血糖和轻-中度低血糖同样增加急性心肌梗死患者的全因死亡率[7-9]。GIK导致严重低血糖的现象屡有报道[10-13],因此,我们认为这是导致GIK疗效不确切的可能机制之一。本研究拟比较葡萄糖与极化液对减少PCI术后心肌损伤的不同作用。
1 对象与方法
1.1 研究对象
选择2012年10月1日~2012年11月30日在北京安贞医院住院接受PCI治疗的冠心病患者100例,按照随机数字表分为试验组和对照组,每组各50例。入选标准:(1)经冠状动脉造影证实至少1支主要血管狭窄程度≥75%;(2)符合PCI治疗指征[14];(3)既往无糖尿病史,无降糖药物应用史;(4)PCI术前检测糖化血红蛋白(HbA1c)<6.5%,空腹血糖<7.0mmol/L[15];(5)病情平稳:意识清醒,血压控制在90~140/60~90mmHg(1mmHg=0.133kPa),窦性心律,且心率60~100次/min,纽约心功能分级Ⅰ~Ⅱ级;(6)患者本人及法定监护人同意接受PCI及应用葡萄糖或极化液治疗,并签署知情同意书。排除标准:(1)急性或亚急性心肌梗死患者;(2)PCI术前CK-MB或cTnI异常升高者;(3)合并其他严重器质性疾病如肿瘤、脏器功能不全、严重贫血或感染等;(4)合并有严重的精神疾病或意识障碍;(5)合并有影响抗凝治疗的疾病如出凝血障碍、活动性溃疡、半年内发生的缺血性或出血性脑卒中、外伤等。
1.2 方法
除常规检查外,所有患者PCI术前均需要进行血清心肌损伤标记物检测,包括CK-MB和cTnI。患者术前均接受指南推荐的冠心病二级预防药物治疗,包括阿司匹林、氯吡格雷、他汀、β-受体阻滞剂等。试验组患者在常规治疗的基础上于PCI术前2~4h给予10%葡萄糖溶液500ml静脉滴注至手术开始,对照组则于PCI术前2~4h给予GIK(10%葡萄糖溶液500ml+10%氯化钾溶液10ml+胰岛素12U)静脉滴注至手术开始。PCI术均由具有介入资质、经验丰富的高年资医师完成。所有患者PCI术前与术后即刻测定快速血糖水平,术后次日清晨空腹检测血糖、CK-MB和cTnI。记录患者的基线资料,如年龄、性别、伴随疾病及基线用药等;PCI手术前后心肌损伤标记物的变化。
1.3 统计学处理
使用SPSS17.0统计软件,正态分布计量资料以±s表示,非正态分布计量资料以中位数表示,计数资料以百分率表示,计量资料方差齐且正态分布者采用独立样本t检验,方差不齐或非正态分布者采用秩和检验,计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料
全部100例患者的平均年龄为(59.3±11.6)岁,男性55例(55.0%),既往明确诊断为陈旧性心肌梗死、陈旧性脑卒中、高血压及高脂血症的患者依次为16例(16.0%)、4例(4.0%)、61例(61.0%)和15例(15.0%)。入院后首次检测的低密度脂蛋白胆固醇为(2.9±0.9)mmol/L,空腹血糖(5.2±0.7)mmol/L,HbA1c(5.6±1.4)%,血肌酐(71.3±22.5)µmol/L,左室射血分数(60.5±10.7)%。所有患者中11.0%属于A型病变,49.0%属于B型病变,40.0%属于C型病变。试验组和对照组基线临床资料和冠状动脉造影结果差异均无统计学意义(均P>0.05;表1)。

表1 试验组和对照组基线临床资料及冠状动脉造影结果比较Table 1 Clinical baseline data and coronary angiography of all subjects (n=50)
2.2 试验组和对照组PCI手术前后血糖水平的比较
如表2所示,两组患者入院后首日空腹血糖水平与PCI术后次日空腹血糖水平差异均无统计学意义(P>0.05)。而试验组PCI术前快速血糖水平显著高于对照组[(11.9±3.6)vs(5.3±3.7)mmol/L,P<0.001];试验组PCI术后快速血糖水平亦显著高于对照组[(8.8±4.2)vs(5.1±3.9)mmol/L,P<0.001]。进一步分析,试验组患者PCI术前快速血糖水平无1例≤5.0mmol/L,而对照组患者有7例(14.0%)出现快速血糖水平≤5.0mmol/L,但两组患者均未出现严重低血糖现象(≤3.3mmol/L)。
表2 试验组和对照组PCI手术前后血糖水平的比较Table 2 Blood glucose level before and after PCI(n=50, mmol/L,±s)
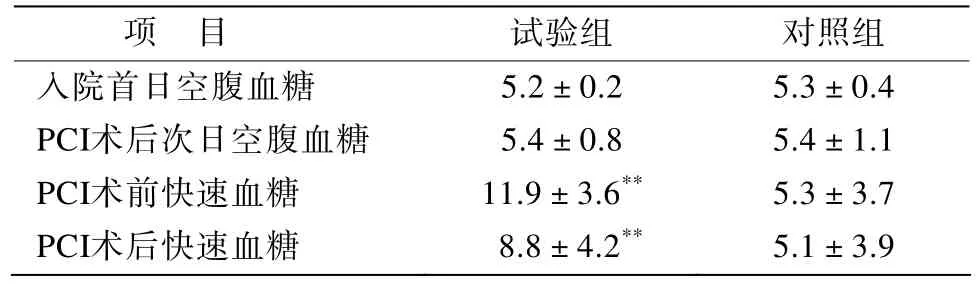
表2 试验组和对照组PCI手术前后血糖水平的比较Table 2 Blood glucose level before and after PCI(n=50, mmol/L,±s)
注: 与对照组比较, **P<0.001
项 目 试验组 对照组入院首日空腹血糖 5.2±0.2 5.3±0.4 PCI术后次日空腹血糖 5.4±0.8 5.4±1.1 PCI术前快速血糖 11.9±3.6** 5.3±3.7 PCI术后快速血糖 8.8±4.2** 5.1±3.9
2.3 试验组和对照组PCI手术前后CK-MB和cTnI水平的比较
两组患者PCI术前CK-MB及cTnI差异均无统计学意义(P>0.05)。与PCI术前比较,两组患者PCI术后CK-MB和cTnI均显著升高,且对照组CK-MB和cTnI升高幅度较试验组更显著(P<0.05;表3)。
表3 试验组和对照组PCI手术前后CK-MB及cTnI水平的比较Table 3 CK-MB and cTnI levels before and after PCI in two groups (n=50,±s)

表3 试验组和对照组PCI手术前后CK-MB及cTnI水平的比较Table 3 CK-MB and cTnI levels before and after PCI in two groups (n=50,±s)
注: 与术前比较, *P<0.05; 与试验组比较, #P<0.01
CK-MB(U/L) cTnI(µg/L)组别 术前 术后 术前 术后试验组 16.2±10.5 50.8±31.9* 0.03±0.02 0.21±0.19*对照组 17.4±12.8 62.4±37.3*# 0.03±0.02 0.29±0.16*#
2.4 试验组和对照组PCI术前、后CK-MB和cTnI升高比例的比较
与试验组比较,对照组PCI术后CK-MB和cTnI升高1~3倍者及>3倍者的比例更高(P<0.05;表4)。

表4 试验组和对照组PCI术后CK-MB和cTnI升高情况的比较Table 4 Increase of CK-MB and cTnI after PCI in two groups (n=50, %)
3 讨 论
无论CK-MB还是cTnI升高,均为PCI术后预后不良的预测指标,且升高幅度与预后显著相关[1-4]。Chen等[16]观察了2812例择期PCI患者,术后24h内每6h采血测定CK-MB。结果发现,术后CK-MB升高的患者与对照组相比住院期间的心血管事件的发生率相同,然而在平均随访4年后,CK-MB升高的患者心血管死亡病死率显著高于对照组。Abdelmeguid等[17]对8409例成功行PCI的急性心肌梗死患者进行了研究,平均随访(38±25)个月。结果发现,CK-MB升高>5倍组、1~5倍组及正常组病死率分别为8.9%,1.9%和1.2%。Fuchs等[18]研究了1129例接受PCI的患者,他们认为cTnI>0.45µg/L及cTnI和CK-MB同时增高均是住院期间并发症的独立预测因素。Gruberg等[19]认为PCI术后cTnI的增高是慢性肾功能衰竭患者长期(12个月)预后不良的独立预测因素,尤其是cTnI升高大于3倍的患者预后更为不佳。PCI术后心肌损伤可能通过以下机制影响心血管事件的发生率:(1)PCI造成心肌坏死,从而削弱左室功能,或形成疤痕,造成室内小折返环路,引起室性心律失常;(2)术后心肌损伤标记物的增高可能为弥漫性冠状动脉粥样硬化病变的标记物;(3)血管及心肌细胞本身在PCI术中易造成心肌损伤标记物释放的性质与后期事件有关。心肌细胞由于供血血管血流欠佳易造成损伤,或由于心肌细胞内部在分子水平对缺血状态不能进行良好调整是后期事件发生的可能原因。
1962年,Sodi-pallares等首次提出GIK可用于治疗缺血损伤的心肌细胞。1970年,Opie等进一步阐释了其心肌保护作用的机制,提出了代谢治疗的概念,即促进受损心肌细胞糖酵解并抑制对血清游离脂肪酸的摄取和利用。早期应用GIK主要是基于以下两个理论基础:(1)给缺血心肌提供更多能量,并用胰岛素促进心肌细胞摄取和利用葡萄糖,最终促进缺血心肌的功能恢复;(2)胰岛素刺激心肌细胞Na+- K+-ATP酶,促进心肌细胞摄取K+,从而稳定细胞膜的极化状态,减少心律失常的发生[5,6]。但随着近年来大量基础和临床研究,对GIK有了新的认识,整体而言人们对其疗效仍存在争议,机制也不明确。
冠心病患者无论是否合并糖尿病,入院时血糖升高均是心血管预后的强、独立预测因子,低血糖的危害尚存在争议[20]。Svensson等[21]发现,入院时空腹血糖≤3.0mmol/L的不稳定型心绞痛和非Q波心肌梗死患者2年死亡率显著高于血糖正常的患者,但低血糖与预后之间的因果关系不显著。Kosiborod等[22]证明了自发性低血糖(<3.3mmol/L)与不良预后之间存在显著的因果关系,但对于医源性低血糖患者,这种关系并不明确。Goyal等[23]发现只有入院前存在的低血糖(≤3.8mmol/L)可以预测30d的死亡率,而入院后发生的低血糖则不能预测死亡。实际上,符合上述研究中定义的低血糖标准(<3.0~3.8mmol/L)的冠心病患者并不常见,因此血糖降低在临床实践中并未受到充分关注。北京老年心肌梗死治疗现状与预后研究(Beijing Elderly Acute Myocardial Infarction Study,BEAMIS)是由我们主持完成的一项多中心注册研究[7-9]。结果表明,不仅血糖升高(空腹血糖≥7.1mmol/L)的患者近期和远期死亡率增加,血糖轻-中度降低(空腹血糖≤5.0mmol/L)的患者死亡率同样升高,而空腹血糖5.1~7.0mmol/L的患者死亡率最低,空腹血糖与死亡危险之间的关系呈U型曲线。这一现象不仅存在于非糖尿病患者,也存在于糖尿病患者,不同治疗方式(单纯药物治疗、介入治疗和冠状动脉旁路移植术)的患者同样表现出这一规律。该研究结果提示我们,不仅需要关注高血糖,也要关注低血糖,甚至是轻-中度血糖下降(≤5.0mmol/L)也有可能导致预后恶化。GIK导致严重低血糖的现象屡有报道[10-13]。本研究表明,应用GIK虽然未导致严重低血糖,但有14.0%的对照组患者血糖水平≤5.0mmol/L,而单纯应用葡萄糖的患者未出现类似现象。因此我们提出如下假说:低血糖是导致GIK疗效不确切的可能机制之一。由于本研究样本量较小,结果可能有一定的偏倚等不足,尚不能得出确切结论,有待大规模随机对照试验进一步证实。
[1]Babu GG, Walker JM, Yellon DM,et al.Peri-procedural myocardial injury during percutaneous coronary intervention:an important target for cardioprotection[J].Eur Heart J, 2011,32(1): 23-31.
[2]Mather AN, Fairbairn TA, Artis NJ,et al.Relationship of cardiac biomarkers and reversible and irreversible myocardial injury following acute myocardial infarction as determined by cardiovascular magnetic resonance[J].Int J Cardiol, 2011.[Epub ahead of print].
[3]Cram P, House JA, Messenger JC,et al.Percutaneous coronary intervention outcomes in US hospitals with varying structural characteristics: analysis of the NCDR(R)[J].Am Heart J, 2012, 163(2): 222-9.e1.
[4]Van Gaal WJ, Banning AP.Diagnosing peri-procedural myocardial injury following percutaneous coronary intervention: replacing confusion with consensus[J].Heart,2012, 98(20): 1473-1475.
[5]Selker HP, Beshansky JR, Sheehan PR,et al.Out-of-hospital administration of intravenous glucose-insulin-potassium in patients with suspected acute coronary syndromes: the IMMEDIATE randomized controlled trial[J].JAMA, 2012,307(18): 1925-1933.
[6]Carvalho G, Pelletier P, Albacker T,et al.Cardioprotective effects of glucose and insulin administration while maintaining normoglycemia (GIN therapy) in patients undergoing coronary artery bypass grafting[J].J Clin Endocrinol Metab, 2011, 96(5): 1469-1477.
[7]Yang SW, Zhou YJ, Hu DY,et al.Association between admission hypoglycaemia and in-hospital and 3-year mortality in older patients with acute myocardial infarction[J].Heart, 2010, 96(18): 1444-1450.
[8]Yang SW, Zhou YJ, Nie XM,et al.Effect of abnormal fasting plasma glucose level on all-cause mortality in older patients with acute myocardial infarction: results from the Beijing Elderly Acute Myocardial Infarction Study(BEAMIS)[J].Mayo Clin Proc, 2011, 86(2): 94-104.
[9]Yang SW, Zhou YJ, Liu YY,et al.Influence of abnormal fasting plasma glucose on left ventricular function in older patients with acute myocardial infarction[J].Angiology, 2012,63(4): 266-274.
[10]Sands MJ Jr, McDonough MT, Neubauer SJ,et al.Hypoglycemia complicating the use of solution of glucose,insulin and potassium[J].Chest, 1975, 67(3): 363-365.
[11]Mantle JA.Regular insulin dose in GIK formulation for acute myocardial infarction therapy[J].Am Heart J, 1982,103(4 Pt 1): 572.
[12]Lipton JA, Can A, Akoudad S,et al.The role of insulin therapy and glucose normalisation in patients with acute coronary syndrome[J].Neth Heart J, 2011, 19(2): 79-84.
[13]Koehler LS, Brown DR, Norfleet EA.Glucose-insulinpotassium solution and hypoglycemia[J].JAMA, 1978,239(26): 2757-2758.
[14]Patel MR, Dehmer GJ, Hirshfeld JW,etal.ACCF/SCAI/STS/AATS/AHA/ASNC/HFSA/SCCT 2012 appropriate use criteria for coronary revascularization focused update: a report of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, Society for Cardiovascular Angiography and Interventions, Society of Thoracic Surgeons, American Association for Thoracic Surgery, American Heart Association, American Society of Nuclear Cardiology, and the Society of Cardiovascular Computed Tomography[J].J Am Coll Cardiol, 2012, 59(9): 857-881.
[15]Introduction: The American Diabetes Association's (ADA)evidence-based practice guidelines, standards, and related recommendations and documents for diabetes care[J].Diabetes Care, 2012, 35 (Suppl 1): S1-2.
[16]Chen SA, Tsang WP, Hsia CP,et al.Reappraisal of intermediate-term follow-up of radiofrequency ablation of accessory atrioventricular pathways for treatment of Wolff-Parkinson-White syndrome[J].Jpn Heart J, 1992,33(6): 755-769.
[17]Abdelmeguid AE, Ellis SG, Sapp SK,et al.Defining the appropriate threshold of creatine kinase elevation after percutaneous coronary interventions[J].Am Heart J, 1996, 131(6): 1097-1105.
[18]Fuchs S, Kornowski R, Mehran R,et al.Prognostic value of cardiac troponin-I levels following catheter-based coronary interventions[J].Am J Cardiol, 2000, 85(9): 1077-1082.
[19]Gruberg L, Fuchs S, Waksman R,et al.Prognostic value of cardiac troponin I elevation after percutaneous coronary intervention in patients with chronic renal insufficiency: a 12-month outcome analysis[J].Catheter Cardiovasc Interv,2002, 55(2): 174-179.
[20]Deedwania P, Kosiborod M, Barrett E,et al.Hyperglycemia and acute coronary syndrome: a scientific statement from the American Heart Association Diabetes Committee of the Council on Nutrition, Physical Activity, and Metabolism[J].Circulation, 2008, 117(12): 1610-1619.
[21]Svensson AM, McGuire DK, Abrahamsson P,et al.Association between hyper- and hypoglycaemia and 2 year all-cause mortality risk in diabetic patients with acute coronary events[J].Eur Heart J, 2005, 26(13): 1255-1261.
[22]Kosiborod M, Inzucchi SE, Goyal A,et al.Relationship between spontaneous and iatrogenic hypoglycemia and mortality in patients hospitalized with acute myocardial infarction[J].JAMA, 2009, 301(15): 1556-1564.
[23]Goyal A, Mehta SR, Diaz R,et al.Differential clinical outcomes associated with hypoglycemia and hyperglycemia in acute myocardial infarction[J].Circulation, 2009, 120(24):2429-2437.

