老年人甲状腺功能异常与心血管疾病
高 莹, 郭晓蕙
(北京大学第一医院内分泌科, 北京 100034)
甲状腺疾病按甲状腺功能可分为甲状腺功能亢进症(简称甲亢)和甲状腺功能减退症(简称甲减)。随着促甲状腺激素(thyrotropin,thyroid stimulating hormone,TSH)检测方法的进步,亚临床甲状腺功能异常日益得到重视。亚临床甲亢是指血清TSH水平低于正常参考值的下限,而甲状腺素(thyroxine,T4)和三碘甲状腺原氨酸(triiodothyronine,T3)浓度在正常范围内;亚临床甲减指TSH水平超过正常参考值的上限,而游离甲状腺素(free thyroxine,FT4)尚在正常范围内。美国一项研究显示,在大于65岁的老年人中,0.1%患甲亢、1.5%患亚临床甲亢、15.0%患亚临床甲减、1.6%患临床甲减[1],因此,甲状腺功能异常在老年人中并不少见,但我国目前尚缺乏有关老年人甲状腺功能异常的大规模普查数据[2]。甲状腺激素既可直接影响心脏的结构和功能,也可通过改变血流动力学、交感神经系统等间接影响心血管系统。目前我国老龄化进入快速发展阶段,本文简要回顾了在老年人这一特殊人群中甲状腺功能对心血管系统的影响。
1 老年人的甲状腺功能
美国第三次全国健康营养状况普查显示,健康人群血清TSH水平的参考范围是0.45~4.12mIU/L,其几何平均值是1.4mIU/L[3],呈偏态分布。健康老人甲状腺组织萎缩,因而甲状腺激素合成减少;但研究显示在70~79岁的老人中,T4的半衰期增加至9.3d,因此其血清浓度不受影响[4];同时由于组织中5'-脱碘酶活性降低,T4在外周组织中脱碘产生T3减少,反T3增加,T3的水平可能明显下降;而随年龄增长,TSH的分布曲线向高水平的方向偏移[5]。
2 甲亢对心血管系统的影响
2.1 临床甲亢
国内外资料显示,老年人甲亢的患病率约为0.5%~3.0%,60岁以上患者占甲亢总人数的10.0%~20.0%。在病因中,Graves病和毒性结节性甲状腺肿(toxic multinodular goiter,TMNG)大约各占50.0%;此外,老年人因患其他疾病,服用含碘药物如胺碘酮的机会增多,因此碘甲亢(iodine-induced thyrotoxicosis)的发生率也较高。
由于组织对甲状腺激素的反应能力减弱以及衰老等因素的影响,老年人的甲亢起病较隐匿,常缺乏典型表现。患者较少出现甲状腺相关眼病和高代谢症候群,甲状腺常无肿大,而纳差、消耗性表现、心房纤颤(房颤)或充血性心力衰竭(congestive heart failure,CHF)等较常见。
甲亢可导致无心脏结构性异常的患者出现劳力性呼吸困难和CHF[6,7]。其可能与应激时心脏储备功能不足以及甲亢时心肌肥厚(左室质量指数增加)导致心脏收缩异常等因素有关,后者在治疗甲亢后可恢复正常。甲亢可引起“心肌顿抑”(myocardial stunning),导致室壁节段性运动不良,急性左室功能异常,其表现类似冠心病,经治疗后可很快逆转[8]。文献报道约20%的甲亢患者可发生心绞痛,原因可能是甲亢时氧化型低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)产生氧自由基增加,导致血管内皮功能损伤,此外可能与冠状动脉痉挛有关[9]。临床中如发现以下线索时需考虑老年甲亢性心脏病的可能:(1)阵发性或持续性房颤、心房扑动、心室率快而洋地黄制剂无效;(2)对洋地黄类和利尿剂效果不显著的心力衰竭(简称心衰);(3)心绞痛经扩张冠状动脉的药物治疗后未见好转,且血脂正常或偏低者;(4)无其他原因可解释的心脏扩大或心电图异常;(5)不明原因的进行性消瘦、腹泻、焦虑、抑郁和失眠[10]。
甲亢患者的心电图常表现为复极异常,心房、心室的额外收缩,窦性心动过速和房颤,也可表现为心肌缺血、左室高电压和不同程度的心脏阻滞。研究显示房颤的患病率随年龄增长而增加,年龄>70岁的老年甲亢患者中15%患有房颤;但在新发房颤的病例中,仅小于1%的患者患甲亢[11]。因单纯治疗甲亢就可导致心脏复律,所以推荐对于房颤患者常规筛查甲状腺功能,且建议在采用有创性电转复前先纠正甲亢[12]。虽然有报道甲亢引起的房颤可能引起系统性栓塞,且独立于其他栓塞危险因素之外,但尚未得到充分证实[6,11]。
不同病因的甲亢患者其心血管疾病的表现存在差异,TMNG患者的心血管风险高于Graves病患者。房颤、心房扩大和CHF等表现在60岁以上的TMNG患者中常见,特别是既往有心脏疾患者。而Graves病患者常出现与自身免疫相关的心脏并发症,例如心脏瓣膜受累(二尖瓣黏液样退行性变)、肺动脉高压和特异性心肌病(扩张性心肌病)[13]。
与甲亢相关的大部分心血管系统表现经治疗甲亢后是可逆的。一些长期随访研究的结果提示老年甲亢患者心、脑血管疾病的死亡率增加,现认为其可能与室上性心律失常的发生率增高有关[14]。
2.2 亚临床甲亢
2010年公布的《中国十城市甲状腺疾病流行病学调查》结果显示亚临床甲亢的患病率为2.6%。其自然病程变化较大,一年中进展至临床甲亢的发生率为1.5%~13.0%。国内对85例亚临床甲亢患者随访1~2年,2.4%进展为临床甲亢,而63.5%恢复正常[15]。TSH<0.1mIU/L的亚临床甲亢患者较TSH在0.1~0.4mIU/L之间的患者更易进展至临床甲亢。老年亚临床甲亢最主要的病因是TMNG。Graves病导致的亚临床甲亢患者较TMNG更易出现自发缓解。
亚临床甲亢的患者亦可出现心脏结构和功能的改变[4],包括心脏收缩增加、左室舒张充盈受损、运动时收缩功能受损、左室质量指数增加、室间隔厚度增加、左室后壁厚度增加、大小动脉弹性下降、QT间期延长;临床表现为心率和房性早搏频率增加、房颤的发病率增加、血清总胆固醇(total cholesterol,TC)和LDL-C的水平下降、活动能力下降、心血管疾病的死亡率增加。研究表明,房颤的发生率与血清TSH浓度显著相关,年龄大于60岁而血清TSH水平<0.1mIU/L的患者发生房颤的危险性较正常对照组升高3倍之多[16]。年龄在65岁以上的老人中,亚临床甲亢患者与甲状腺功能正常者相比,发生房颤的危险性是1.98(95%CI 1.29~3.03)[1]。亚临床甲亢患者心脏L型Ca通道的数量增加了3倍,可能与其房颤发生率增加有关[17]。有关亚临床甲亢死亡率的报道结论并不一致。有研究表明TSH<0.5mIU/L的60岁以上老人在随访1,2,5年时全因死亡率和心血管死亡率增加,但随访10年时并未发现统计学意义[18]。未治疗的亚临床甲亢患者从85岁随访到89岁时,心血管和全因死亡率均增加[19]。Haentjens等[20]提出亚临床甲亢全因死亡率的风险在超过60岁后随年龄而递增,老年男性为著。而近来几个研究表明亚临床甲亢与冠心病事件的危险性或死亡无关[1,21]。Cappola等[1]进行的心血管健康研究中,共入选了3233例年龄大于65岁的老人,其中亚临床甲亢占1.5%,研究显示亚临床甲亢的患者与甲状腺功能正常者相比,全因死亡率的风险比为1.08(95% CI 0.72~1.62)。Walsh等[21]报告监测了2108例受访者的冰冻血样本中的甲状腺激素水平,在剔除基线水平患冠心病的患者后,未发现亚临床甲亢组与心血管死亡率的风险增加相关(风险比1.0,95% CI 0.2~4.3)[21]。
3 治 疗
3.1 甲亢的治疗
目前,国内外治疗甲亢的方法主要有抗甲状腺药物、手术和放射性碘(131Ⅰ)治疗。老年人应用抗甲状腺药物治疗甲亢,发生药物不良反应的风险增高[22],且甲亢复发率在50%左右,而131Ⅰ治疗甲亢的复发率仅为1%~4%。考虑到老年甲亢患者合并症较多,131Ⅰ治疗疗效确切而且可避免手术风险,因此,老年甲亢患者优先选择131Ⅰ治疗[1]。131Ⅰ治疗后,甲状腺激素大量释放入血液可能加重心脏疾患,甚至导致“甲亢危象”,因此,要告知患者,在131Ⅰ治疗后一旦出现高热、大汗、心动过速(>140次/min),烦躁和焦虑,严重的呕吐或腹泻时,需立即到医院就诊。美国甲状腺协会(American Thyroid Association,ATA)的最新指南推荐:对于严重甲亢患者(症状重或FT4在正常上限2~3倍以上,老年人,患有严重合并症,包括心血管并发症例如房颤、心衰或肺动脉高压,或肾衰竭、感染、创伤、控制不佳的糖尿病以及脑血管或肺部疾病等),建议先应用抗甲状腺药物甲巯咪唑(methimazole,MMI)控制Graves病[23],待病情稳定后根据临床情况再进行131Ⅰ治疗。若情况紧急需立即控制甲亢时,在应用初始剂量的抗甲状腺药物丙硫氧嘧啶(propylthiouracil,PTU)或MMI后可应用复方碘溶液(Lugol液)阻断甲状腺激素的释放。对于心脏症状不稳定的患者,可静脉应用β受体阻滞剂快速降低心率。利尿剂仍是CHF的主要治疗。在甲亢导致的CHF中可应用地高辛,但应注意甲亢患者地高辛的治疗剂量和中毒剂量很接近,加之老年患者往往肾小球滤过率下降,易出现洋地黄中毒。
甲亢经治疗后缓解,心悸、快速型心律失常等常可好转。甲状腺激素水平正常后,房颤的自发转复率很高。大多数患者在甲状腺功能恢复正常的3周内发生转复。老年患者如果在甲状腺功能正常后的4个月仍然存在房颤,或在功能正常前房颤已超过13个月,自发转复率低。甲状腺功能恢复正常后超过4个月仍有房颤的患者可行心脏复律治疗。
已完成的随机对照研究尚未阐明与甲亢相关的房颤是否需抗凝治疗。推荐在合并高血压、CHF、左房扩大或左室功能障碍或其他增加系统性栓塞危险的情况下,或长期房颤的患者中予以抗凝治疗。而对于年轻、无合并症或房颤持续时间短的患者可能不需要抗凝治疗[6]。抗凝治疗时,需依国际标准化比值(international normalized ratio,INR)调整华法林的用量,使INR维持在2.0~3.0之间,直到甲状腺功能维持正常并恢复正常的窦性节律。甲亢患者凝血因子的清除率增加,药物与血浆蛋白的结合下降50%,因此,其对华法林抗凝作用的敏感性增加,而对应用维生素K纠正华法林导致的低凝血酶原血症并不敏感,因此甲亢患者应用华法林需减少剂量。
3.2 亚临床甲亢的治疗
亚临床甲亢进展至临床甲亢的发生率低,因此是否治疗尚有争议。目前尚无随机对照的前瞻性研究用以评价亚临床甲亢患者的治疗获益。如表1所示,ATA推荐以下情况应给予治疗[23]。血清TSH恢复正常后,心血管功能可能会显著改善,因而出现心率下降,房性及室性早搏数量、左室质量指数、室间隔厚度和舒张期左室后壁厚度均下降。
4 甲减对心血管系统的影响
4.1 临床甲减
约80%的甲减患者有心血管系统受累的表现,其是无足够的甲状腺激素作用于心肌以及甲减相关的脂代谢紊乱损伤血管的共同结果。心脏血流动力学的变化取决于甲状腺激素缺乏的严重性。长期的甲减可引起包括血管内容量下降,系统性血管阻力增加和收缩力降低,心脏氧耗量降低等表现。甲减可引起劳力性呼吸困难,而端坐呼吸、阵发性夜间呼吸困难和心绞痛相对少见。体格检查可发现心动过缓、脉压小、轻度高血压、心音遥远、心肌肥厚等。因心脏对儿茶酚胺的敏感性下降,老年甲减患者中的30%~60%可出现心动过缓。10%~50%的患者血压增高,特别是舒张期血压升高,其机理尚不清楚,一般降压药治疗效果不佳,而甲状腺激素替代治疗后血压可恢复正常[24]。心包积液是30%~80%老年甲减患者的特征性表现之一,其并不影响心脏功能,大量心包积液时也很少出现心包填塞症状。严重甲减的患者可出现外周水肿、胸腔积液甚至腹水,有类似CHF的表现,但非可凹性浮肿提示甲减的可能性。在无其他伴随疾病时,甲减患者极少出现CHF。无肺淤血表现、血容量下降、胸腔积液或心包积液中蛋白含量高,静息状态时静脉、动脉、肺动脉和右室舒张末期压力均正常,以上表现均高度提示黏液性水肿。黏液水肿性心肌病可表现为气短、胸腔积液、心肌肥大等,其很难与CHF鉴别,但前者应用甲状腺激素替代治疗后是可逆的。

表1 亚临床甲亢的推荐治疗Table 1 Recommended therapy strategy for subclinical hyperthyroidism
心电图呈心动过缓、QT间期延长、T波低平或倒置、QRS波低电压,其可能是甲状腺激素缺乏的直接作用,也可能是甲减引起心包积液的ECG表现,患者常常出现不完全性或完全性右束支传导阻滞,室性心律失常包括室性心动过速,尖端扭转型室速。经替代治疗后上述表现可恢复正常,甚至在其他临床表现恢复前恢复。
由于甲减患者常伴有高胆固醇血症,主要表现为TC、LDL-C和载脂蛋白B(apolipoprotein B,apoB)升高,且甲减常引起舒张期高血压,故甲减患者易发生动脉硬化和冠心病,老年甲减患者尤甚。但甲状腺激素的缺乏对老年人有保护作用,即降低代谢率及肾上腺素能的兴奋性[4],因此,老年甲减患者较少发生心绞痛、心肌梗死和心力衰竭。
4.2 亚临床甲减
我国南昌地区的调查显示,亚临床甲减的总患病率为6.1%,60岁以上达10.4%。超过60岁的女性中患病率可达20%左右。每年约有2%~5%的亚临床甲减患者进展为临床甲减[25]。74%年龄大于80岁TSH>4.5mIU/L的人群,如果按照年龄特异的TSH 97.5%的可信区间7.4mIU/L判断甲状腺功能状态,可划分于正常范围内,因此应用统一的TSH正常参考值上限定义亚临床甲减,可能高估了老年人亚临床甲减的患病率[3]。需要注意的是,亚临床甲状腺疾病往往是一个中间状态,同亚临床甲亢自发缓解一样,国外研究报道在2年和4年的随访中,持续为亚临床甲减的患者仅为56%。按照初始TSH水平分层,两年随访时TSH恢复正常的比例分别为,初始TSH在4.5~6.9mIU/L的患者为46%,TSH7~9.9mIU/L为10%,TSH≥10mIU/L为7%(P<0.001)。该变化与年龄和性别无关[26]。
4.3 亚临床甲减对心血管的主要影响
如表2所示,诸多研究表明亚临床甲减可影响心肌构型和收缩功能,上述异常均能在应用左甲状腺素(L-T4)替代治疗后好转[4]。亚临床甲减患者最一致的心脏异常是左室舒张功能受损,其以心肌松弛延缓和心室充盈受损为特征。更敏感的Doppler心肌显像和心脏核磁共振已证实亚临床甲减也存在心脏收缩功能受损。亚临床甲减患者和甲减患者的心血管改变相似,提示心脏改变在亚临床至临床甲减的患者中是一个连续的过程[4]。
研究表明,TSH在正常高限时就可对血脂和脂蛋白水平有不利影响。但亚临床甲减的血脂变化远不及临床甲减明显。Surks等[25]认为当血清TSH>10mIU/L时,其与TCHO、LDL-C的升高有较好的相关性。在亚临床甲减患者中,LDL-C水平增高了约20%。血清TSH>6mIU/L时,TSH每上升1mIU/L,女性TCHO上升0.09mmol/L,男性则上升0.16 mmol/L[27],亚临床甲减对血脂的影响可能与年龄相关。Rotterdam研究中纳入的对象平均年龄是69岁,研究未发现亚临床甲减与血脂升高存在相关性[28],而针对年轻受试者的研究则表明亚临床甲减与血脂变化显著相关。应用L-T4治疗亚临床甲减后,血脂的改善情况并不一致。荟萃分析提示对于基线TCHO(>240mg/dl)较高的患者应用L-T4治疗获益更大[29]。
亚临床甲减对血压的影响结论并不一致,其对多种预测心血管疾病风险的血清标志物(如C反应蛋白、同型半胱氨酸)的影响各家报道亦不相同[30-32]。应用L-T4治疗的多项小规模研究提示治疗后亚临床甲减患者的脉搏波传导速度(pulse wave velocity,PWV)、肱动脉内皮依赖性舒张功能(flow-mediated dilation,FMD)、颈动脉内膜中层厚度(intima-media thickness,IMT)均有改善。针对亚临床甲减和缺血性心脏病(ischemic heart disease,IHD)的相关性,Razvi等[33]对97例亚临床甲减(TSH 6.0~15mIU/L)患者和2279例甲状腺功能正常的无IHD的人群随访了20年,结果表明IHD的发病率在亚临床甲减组显著高于功能正常组,调整后的风险比为1.76(95% CI 1.15~2.71;P=0.01);IHD死亡率在亚临床甲减组也较功能正常组增加[风险比为1.79(95%CI 1.02~3.56),P=0.05];当应用L-T4治疗亚临床甲减后IHD相关的发病率和死亡率可能减少;这两组全因死亡率差异无统计学意义。Rodondi等[34]对亚临床甲减和冠心病(coronary heart disease,CHD)的风险以及全因死亡率的关系进行了Meta分析,该研究包括了11个前瞻性研究,随访时间从1972年到2007年,从7个队列研究25 977人中获得的数据分析显示(表3),亚临床甲减患者的总体死亡率没有增加,亚临床甲减患者TSH水平的升高与CHD事件的风险增加和CHD的死亡增加相关,特别是TSH水平>10mIU/L者。部分研究提示,随访大于5年的研究中亚临床甲减患者患冠心病的风险明显高于随访时间小于5年的研究,提示亚临床甲减对冠心病起轻微的长期促进作用[35]。与甲状腺功能正常的老人相比,TSH≥10mIU/L的患者心力衰竭和心功能改变的危险轻度增加,但在TSH<10mIU/L的患者中未观察到相同情况[36]。但Hyland等[37]观察了679名持续亚临床甲减和4184名甲状腺功能正常的65岁以上未服甲状腺制剂的老年人发生CHD、心力衰竭和心血管死亡的10年风险,研究发现持续性亚临床甲减和CHD[hazard ratio(HR)1.12,95% CI(0.93~1.36)]、心力衰竭 [HR 1.05,95% CI(0.97~1.27)]或心血管死亡[HR1.07,95%CI(0.87~1.31)]均不相关;而按照TSH水平4.5~6.9、7.0~9.9和10.0~19.9mIU/L分层,亦未发现相关性。
综上所述,亚临床甲减可能是心力衰竭、IHD、全因死亡的一个潜在危险。亚临床甲减对心血管事件的影响在不同年龄的患者中可能不同,对于年龄较轻的人(在50~60岁或以上)亚临床甲减增加心血管的危险,但对年龄大于85岁的老老年人可能有心血管的保护作用。因此,有作者推测亚临床甲减和IHD的风险可能存在年龄依赖的易感性。在年轻时,甲减可能通过脂代谢紊乱、内皮功能异常或直接对心脏的作用与其他基因或环境因素协同增强IHD的风险,相反,老年特别是老老年(年龄大于85岁)的患者,其可能从轻度甲状腺功能减退导致的代谢减慢、节省能量中获益,因此,反而表现为长寿、心血管事件风险降低[38]。而亚临床甲减与其他心血管疾病或死亡率相关的假设尚未得到一致结论。

表2 已报道的与亚临床甲减相关的心血管表现Table 2 Reported cardiovascular features of subclinical hypothyroidism
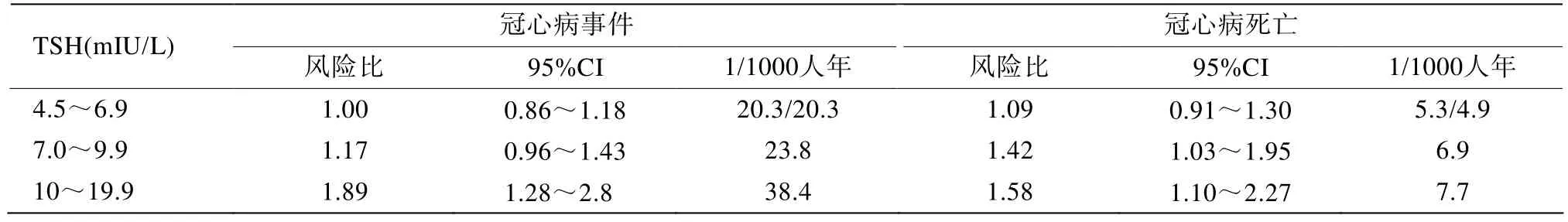
表3 不同TSH水平的亚临床甲减患者与甲状腺功能正常者相比发生冠心病事件及冠心病死亡的情况Table 3 Stratified analyses for the associations between subclinical hypothyroidism and risk of coronary heart disease(CHD) events and CHD mortality
4.4 治疗
4.4.1 临床甲减治疗 甲状腺片是动物甲状腺的干制剂,因其甲状腺激素含量不稳定,T3含量过高已很少使用。老年患者对T3的耐受性差,且T3的半衰期短(1.4d),因此应避免使用干甲状腺片[39],而应优先选择L-T4替代治疗甲减,而T3、T4的联合治疗同样具有T3的缺点。老年甲减患者可能有潜在的心血管疾病,所以甲状腺激素替代治疗的剂量需从更小量开始,即每天12.5µg。考虑到年龄和L-T4的半衰期,应每4~6周增加25µg,直到血清TSH水平下降至正常范围或患者出现甲状腺毒症的症状。因为甲状腺激素随年龄增长分泌量下降,且在年龄大于65岁的老人中T4的半衰期大约为9d,因此与年轻患者相比,老年甲减患者的替代量需减少25%,常为75~100µg,且L-T4调整剂量要慢。
有严重心肌缺血的患者,恢复甲状腺功能而不引起心脏症状是很困难的。但一项研究表明,经替代治疗后84%有症状的冠心病患者症状无加重或反而有改善,仅16%的患者症状加重。在治疗中应予最大量的抗心绞痛治疗,包括β受体阻滞剂,血管扩张剂和钙离子拮抗剂。如果仍然发生心绞痛或心绞痛恶化,应考虑血管成形术或冠状动脉搭桥术。60到75岁的老年甲减患者,合理替代治疗的目标是TSH 3~4mIU/L,年龄更大的患者TSH水平应达到4~6mIU/L[4]。
对于老年分化型甲状腺癌的患者,手术后应用L-T4抑制TSH治疗,可能出现医源性的亚临床甲亢,诱发老年人出现心血管疾病的相关表现。虽然TSH抑制治疗能降低分化型甲状腺癌的复发率,但对老年人需权衡潜在的并发症风险。
4.4.2 亚临床甲减的治疗 基于亚临床甲减进展至临床甲减的发生率和甲状腺素治疗对甲减相关症状、抑郁、脂代谢和心脏功能的改善,对TSH水平超过10mIU/L的患者应予以治疗。对于TSH在5~10mIU/L之间,抗微粒体抗体高水平或有与轻度甲减一致的症状时也可替代治疗; 抗微粒体抗体阴性而无甲减症状的患者,每6~12个月监测TSH和FT4。因为亚临床甲减对年龄大于85岁老人的心血管事件有保护作用,所以在老老年人中如果TSH<10mIU/L可能不是亚临床甲减治疗的适应证。考虑到亚临床甲减和心血管疾病相关研究的不一致性,可能仅有部分的亚临床甲减患者通过积极应用L-T4替代治疗获益。
[1]Cappola AR, Fried LP, Arnold AM,et al.Thyroid status,cardiovascular risk, and mortality in older adults[J].JAMA, 2006, 295(9): 1033-1041.
[2]闫宛春, 高奎山.老年人甲状腺功能异常流行病学研究现状[J].中国老年学杂志, 2011, 31(2): 367-368.
[3]Hollowell JG, Staehling NW, Flanders WD,et al.Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III)[J].J Clin Endocrinol Metab, 2002, 87(2): 489-499.
[4]Biondi B, Cooper DS.The clinical significance of subclinical thyroid dysfunction[J].Endocr Rev, 2008,29(1): 76-131.
[5]Surks MI, Hollowell JG.Age-specific distribution of serum thyrotropin and antithyroid antibodies in the US population: implications for the prevalence of subclinical hypothyroidism[J].J Clin Endocrinol Metab, 2007,92(12): 4575-4582.
[6]Klein I, Ojamaa K.Thyroid hormone and the cardiovascular system[J].N Engl J Med, 2001, 344(7):501-509.
[7]Fadel BM, Ellahham S, Ringel MD,et al.Hyperthyroid heart disease[J].Clin Cardiol, 2000, 23(6): 402-408.
[8]Pereira N, Parisi A, Dec GW,et al.Myocardial stunning in hyperthyroidism[J].Clin Cardiol, 2000, 23(4):298-300.
[9]陈秀林.甲状腺功能亢进症合并急性心肌梗死患者的临床分析[J].中国急救医学, 2011, 31(7): 664-666.
[10]肖 军, 唐发宽, 金志浩, 等.老年甲亢性心脏病误诊为其他心血管病的原因分析[J].中国综合临床, 2003,19(4): 382-833.
[11]Toft AD.Clinical practice.Subclinical hyperthyroidism[J].N Engl J Med, 2001, 345(7): 512-516.
[12]Neves C, Alves M, Medina JL,et al.Thyroid diseases,dyslipidemia and cardiovascular pathology[J].Rev Port Cardiol, 2008, 27(10): 1211-1236.
[13]Biondi B, Kahaly GJ.Cardiovascular involvement in patients with different causes of hyperthyroidism[J].Nat Rev Endocrinol, 2010, 6(8): 431-443.
[14]Osman F, Gammage MD, Sheppard MC,et al.Clinical review 142: cardiac dysrhythmias and thyroid dysfunction:the hidden menace[J]? J Clin Endocrinol Metab, 2002,87(3): 963-967.
[15]李 智, 李 静, 滕卫平, 等.115例亚临床甲状腺功能亢进症的流行病学研究[J].中华内分泌代谢杂志, 2003,19(2): 23-24.
[16]Sawin CT, Geller A, Wolf PA,et al.Low serum thyrotropin concentrations as a risk factor for atrial fibrillation in older persons[J].N Engl J Med, 1994,331(19): 1249-1252.
[17]Kreuzberg U, Theissen P, Schicha H,et al.Single-channel activity and expression of atrial L-type Ca2+channels in patients with latent hyperthyroidism[J].Am J Physiol Heart Circ Physiol, 2000, 278(3): H723-730.
[18]Parle JV, Maisonneuve P, Sheppard MC,et al.Prediction of all-cause and cardiovascular mortality in elderly people from one low serum thyrotropin result: a 10-year cohort study[J].Lancet, 2001, 358(9285): 861-865.
[19]Gussekloo J, van Exel E, de Craen AJ,et al.Thyroid status, disability and cognitive function, and survival in old age[J].JAMA, 2004, 292(21): 2591-2599.
[20]Haentjens P, Van Meerhaeghe A, Poppe K,et al.Subclinical thyroid dysfunction and mortality: an estimate of relative and absolute excess all-cause mortality based on time-to-event data from cohort studies[J].Eur J Endocrinol, 2008, 159(3): 329-341.
[21]Walsh JP, Bremner AP, Bulsara MK,et al.Subclinical thyroid dysfunction as a risk factor for cardiovascular disease[J].Arch Intern Med, 2005, 165(21): 2467-2472.
[22]Papaleontiou M, Haymart MR.Approach to and treatment of thyroid disorders in the elderly[J].Med Clin North Am,2012, 96(2): 297-310.
[23]Bahn RS, Burch HB, Cooper DS,et al.Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists[J].Endocr Pract, 2011, 17(3): 456-520.
[24]丁国林, 丁 欣.老年人甲状腺功能减退症的心血管状态[J].国外医学老年医学分册, 2006, 27(05): 239-240.
[25]Surks MI, Ortiz E, Daniels GH,et al.Subclinical thyroid disease: scientific review and guidelines for diagnosis and management[J].JAMA, 2004, 291(2): 228-238.
[26]Somwaru LL, Rariy CM, Arnold AM,et al.The natural history of subclinical hypothyroidism in the elderly: the cardiovascular health study[J].J Clin Endocrinol Metab,2012, 97(6): 1962-1969.
[27]Bindels AJ, Westendorp RG, Frolich M,et al.The prevalence of subclinical hypothyroidism at different total plasma cholesterol levels in middle aged men and women:a need for case-finding[J]? Clin Endocrinol (Oxf), 1999,50(2): 217-220.
[28]Hak AE, Pols HA, Visser TJ,et al.Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam Study[J].Ann Intern Med, 2000,132(4): 270-278.
[29]Danese MD, Ladenson PW, Meinert CL,et al.Clinical review 115: effect of thyroxine therapy on serum lipoproteins in patients with mild thyroid failure: a quantitative review of the literature[J].J Clin Endocrinol Metab, 2000, 85(9): 2993-3001.
[30]Park YJ, Lee EJ, Lee YJ,et al.Subclinical hypothyroidism (SCH) is not associated with metabolic derangement, cognitive impairment, depression or poor quality of life (QoL) in elderly subjects[J].Arch Gerontol Geriatr, 2010, 50(3): e68-73.
[31]Adrees M, Gibney J, El-Saeity N,et al.Effects of 18 months of L-T4replacement in women with subclinical hypothyroidism[J].Clin Endocrinol (Oxf), 2009, 71(2):298-303.
[32]黄绵清, 薛冀苏, 幸思忠, 等.亚临床甲状腺功能减退患者同型半胱氨酸水平与冠状动脉粥样硬化的关系[J].中国老年学杂志, 2006, 26(4): 455-456.
[33]Razvi S, Weaver JU, Vanderpump MP,et al.The incidence of ischemic heart disease and mortality in people with subclinical hypothyroidism: reanalysis of the Whickham Survey cohort[J].J Clin Endocrinol Metab,2010, 95(4): 1734-1740.
[34]Rodondi N, den Elzen WP, Bauer DC,et al.Subclinical hypothyroidism and the risk of coronary heart disease and mortality[J].JAMA, 2010, 304(12): 1365-1374.
[35]张 娜, 张文良, 时景璞.亚临床甲状腺功能减退与冠心病关系的Meta分析[J].中国全科医学, 2011, 14(2):125-129.
[36]Rodondi N, Bauer DC, Cappola AR,et al.Subclinical thyroid dysfunction, cardiac function, and the risk of heart failure.The Cardiovascular Health study[J].J Am Coll Cardiol, 2008, 52(14): 1152-1159.
[37]Hyland KA, Arnold AM, Lee JS,et al.Persistent subclinical hypothyroidism and cardiovascular risk in the elderly: the cardiovascular health study[J].J Clin Endocrinol Metab, 2013, 98(2): 533-540.
[38]Mariotti S.Mild hypothyroidism and ischemic heart disease: is age the answer[J]? J Clin Endocrinol Metab,2008, 93(8): 2969-2971.
[39]Fick D, Semla T, Beizer J,et al.American Geriatrics Society updated Beers Criteria for potentially inappropriate medication use in older adults[J].J Am Geriatr Soc, 2012,60(4): 616-631.

