不同分期的慢性肾脏病患者中血尿酸与冠状动脉狭窄程度相关性分析
韩雅蕾, 张 萌, 易 忠, 张 斌, 王 斌
(北京航天中心医院心脏中心, 北京 100039)
慢性肾脏病(chronic kidney disease,CKD)与心血管疾病的发病率和死亡率增加密切相关[1]。对不同人群进行的研究发现,估测的肾小球滤过率(estimated glomerular filtration rate,eGFR)降低和蛋白尿出现是心血管事件发生率增加的独立危险因素[2,3]。研究发现随着eGFR逐渐降低发生心血管事件的风险显著增加[4]。
许多研究发现血清尿酸(serum uric acid level,SUA)水平增加与心血管事件(cardiovascular events,CVEs)相关[5,6]。近年来,流行病学研究表明,高尿酸血症(hyperuricemia,HUA)与冠状动脉病变在流行病学、发病机制以及相关治疗方面密切相关[7]。最近研究发现SUA是冠心病的独立危险因素[8]。HUA是CKD患者一种常见的伴发疾病。因此,SUA可能增加CKD患者的心血管事件发生率和死亡率。然而,目前关于HUA在CKD不同分期对冠状动脉狭窄程度的影响作用仍不清楚。
1 对象与方法
1.1 对象
随机选择北京航天中心医院心脏中心2011年1月至2012年9月收治的214例冠心病患者为研究对象。所有入选患者均行冠状动脉造影检查,并按2007年国际心脏病学会和协会以及WHO临床命名标准化联合专题组报告提出的冠心病诊断标准,至少有1支冠状动脉主支直径狭窄大于50%,接受经皮冠状动脉腔内血管成形术(percutaneous transluminal coronary angioplasty,PTCA)/经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)/冠状动脉旁路移植术(coronary artery bypass grafting,CABG)治疗。均排除可导致核酸代谢亢进的血液疾病,细胞破坏或增长加速的疾病如红细胞增多症、骨髓异常增生症、多发性骨髓瘤、急慢性溶血性贫血、白血病、淋巴瘤,各种癌肿放疗或化疗后,排除肾脏非痛风性结石、急慢性肾功能衰竭[eGFR<15ml/(min·1.73m2)]及慢性肾小球肾炎、慢性间质性肾炎、糖尿病肾病等其他肾脏疾病,排除近3个月来服用过双氢克尿赛、吡嗪酰胺类等可促进尿酸排泄药物的患者。
1.2 方法
研究对象均询问患者并记录有无高血压、糖尿病、血脂异常、脑卒中、短暂性脑缺血发作等病史;有无吸烟、饮酒嗜好和目前的药物治疗情况。高血压定义为既往明确病史目前正在接受降压治疗,或收缩压≥140mmHg(1mmHg=0.133kPa),和(或)舒张压≥90mmHg。HUA定义为血清尿酸值男性>417µmoL/L(7.0mg/ml),女性>357µmol/L(6.0mg/ml)。糖尿病定义为正在接受降糖药物治疗,或空腹血糖≥7.0mmoL/L,餐后血糖≥11.1mmoL/L。血脂异常定义为正在接受调脂药物治疗,或低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)≥2.6mmol/L。CKD定义根据为eGFR<60ml/(min·1.73m2)超过3个月,有或无肾脏损伤证据;CKD分期按美国K-DOQI指南,CKD3期为eGFR 30~59ml/(min·1.73m2);CKD4期为eGFR 15~29ml/(min·1.73m2)。
所有患者均经知情同意后取入院后第1天空腹12h晨起血生化检查结果:SUA水平、总胆固醇水平(total cholesterol,TC)、甘油三酯水平(triglyceride,TG)、高密度脂蛋白胆固醇水平(high density lipoprotein cholesterol,HDL-C)、LDL-C、血糖和血清肌酐浓度。
1.3 冠状动脉造影
均采用Judkins技术。任何一支主要血管(左主干、前降支、回旋支或右冠状动脉)曾接受PCI或CABG治疗或狭窄程度≥50%定义为阳性。对冠状动脉狭窄严重程度的评价采用两种方法:(1)根据血管狭窄阳性支数分为单支病变组、双支病变组、三支或左主干病变组;(2)根据所有病变的狭窄部位和程度计算Gensini评分(曾接受PCI或CABG治疗的患者不列入), 评分越高,表示冠状动脉病变程度越重。
1.4 统计学处理
应用SPSS13.0软件包建立数据库,并进行统计学分析。所有计量数据采用±s表示;计数资料以频数表示。组间比较:方差齐且正态分布者采用独立样本t检验或单因素方差分析;方差不齐或非正态分布者采用秩和检验。相关分析:正态分布者进行Pearson相关分析,非正态分布者进行秩相关分析。多因素分析采用logistic回归分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 患者基本临床情况
本研究共连续入选214例患者,男性118例(55.1%),女性96例(44.9%);平均年龄(67.0±11.3)岁;平均体质量指数(24.8±3.5)kg/m2(表1)。其中既往存在脑卒中病史患者100例(46.7%),糖尿病患者88例(41.1%),高血压患者157例(73.4%),血脂异常患者72例(33.6%)。
按照eGFR分别15~29,30~59和≥60ml/(min·1.73m2)分为A、B、C三组(表1)。A、B、C三组的入选患者比例分别为7.0%、31.3%和61.7%。绝大多数CKD患者处于第3期(n=67),仅有少数患者处于第4期(n=15)。相较于eGFR≥60ml/(min·1.73m2)组,eGFR 30~59ml/(min·1.73m2)组和eGFR15~29ml/(min·1.73m2)组中年龄、脑卒中发生率、收缩压和血尿酸均更高;CKD患者中,随着eGFR的减少,老年患者增多,脑卒中发生率、收缩压和血尿酸水平增加[eGFR30~59ml/(min·1.73m2)组vseGFR 15~29ml/(min·1.73m2)组,P<0.05]。然而各组的糖尿病、脂代谢紊乱发生率和吸烟病史相似。各组临床用药情况差异不存在统计学意义。
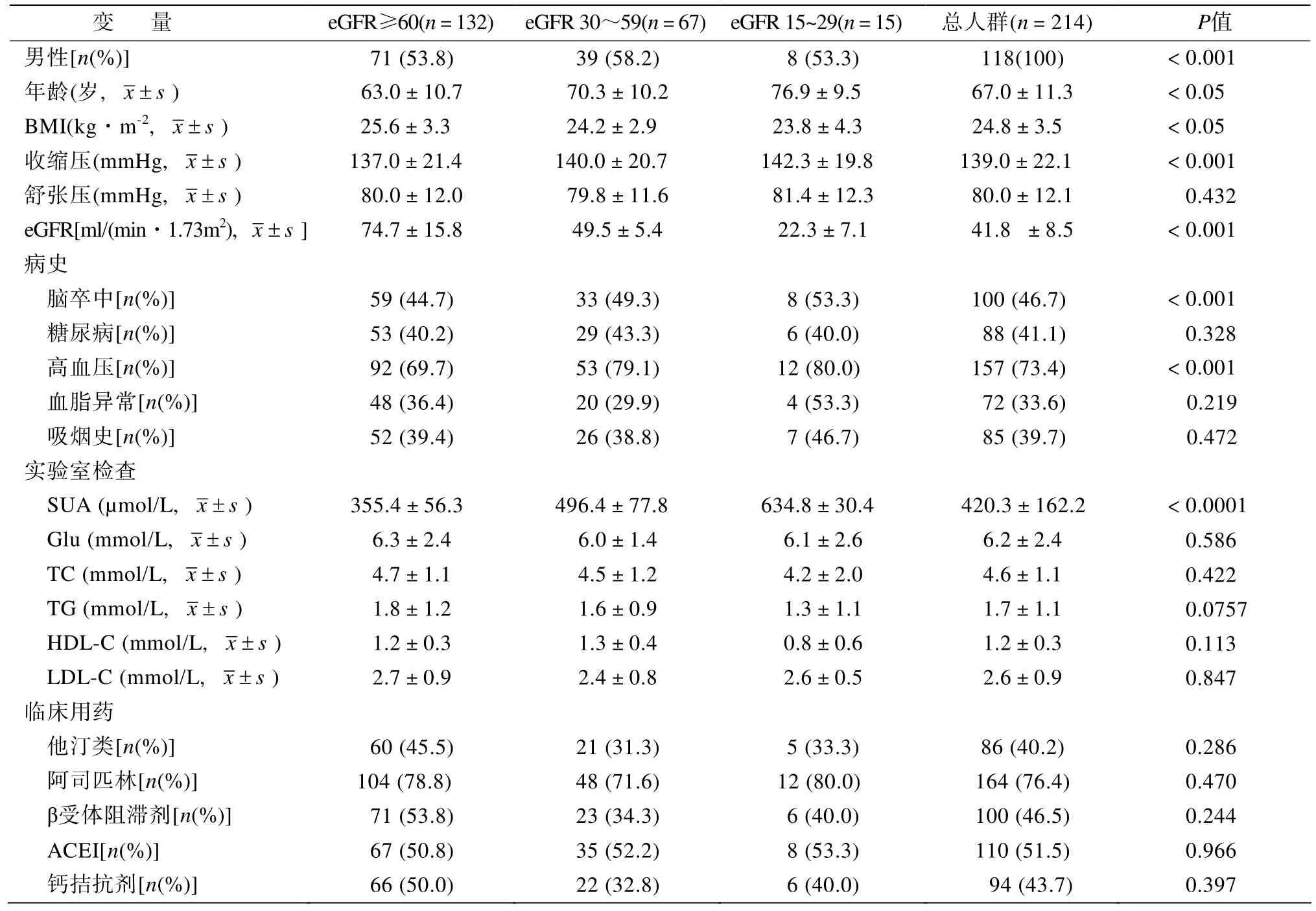
表1 患者基本临床资料Table 1 General characteristics of the enrolled patients
2.2 eGFR与冠状动脉狭窄程度的相关性
按照不同eGFR分组后评价各组冠状动脉血管狭窄程度,并计算Gensini评分(表2)。因根据eGFR分组和Gensini评分均不符合正态分布,故采用秩相关分析,结果提示eGFR分组与Gensini评分呈显著负相关关系(Spearman相关系数= -0.536,P<0.001),即eGFR越低,冠状动脉狭窄程度越重。

表2 冠状动脉狭窄程度和eGFRTable 2 Extent of coronary artery stenosis and eGFR
2.3 CKD患者中血尿酸与冠状动脉狭窄程度的相关分析
首先,在整个人群中分析SUA水平与冠状动脉狭窄程度的相关性。对CKD患者各因素进行皮尔森相关系数分析,结果显示SUA水平与冠状动脉狭窄程度强相关(r=0.26,P=0.001;表3)。
然后,根据eGFR分组后进一步分析SUA水平与冠状动脉狭窄程度的相关性。结果显示在根据eGFR划分的A,B,C三组中高尿酸血症[SUA男性>417µmol/L(7.0mg/ml),女性>357µmol/L(6.0mg/ml)]患病率均与冠状动脉狭窄程度相关(r=0.862,P<0.001;r=0.33,P=0.001;r=0.113,P<0.05)。而且,在A组中高尿酸血症患者比例(93.4%)较B组(63.6%)和C组(50.1%)均升高(P<0.05)。

表3 CKD患者各因素的皮尔森相关系数Table 3 Univariate Pearson correlation coefficients between variables of patients with CKD
2.4 Logistic回归分析冠心病患者中慢性肾脏病的独立危险因素
对表1中相关临床数据,以eGFR<60ml/(min·1.73m2)为因变量,以年龄、BMI、SUA水平、TG水平、TC水平、LDL-C水平、脑卒中病史、高血压病史、糖尿病史及冠状动脉狭窄程度为自变量,进行logistic回归。结果显示SUA水平(OR=1.22,95% CI 1.09~1.37,P<0.001)与年龄(OR=1.11,95%CI 1.10~1.14,P<0.001)、冠状动脉狭窄程度(OR=0.83,95%CI 0.79~0.85,P<0.001)、高血压病史(OR=1.90,95%CI 1.40~2.60,P<0.001)均为慢性肾脏病的独立危险因素(表4)。

表4 慢性肾脏病的独立危险因素Table 4 Independent risk factors of CKD
3 讨 论
HUA是嘌呤代谢异常和(或)尿酸排泄减低所致的一组疾病,以SUA升高为主要特征。随着我国人民生活水平的提高,其患病率已超过10%,并呈逐年升高趋势。目前研究认为HUA与冠心病发病有相关性,并与其预后有一定关系,已引起临床关注。SUA轻度升高时临床上可无任何症状,但HUA与多种代谢性疾病,如肥胖症、高脂血症、高血压病、糖尿病、动脉粥样硬化等明显相关[9]。SUA在心血管系统中主要由血管壁中的内皮细胞分泌产生。
Short等[10]发现,SUA水平≥309µmol/L患者,5年内心血管事件(心源性死亡和新发冠心病)发生率增加3.5倍,SUA水平升高是动脉粥样硬化病变发展的重要因素,并影响其预后。SUA影响冠心病发生的病理机制尚不明确,目前认为可能是通过以下几点发挥效应:(1)HUA时,析出的尿酸结晶沉积在血管壁,不仅直接造成动脉壁增厚,而且损伤血管内皮导致内皮损伤、内膜暴露,促进粥样硬化形成[11];(2)SUA可能通过抑制血管内膜修复,降低NO生成而损伤内皮功能[12];(3)SUA促使氧自由基增加并参与炎症反应,诱导血小板聚集,促进血栓形成,发生梗阻或缺血;(4)SUA是内源性抗氧化剂,脂质过氧化能促进动脉粥样硬化的发生。由于HUA还多合并血脂代谢异常,SUA通过上述综合因素必然更加重了动脉粥样硬化的发生和发展。
根据目前的研究,SUA导致肾功能损伤的机制仍不清楚。基础实验研究结果显示HUA通过氧化应激和炎症等机制引起肾脏内皮细胞、肾小动脉和肾间质小管的损伤[13,14]。Price等[15]发现SUA经尿酸盐转运体-1转运到内皮细胞内诱发氧化应激反应。另外,研究发现HUA可促进近肾小球区肾素的表达并抑制致密斑神经元NO的合成[16]。因此,SUA可能是通过激活肾素-血管紧张素系统、氧化应激反应和炎症因子分泌等多个系统的相互作用而诱发肾功能损伤。本研究中发现eGFR<60ml/(min·1.73m2)患者中SUA水平显著升高,且eGFR15~29ml/(min·1.73m2)患者中SUA水平最高[(634.77±30.4)vs(355.42±56.3)µmol/L,P<0.001]。通过相关性分析发现CKD患者中SUA水平与冠状动脉狭窄程度强相关;而CKD分期与Gensini评分呈显著负相关关系,即eGFR越低,冠状动脉狭窄程度越重。CKD的独立危险因素包括:SUA水平(OR=1.22,95% CI 1.09~1.37,P<0.001)、年龄(OR=1.11,95%CI 1.10~1.14,P<0.001)、冠状动脉血管严重程度(OR=0.83,95%CI 0.79~0.85,P<0.001)与高血压病史(OR=1.90,95%CI 1.40~2.60,P<0.001)。
综上所述,冠状动脉狭窄程度在eGFR降低患者中加重。CKD患者中HUA与冠状动脉狭窄程度正相关。血尿酸、高龄、冠状动脉狭窄程度和高血压病史是CKD的独立危险因素。因此,HUA可能是CKD患者冠状动脉狭窄程度加重的重要因素。而这些发现可能有助于CKD患者冠状动脉血管病变的评价。
[1]Sarnak MJ, Levey AS, Schoolwerth AC,et al.Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention[J].Hypertension, 2003,42(5): 1050-1065.
[2]Matsushita K, van der Velde M, Astor BC,et al.Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative metaanalysis[J].Lancet, 2010, 375(9731): 2073-2081.
[3]Hemmelgarn BR, Manns BJ, Lloyd A,et al.Alberta Kidney Disease Network.Relation between kidney function, proteinuria, and adverse outcomes[J].JAMA,2010, 303(5): 423-429.
[4]Go AS, Chertow GM, Fan D,et al.Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization[J].N Engl J Med, 2004, 351(11): 1296-1305.
[5]Fang J, Alderman MH.Serum uric acid and cardiovascular mortality the NHANES I epidemiologic follow-up study, 1971-1992.National Health and Nutrition Examination Survey[J].JAMA, 2000, 283(18):2404-2410.
[6]Niskanen LK, Laaksonen DE, Nyyssonen K,et al.Uric acid level as a risk factor for cardiovascular and all-cause mortality in middle-aged men: a prospective cohort study[J].Arch Intern Med, 2004, 164(14): 1546-1551.
[7]Puddu PE,Lanti M, Menotti A,et al.Serum uric acid for short term prediction of cardiovascular disease incidence in the Gubbio population study[J].Acta Cardiol, 2001,56(4): 243-251.
[8]吴宗文, 方运勇.冠状动脉病变与血尿酸的相关性研究[J].当代医学, 2012, 18(1): 4-6.
[9]颜秉菊, 蔡久英, 王 俊.冠心病患者血尿酸水平与血管内皮功能的相关性研究[J].山东医药, 2009, 53(49):44-45.
[10]Short RA, Johnson RJ, Tuttle KR.Uric acid, microalbumin uria and cardiovascular events in high-risk patients[J].Am J Nephrol, 2005, 25(1): 36-44.
[11]Hoeg JM.Expanding and understanding risk factors for coronary heart disease[J].JAMA,1997, 277(17): 1387.
[12]Kanellis J, Kang DH.Uric acid as a mediator of endothelial dysfunction, inflammation, and vascular disease[J].Semin Nephrol, 2005, 25(1): 39-42.
[13]Sa´nchez-Lozada LG, Soto V, Tapia E,et al.Role of oxidative stress in the renal abnormalities induced by experimental hyperuricemia[J].Am J Physiol Renal Physiol, 2008, 295(4): F1134-F1141.
[14]Kosugi T, Nakayama T, Heinig M,et al.Effect of lowering uric acid on renal disease in the type 2 diabetic db/db mice[J].Am J Physiol Renal Physiol, 2009, 297(2):F481-F488.
[15]Price KL, Sautin YY, Long DA,et al.Human vascular smooth muscle cells express a urate transporter[J].J Am Soc Nephrol, 2006, 17(7): 1791-1795.
[16]Mazzali M, Hughes J, Kim YG,et al.Elevated uric acid increases blood pressure in the rat by a novel crystal independent mechanism[J].Hypertension, 2001, 38(5):1101-1106.

