佛波酯诱导THP-1细胞分化条件的优化及自噬模型的建立
陈亮 孙毅凡 陈涛 李海成 江振友 周琳 钟球
细胞自噬是从酵母到人类都很保守的古老代谢过程[1],传统观点认为自噬已进化为一种重复利用路径,即其可使真核细胞在饥饿状态下通过降解受损或废弃的细胞器及蛋白质而获得营养[2-3]。近年研究显示,自噬可作为天然免疫、获得性免疫和炎症反应的调控子发挥协助调节免疫系统的功能[4-5],此外,自噬广泛参与多种疾病的发生发展[6-7],包括癌症、神经退行性病变,以及心血管和肺部疾病等。
早在20世纪50年代在哺乳动物细胞中就已鉴定到自噬的形态学,随后详尽的形态学和药理学研究使得自噬过程的基本步骤逐渐明确。目前已鉴定30余个自噬相关基因(autophagy associated gene,ATG)[5,8], Atg8/LC3是一种类似于泛素蛋白的蛋白质,可与磷脂酰乙醇胺(PE)结合。LC3(light chain 3)是目前公认的自噬分子标志物。哺乳动物中有3种LC3,包括LC3A、LC3B、LC3C,它们在自噬过程中存在相关的翻译后修饰。LC3B标记荧光蛋白(如GFP、GFP-LC3)已被用于间接免疫荧光或直接荧光显微镜的方法测定LC3或GFP-LC3点聚集的增加量来监测自噬通量。Atg5和Atg7、Beclin1均是重要的自噬调控基因,其编码的相应蛋白在自噬体的形成、泛素样蛋白通路等多个过程中可发挥重要作用。自噬的诱导可伴随着某些自噬基因mRNA水平的增加,可利用northern印迹或实时荧光定量聚合酶链式反应(RT-qPCR)方法检测LC3等自噬相关基因的mRNA的水平变化。
近年来,自噬相关领域的研究已成为热点。自噬模型也成为研究者常常涉及到的研究模型,本研究在前人研究的基础上,优化了PMA诱导人类单核/巨噬细胞(THP-1)细胞分化的条件,建立了较好的自噬模型,旨在为以THP-1细胞为基础的自噬模型构建及相关功能研究提供实验基础。
材料和方法
一、材料和试剂来源
佛波酯(phorbol 12-myristate 13-acetate, PMA)购于Sigma公司(美国);孔板和抗生素等购于广州唯民生物科技有限公司;感受态细菌DH5α购于Transgene公司(中国);THP-1细胞购于中山大学细胞库; pcDNA3.1- YFP-LC3质粒(简写为“YFP-LC3质粒”)为广东省结核病控制中心参比实验室保存(由中山大学肿瘤防治中心朱孝峰教授馈赠);胎牛血清购于杭州四季青生物工程材料有限公司;RPMI 1640培养基(简写为“1640培养基”)和First-Strand cDNA synthesis M-MLV Kit购于Invitrogen公司(美国);E.Z.N.A. EndoFree Plasmid Mini Kit购于Omega公司(美国);LipofectamineTM2000购于Invitrogen公司(美国);Opti-MEM®Ⅰ Medium购自Gibco公司(美国);TRIzol®Reagent购自Invitrogen公司(美国)。PCR引物由生工生物工程(上海)股份有限公司合成。反转录普通PCR仪(SENSOR)、荧光定量PCR仪(CFX96)购自BIO-RAD公司(美国);低速离心机和高速离心机、细胞培养箱购自Thermo公司(美国);倒置相差显微镜购自OLYMPUS公司(日本);倒置荧光显微镜IX-73购自 OLYMPUS公司(日本);NanoDrop 2000分光光度计购自Thermo Scientific公司(美国)。
二、LC3点聚集示踪细胞自噬模型的建立
(一)PMA诱导THP-1细胞分化
根据细胞生长状态和形态取2~4代细胞进行实验。收集形态典型、生长状态良好的THP-1进行实验[THP-1细胞呈单个圆形悬浮,密度约(5~10)×106/ml,分布均匀,折光度较好]。THP-1细胞使用含有10%胎牛血清、1%谷氨酰胺、1%双抗(青霉素和链霉素配制)的1640培养基,在37 ℃、5% CO2的细胞培养箱内培养,每12~16 h观察一次。待细胞到达对数生长期时(培养约24~36 h后),用1640培养基调整细胞浓度为6×105个/孔接种于6孔板中,加入PMA,调整PMA最终浓度依次为0、10、20、50、100、200 ng/ml,最后补充1640培养基至2 ml,以0 ng/ml PMA孔作为阴性对照孔。培养24 h后观察各孔细胞贴壁、形态变化情况并摄影。当细胞形态由单个圆形悬浮细胞,逐渐变为贴壁、形态不规则并伸出伪足,综合观察比较各孔分化形态和分化比例,以确定PMA诱导THP-1分化的优化浓度,以分化细胞比例大的和巨噬细胞形态典型的为优。确定最优PMA浓度后,使用此PMA浓度分别诱导THP-1细胞0、24、48、60 h后再次观察各孔细胞形态变化并摄影,综合观察比较各孔分化形态和分化比例,以确定PMA诱导THP-1分化的优化作用时间,其中0 h作用孔作为阴性对照孔。细胞培养严格无菌操作,若有污染则弃去细胞,重新复苏。
(二)细胞的转染与筛选
1.YFP-LC3质粒DNA的制备:首先使用本室保存的构建好的质粒(pcDNA3.1-YFP-LC3质粒)转化感受态细菌DH5α,然后将转化的感受态细菌DH5α均匀涂在含卡那霉素的LB固体琼脂培养基上,干燥后,倒置平板,37 ℃恒温培养12~16 h。挑取单克隆菌落经鉴定后进行扩大培养。收集菌液,使用去内毒素法,按照E.Z.N.A. EndoFree Plasmid Mini Kit说明书步骤提取YFP-LC3质粒,NanoDrop 2000分光光度计测定浓度,-20 ℃保存备用。YFP为黄绿色荧光蛋白,本研究用表达融合蛋白YFP-LC3质粒转染细胞,以示踪自噬体的形成。
2.THP-1细胞的转染:脂质体法转染YFP-LC3质粒至THP-1细胞。使用无抗生素培养基以2.5×105个/孔密度接种THP-1细胞至24孔细胞培养板,加入培养基至500 μl。使用100 ng/ml的PMA诱导THP-1细胞48 h,设置未加入PMA孔作为阴性对照。当细胞形态由单个圆形悬浮细胞,逐渐变为贴壁、形态不规则并伸出伪足,认为THP-1已分化为巨噬细胞。当细胞分化为贴壁的巨噬细胞、判断贴壁细胞占孔板达到90%~95%时进行后续操作。具体的操作严格按照脂质体转染试剂LipofectamineTM2000的操作说明书进行。
(三)细胞自噬的检测
1.YFP-LC3点聚集示踪自噬体的形成:Earle’s balanced salts solution(EBSS,又称饥饿培养基),可诱导多种细胞发生自噬。将细胞进行如下处理:先用优化的PMA作用浓度和作用时间诱导THP-1分化为巨噬细胞,再分别收集未转染YFP-LC3质粒THP-1细胞、转染YFP-LC3质粒THP-1细胞及转染后用EBSS处理的THP-1细胞(即用饥饿培养基培养2 h后,再换成普通培养基),利用荧光显微镜观察黄绿色荧光及YFP-LC3点聚集在细胞中的分布情况并摄影。
2.RT-qPCR检测自噬相关基因:收集上述三组细胞,PBS洗2次后,使用TRIzol®Reagent裂解细胞,具体操作严格按照TRIzol®Reagent说明书步骤进行。以 NanoDrop 2000分光光度计进行浓度测定和纯度判断,A260/280在1.9~2.1之间,可认为RNA纯度较好[5]。根据First-Strand cDNA synthesis M-MLV Kit说明书进行cDNA的合成,使用20 μl反应体系,以β-actin和GAPDH作为内参扩增相关基因(引物序列见表1),其中β-actin、GAPDH、LC3基因上下游引物用Primer Premier 5.0软件设计,Beclin1、Atg5、Atg7基因上下游引物参考文献[9]进行设计。反应步骤为: 94 ℃,2 min预变性;94 ℃,15 s变性;58 ℃,30 s退火;68 ℃,1 min延伸,共40个循环。使用比较Ct值法(2-ΔΔCt)方法进行mRNA表达差异分析。自噬相关基因LC3、Beclin1、Atg5、Atg7基因mRNA的表达增加,可在一定程度上提示自噬通量增强。

表1 不同目的基因的荧光定量PCR引物序列
注F:正向引物;R:反向引物
(四)数据的统计学处理
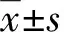
三、相关定义
1.自噬通量:指自噬的完整过程,包括底物向溶酶体的传送及其后续分解和回收利用等。
2.比较Ct值法:Ct值法是基因表达调控研究中最常用的两种相对定量方法之一。该方法同时扩增目的基因片段和内参基因片段,一般设 1~2个内参基因。比较Ct值法与标准曲线法的相对定量的不同之处在于其运用了数学公式来计算相对量,前提是假设每个循环增加1倍的产物数量,在PCR反应的指数期得到Ct值来反应起始模板的量,一个循环的不同相当于起始模板数2倍的差异[10]。测得两者的Ct值之差,即2-ΔΔCt。通过扩增标准曲线判断扩增效率,通过数学公式来计算相对量。本研究通过比较 Ct值法的相对定量来评价细胞自噬相关基因mRNA表达量的变化。
结 果
一、THP-1诱导分化的条件优化
为获得THP-1源性巨噬细胞(MΦ),本研究优化了THP-1细胞分化成MΦ的诱导条件。笔者采用0、10、20、50、100、200 ng/ml不同浓度PMA诱导分化细胞24 h,并用同一浓度PMA诱导THP-1细胞0、24、48、60 h(图1,2)。结果显示,未加入诱导剂PMA时,观察细胞形态无明显变化,即几乎没有细胞被诱导分化贴壁(图1A,图2A);随着PMA诱导浓度增加,THP-1分化为MΦ比例增多,即细胞形态由单个圆形悬浮细胞,逐渐变为贴壁、形态不规则并伸出伪足(图1B~E)。同一浓度PMA刺激时,随着诱导时间的增加,贴壁细胞增多(图2B~D)。综合分析发现,在PMA浓度为100 ng/ml和诱导时间24~48 h之间时,细胞贴壁最多,形态不规则且伪足明显,即巨噬细胞样细胞状态最理想(图3),故选择此条件为PMA诱导THP-1细胞分化的最佳条件。
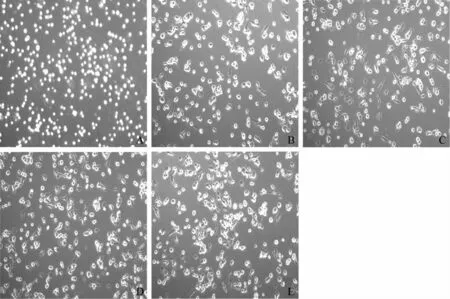
A:0 ng/ml(对照组);B:20 ng/ml;C:50 ng/ml;D:100 ng/ml;E:200 ng/ml图1 倒置显微镜观察不同浓度PMA诱导THP-1 24 h的分化情况(直接可见光下观察,×100)
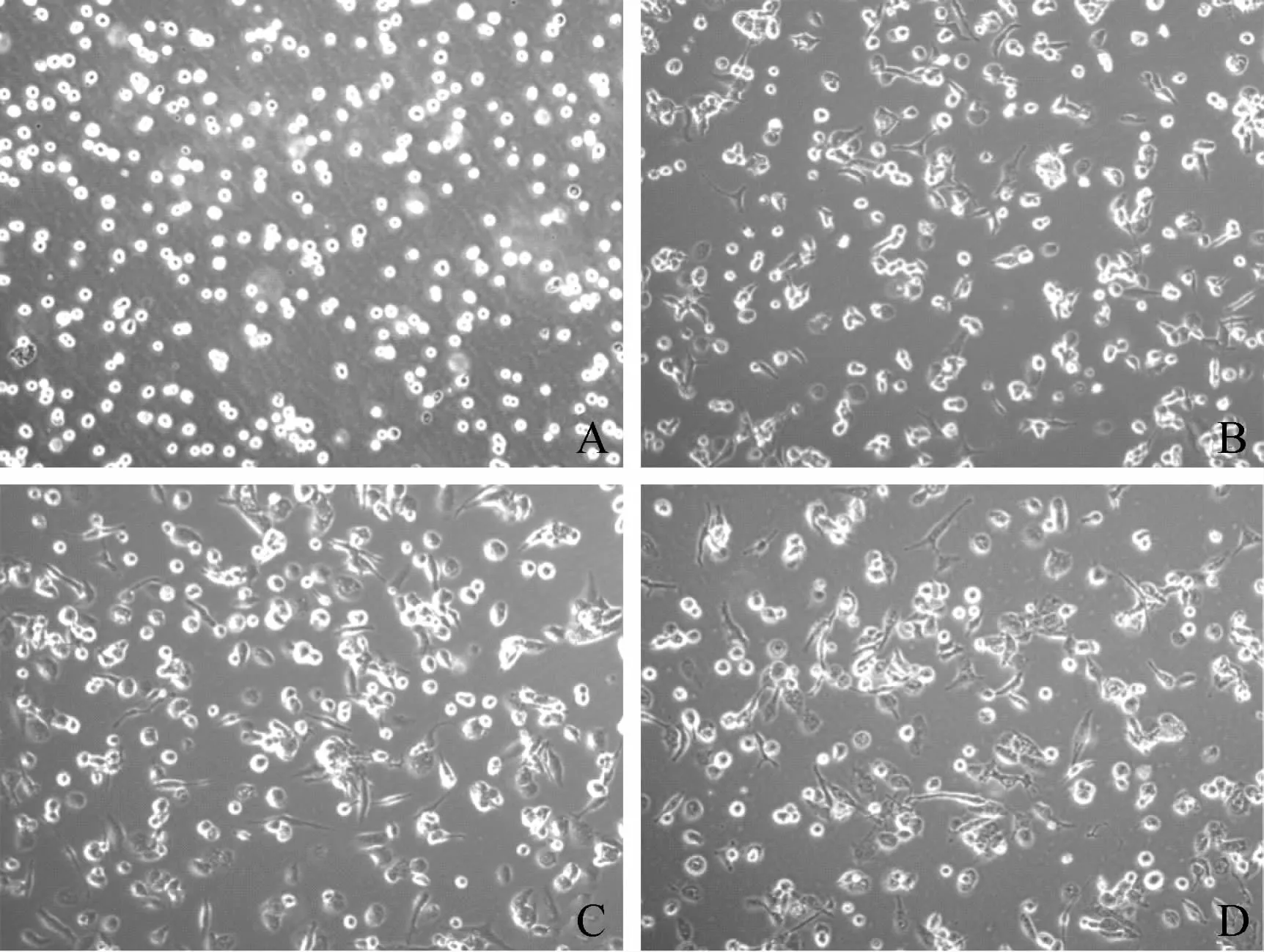
A:0 h(对照组);B:12 h;C:48 h;D:60 h图2 倒置显微镜观察100 ng/ml PMA诱导THP-1不同作用时间的分化情况(直接可见光下观察,×100)
二、荧光显微镜观察YFP-LC3质粒转染至THP-1源性MΦ
结果显示,未转染YFP-LC3质粒的细胞未见荧光发出,而转染YFP-LC3质粒的巨噬细胞可见荧光发出,说明YFP-LC3质粒已成功转染至THP-1源性的巨噬细胞,可用于后续示踪自噬的检测(图4 A、B)。THP-1分化的MΦ经EBSS处理后,LC3点聚集现象增强,提示EBSS增加了自噬通量(图4C)。
三、RT-qPCR检测EBSS诱导MΦ后LC3、Atg5、Atg7、Beclin1的mRNA表达水平
使用EBSS诱导细胞后,用RT-qPCR检测自噬相关基因的mRNA表达水平,以检测EBSS是否可诱导THP-1源性巨噬细胞发生自噬。结果提示,EBSS处理PMA诱导THP-1分化的巨噬细胞后,自噬相关基因LC3、Atg5、Atg7、Beclin1的mRNA表达水平显著增加, 2-ΔΔCt值均值分别为1.35±0.16、1.18±0.39、1.44±0.12、1.08±0.09,(t值分别为4.00、2.90、5.16、3.57,P值均<0.05)(图5),说明EBSS能明显诱导THP-1源性MΦ细胞的自噬过程。

PMA浓度为100 ng/ml和诱导时间24~48 h之间时,细胞贴壁最多,形态不规则且伪足明显,即巨噬细胞样细胞状态最理想图3 倒置显微镜观察100 ng/ml PMA诱导THP-1分化的巨噬细胞(直接可见光下观察,×100)
讨 论
“自噬”的概念由比利时科学家Christian de Duve 在1963年溶酶体国际会议上首先提出,是指细胞受到刺激后吞噬自身的细胞质或细胞器, 最终将吞噬物在溶酶体内降解的过程。广义上的自噬包括巨自噬 (macroautophagy)、微自噬(micro-autophagy)和分子伴侣介导的自噬(chaperone- mediated autophagy,CMA)3种类型,通常所说的自噬指巨自噬。THP-1,即人类急性单核细胞白血病细胞,可被PMA诱导分化为MΦ,形态上由单个圆形的悬浮细胞分化为贴壁生长、形态不规则且伸出伪足的MΦ样细胞[6]。THP-1源性MΦ属于人类细胞系,是研究炎症相关巨噬细胞功能的经典细胞模型,也是研究Mtb与宿主细胞相互作用的常用细胞株[11-13],且已用于结核分枝杆菌感染中自噬作用的研究[14-15]。然而,虽然由THP-1诱导分化的巨噬细胞是重要的工具细胞,但已往文献报道中关于诱导剂PMA的诱导浓度和诱导时间存在较大差异,导致诱导条件不一致。PMA的诱导浓度从50~200 ng/ml不等,诱导时间跨度也达12~72 h,这可能受实验中THP-1培养状态、所用PMA的质量和纯度等的影响[6,12-13],但THP-1诱导分化条件的不确定性,常常导致研究者对研究结果的质疑,甚至引起同行争议。因此,对THP-1细胞诱导分化条件的优化是当前研究亟需解决的问题,统一、可靠的诱导条件是进行后续科学研究的坚实基础。本研究在前人研究的基础上,优化了PMA对THP-1细胞的诱导分化条件,通过综合分析PMA在不同诱导浓度和诱导时间下对THP-1的诱导作用,发现100 ng/ml的PMA诱导THP-1细胞24~48 h后分化形成的MΦ形态特征明显,且状态较好。因此,确定100 ng/ml PMA作用24~48 h是最佳诱导条件。
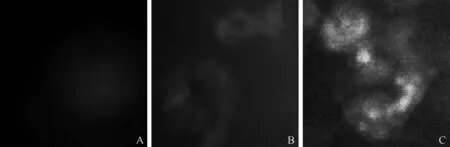
A:未转染YFP-LC3质粒的MΦ,B:转染YFP-LC3质粒的MΦ,C:EBSS处理转染YFP-LC3质粒的MΦ图4 荧光显微镜观察YFP-LC3质粒转染至THP-1源性MΦ的情况(×100)

图5 EBSS处理THP-1源性MΦ后自噬相关基因LC3、Atg5、Atg7、Beclin1的mRNA表达水平变化(t值分别为4.00、2.90、5.16、3.57,P值均<0.05)
在此诱导条件下,笔者还构建了EBSS诱导THP-1源性MΦ的自噬模型,通过荧光显微镜观察YFP-LC3点聚集示踪自噬,发现经EBSS培养基处理后,细胞发生自噬并增加了自噬通量。RT-qPCR对自噬相关基因(LC3、Atg5、Atg7、Beclin1)mRNA的表达水平进行检测,发现由EBSS处理后的MΦ细胞中自噬相关基因mRNA表达水平明显增加。以上实验结果均提示EBSS可增加THP-1源性MΦ的自噬通量。这部分实验中有关键的两点,分别是PMA的质量和THP-1的生长状态。对于诱导剂PMA,本研究采用的是Sigma的产品,制成的工作液避光保存于-20 ℃冰箱并在1个月内用完。本研究中发现,只要操作者有熟练的细胞培养经验,选取对数生长期的细胞和合格质量的PMA就能以稳定的诱导条件得到巨噬细胞。
总之,本研究结合已有文献报道,优化了PMA诱导THP-1细胞分化的条件,为后续相关实验提供了可靠的诱导条件。除此之外,笔者还构建了较理想的自噬模型,为基于细胞自噬模型进行的实验提供了科学依据。例如研究以细胞免疫为主的相关疾病的致病机制、机体免疫机制,常见应用于传染性疾病(结核病等)、肿瘤等相关疾病的研究。
[1] Meijer WH,Van der Klei IJ,Veenhuis M,et al.ATGgenes involved in non-selective autophagy are conserved from yeast to man, but the selective Cvt and pexophagy pathways also require organism-specific genes. Autophagy,2007, 3(2):106-116.
[2] Li CM,Campbell SJ, Kumararatne DS,et al.Association of a polymorphism in theP2X7 gene with tuberculosis in a Gam-bian population.J Infect Dis, 2002,186(10):1458-1462.
[3] Xie Z, Klionsky DJ. Autophagosome formation: core machinery and adaptations. Nat Cell Biol,2007, 9(10): 1102-1109.
[4] Deretic V, Levine B. Autophagy, immunity, and microbial adaptations. Cell Host Microbe,2009, 5(6):527-549.
[5] Huang J, Klionsky DJ. Autophagy and human disease. Cell Cycle, 2007, 6(15):1837-1849.
[6] Daigneault M, Preston JA, Marriott HM,et al. The identification of markers of macrophage differentiation in PMA-stimulated THP-1 cells and monocyte-derived macrophages. PLoS One,2010, 5(1): e8668.
[7] Choi AM, Ryter SW, Levine B. Autophagy in human health and disease. N Engl J Med, 2013,368(7): 651-662.
[8] Klionsky DJ, Cregg JM, Dunn WA Jr,et al. A unified nomenclature for yeast autophagy-related genes. Dev Cell, 2003, 5(4): 539-545.
[9] Kiyono K, Suzuki HI, Matsuyama H,et al. Autophagy is activated by TGF-beta and potentiates TGF-beta-mediated growth inhibition in human hepatocellular carcinoma cells. Cancer Res,2009, 69(23): 8844-8852.
[10] 赵焕英,包金风.实时荧光定量PCR技术的原理及其应用研究进展.中国组织化学与细胞化学杂志,2007,16(4):492-497.
[12] Iona E, Pardini M, Gagliardi MC, et al. Infection of human THP-1 cells with dormantMycobacteriumtuberculosis. Microbes Infect,2012, 14(11): 959-967.
[13] Riendeau CJ, Kornfeld H. THP-1 cell apoptosis in response to Mycobacterial infection. Infect Immun,2003,71(1): 254-259.
[14] Harris J, De Haro SA, Master SS, et al. T helper 2 cytokines inhibit autophagic control of intracellularMycobacteriumtuberculosis. Immunity,2007, 27(3): 505-517.
[15] Dutta RK, Kathania M, Raje M, et al. IL-6 inhibits IFN-γ induced autophagy inMycobacteriumtuberculosisH37Rv infected macrophages. Int J Biochem Cell Biol,2012, 44(6): 942-954.
——一道江苏高考题的奥秘解读和拓展

