布鲁氏菌磷酸葡萄糖变位酶基因的原核表达与鉴定
张豫,张辉,张艳,陈瑞花,王震,桂丹,孙志华,陈创夫
(石河子大学动物科技学院/新疆地方病与民族高发病教育部重点实验室,石河子 832003)
布鲁氏菌病又称地中海弛张热,波浪热,是一种人畜共患传染病,世界范围内广泛流行。该病在我国发病率较高,严重危害人类健康和畜牧业发展。该病的病原为布鲁氏菌,是革兰阴性菌,属于蛋白细菌ɑ-亚组,与立克次体、土壤杆菌、根瘤菌关系密切。布鲁氏菌无典型的外毒素,其毒力主要表现在侵袭力和繁殖力。人感染后常表现为持续性感染,造成生殖系统的损伤;动物感染后,母畜易造成流产,公畜则引起睾丸炎[2]。近几年,布鲁氏菌病的人畜疫情有逐年上升的趋势,人感染该病菌的病例也时有发生[3]。毒力蛋白对于病原菌的毒力至关重要,在其侵袭和繁殖过程中起到不可或缺的作用。布鲁氏菌细胞的毒力蛋白具有干扰巨噬细胞抗原递呈活性、避免引起巨噬细胞完全的炎性和抗菌反应以及最终的天然和特异性免疫反应,从而使布鲁氏菌逃避宿主的免疫反应。因此,研究布鲁氏菌毒力蛋白侵染宿主细胞的机制非常有必要。
布鲁氏菌分为光滑型和粗糙型2种表现型,一般光滑型菌株要比粗糙型菌株的毒力强,感染光滑型布鲁氏菌的动物能够产生抗脂多糖(LPS)的O链抗原,而LPS是布鲁氏菌病诊断的主要抗原[4]。布鲁氏菌pgm基因编码的磷酸葡萄糖变位酶与光滑型布鲁氏菌脂多糖O链的合成相关,是布鲁氏菌重要的毒力因子之一[5]。
本研究对pgm蛋白进行表达与纯化并研究其免疫反应性,为进一步研究该蛋白的功能提供基础物质,同时也为进一步开发基因工程疫苗奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌E.coli DH5a和E.coli BL21(DE3)感受态细胞,均购自天根生化(北京)科技有限公司;pET-28a(+)质粒、布鲁氏菌疫苗株 M5-90均由本实验室保存。
1.1.2 主要试剂
Taq DNA聚合酶、琼脂糖凝胶DNA回收试剂盒均购自天根生化(北京)科技有限公司;限制性内切酶EcoR I和Sal I、DNA Marker、pMD18-T simple载体连接试剂盒购自TaKaRa公司;辣根过氧化物酶标记兔抗羊IgG-HRP、蛋白Marker均购自上海生工生物工程技术服务有限公司;布鲁氏菌阳性血清由本实验室保存。
1.2 方法
1.2.1 引物设计与合成
根据布鲁氏菌参考株16M的pgm基因序列设计引物,上游引物含有限制性内切酶EcoRⅠ,下游引物含有SacⅠ酶切位点。
P1:5′-GAATTCCCGATTGAAACGAACGGGAAC-3′;
P2:5′-GTCGACGGGAATAGGGGAATAAG GGAGT-3′。
引物由上海生工生物工程技术服务有限公司合成。
1.2.2 目的基因PCR扩增及产物的纯化
以热灭活布鲁氏菌疫苗株 M5-90为模板,用PCR方法扩增得到pgm基因片段。
在20.0μL PCR反应的体系中加入:10×反应缓冲液(含15.0mmol/L MgCl2)2.0μL,dNTP(各2.5mmol/L)0.8μL,上游引物P1(25μmol/L)0.2 μL,下游引物 P2 (25μmol/L)0.2μL,模板1.0 μL,Taq DNA聚合酶(2.5U/μL)0.5μL,补水至20.0μL;PCR反应条件:95℃4min;94℃40s,57℃40s,72℃2min,30个循环;最后72℃延伸7 min。PCR产物进行1.5% 琼脂糖凝胶电泳分析,并以琼脂糖凝胶DNA回收纯化试剂盒进行纯化,操作方法按产品说明书进行。
1.2.3 pMD18-T-pgm的构建及鉴定
将纯化的PCR产物与pMD18-T simple载体4℃连接过夜后,转化E.coli DH5a感受态细胞。37℃,摇菌培养过夜后提取质粒,用PCR和EcoR I、Sal I双酶切方法鉴定pMD18-T-pgm重组质粒,对鉴定正确的质粒送北京华大基因公司进行DNA测序分析。
1.2.4 pET28a-pgm重组表达质粒的构建
分别将pET-28a(+)质粒和pMD18-T-pgm 质粒用EcoR I和Sal I双酶切,分别回收pET-28a(+)载体片段和pgm基因片段。将pET-28a(+)载体片段和pgm基因片段4℃连接过夜后,转化E.coli BL21(DE3)感受态细胞。37℃,摇菌培养过夜后提取质粒,用PCR和EcoR I、Sal I双酶切方法进行鉴定。
1.2.5 重组pgm蛋白的诱导表达、检测及纯化
1.2.5.1 重组pgm蛋白的诱导表达
将鉴定正确的阳性重组菌在液体培养基中培养,37℃培养至OD600nm=0.6左右时,加入IPTG至终浓度为1.0mmol/L进行诱导表达。分别于0、2、4和6h取样,进行SDS-PAGE电泳分析。
1.2.5.2 重组pgm 蛋白的纯化
重组蛋白纯化操作按Ni-NTA Agarose试剂盒说明书进行。将沉淀的菌体重悬于裂解液中,超声破碎-冻溶处理4次;超声破碎每次10s,间歇10s,90次/周期。4℃,12000r/min离心20min,收集上清,按4∶1的比例加入Ni-NTA琼脂糖珠,低温摇床结合60min后用漂洗缓冲液Buffer C漂洗Ni-NTA琼脂糖珠3~5次;最后用漂洗缓冲液Buffer D对琼脂糖珠进行洗脱3~5次,收集洗脱液,进行SDS-PAGE电泳检测。
1.2.5.3 Western blot检测
使用半干式电转印仪,将SDS-PAGE凝胶上的蛋白样品转印到NC膜上;用Western blot膜封闭液进行封闭,37℃作用1h;TBST洗涤3次,每次10min,加入1∶500稀释的布鲁氏菌阳性血清,37℃作用1h;TBST洗涤3次,加入1∶5000稀释的辣根过氧化物酶(HRP)标记的兔抗羊IgG,作用1 h,TBST洗涤3次,加入DAB底物显色液进行显色反应,用水终止反应。
2 结果与分析
2.1 目的基因的PCR扩增
以羊种布鲁氏菌M5-90株的基因组DNA为模板,进行PCR扩增,琼脂糖凝胶电泳结果显示与pgm基因(1632bp)大小相符,约1630bp核酸条带(图1)。

图1 pgm基因的PCR扩增Fig.1 Amplification of pgm gene by PCR
2.2 pMD18-T-pgm的PCR及酶切鉴定
用PCR方法获取pgm基因片段后,将其克隆到pMD18-T simple载体中,转化E.coli DH5a,提取质粒,用PCR方法和限制性内切酶EcoR I和Sal I双酶切方法鉴定,DNA序列测定结果表明,扩增所获得的pgm基因片段与GenBank登录的pgm基因序列同源率为99.69%。
2.3 pET28a-pgm重组表达质粒的构建及鉴定
pET-28a(+)质粒和pMD18-T-pgm 重组质粒分别经EcoR I和Sal I双酶切,回收目的片段4℃连接后,转化入E.coli BL21(DE3)感受态细胞。提取的重组质粒用PCR方法可扩增到约1630bp的目的条带;限制性内切酶EcoR I和Sal I双酶切分别得到1条约1630bp的目的条带以及1条约5300 bp的pET-28a(+)载体片段(图2)。

图2 pET28a-pgm质粒酶切鉴定Fig.2 Identification of pET28a-pgm by restriction endonuclease digestion
2.4 重组蛋白pgm的诱导表达
将鉴定正确的含有pET28a-pgm 的E.coli BL21(DE3)经IPTG诱导表达;分别于0、2、4和6h进行取样,进行12%SDS-PAGE电泳分析,结果发现重组蛋白pgm的相对分子质量为64ku,大小与预期的蛋白质分子量基本一致(图3)。
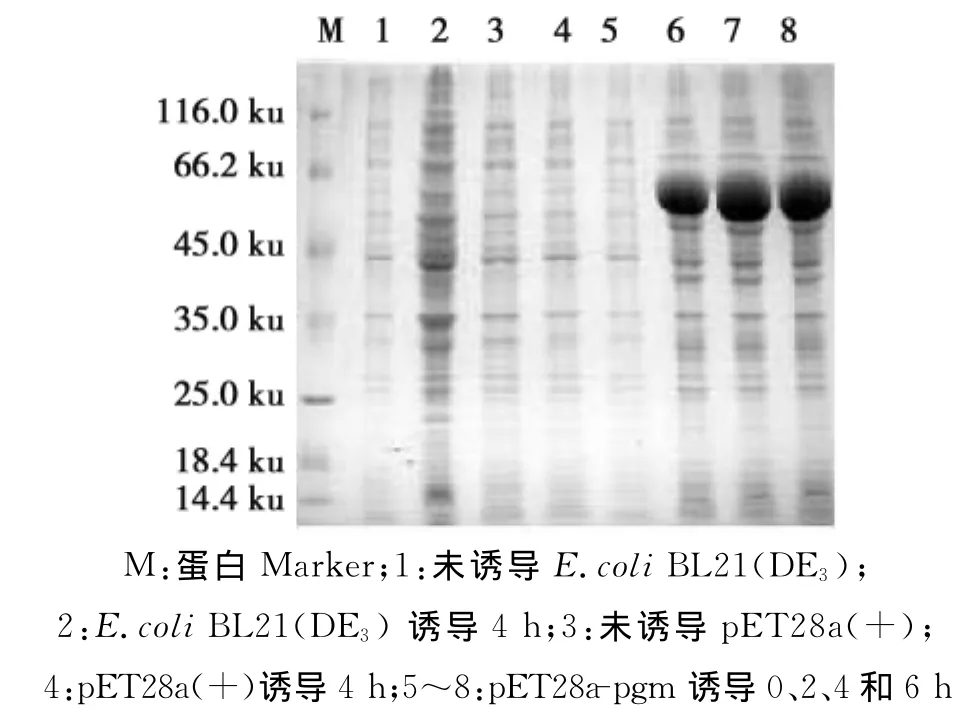
图3 重组蛋白pgm的SDS-PAGE分析Fig.3 SDS-PAGE analysis of expressed pgm fusion protein
2.5 重组蛋白pgm的纯化及Western blot分析
采用QIANGEN公司的Ni-NTA亲和纯化试剂盒对重组融合蛋白进行纯化,将收集的洗脱液进行SDS-PAGE电泳检测,在约64ku处可见纯化的pgm融合蛋白条带(图4);Western blot结果(图4)显示,表达的重组蛋白pgm具有良好的免疫反应性。

图4 重组蛋白pgm的纯化及Western blot鉴定Fig.4 Purification of WboA fusion protein and identification by Western blot
3 讨论
布鲁氏菌是一种兼性胞内寄生的革兰氏阴性菌,是我国35种法定传染病中的乙类传染病,被列为“家畜家禽防疫条例实施细则”中二类传染病之首[6]。目前,疫苗接种是预防该病的主要手段,但是目前使用的疫苗毒力强、容易引起怀孕母畜的流产、无法区分自然感染和疫苗免疫[7]等缺陷,使得该疫苗的应用受到很大限制。因此,研究布鲁氏菌的毒力因子的功能,研发布鲁氏菌病新型疫苗成为目前控制布鲁氏菌病的关键。
布鲁氏菌不分泌外毒素,脂多糖在维持布鲁氏菌外膜结构完整和稳定方面起着重要作用,是重要的布鲁氏菌主要毒力因子[8]。布鲁氏菌pgm基因编码磷酸葡萄糖变位酶,是装配形成LPS的必需酶。此基因的缺失将导致光滑型布鲁氏菌的LPS无法合成,从而使免疫动物体内不产生抗LPS抗体,导致其血清不与凝集抗原发生凝集反应,使检测结果为阴性[9]。将布鲁氏菌S19的pgm基因敲除后,动物试验结果表明,其免疫保护性和亲本株S19相当[10]。pgm基因的缺失可能影响细胞壁的其它附件的合成,比如像β环状葡聚糖的合成[9]。本实验对布鲁氏菌pgm基因的原核表达及纯化,证实该基因具有较好的免疫反应性,具备了作为免疫学活性抗原的潜力和优势,这为疫苗的开发和免疫学检测方法的建立提供了候选抗原,同时也为进一步研究该基因的功能提供了物质基础。
[1]毛景东,王景龙,杨艳玲.布鲁氏菌病的研究进展[J].中国畜牧兽医,2011,38(1):222-227.
[2]Related Articles,Links Greenfield R A,Drevets D A,et al.Bacterial pathogens as biological weapons and agents of bioterrorism[J].American Journal of the Medical Sciences,2002,323:299-315.
[3]张艳,陈创夫,张辉,等.布鲁氏菌 WboA基因的原核表达与鉴定[J].石河子大学学报:自然科学版,2011,29(2):190-193.
[4]王加兰,胡森,郑孝辉,等.光滑型布鲁氏菌LPS单克隆抗体的制备及鉴定[J].中国预防兽医学报,2009,31(8):642-645.
[5]Patrícia Gomesc Ardoso,Gilson Costa Macedo,Vasco Azevedo,et al.Brucella spp.noncanonical LPS:structure,biosynthesis,and interaction with host immune system[J].Microb Cell Fact,2006,5:13.
[6]王震,张辉,张艳,等.布鲁氏菌磷酸葡萄糖变位酶对胚胎滋养层细胞的致炎作用[J].微生物学报,2012,52(8):1040-1048.
[7]A Khalaf S A,Taha M B,Nicoletti P.Control of brucellosis in Kuwait by vaccination of cattle,sheep and goats with Brucella abortus strain 19or Brucella melitensis strain Rev1.Trop[J].Anim Health Prod,1992,24:45-49.
[8]尚德秋,李玉兰.布氏菌分子生物学研究现状[J].中国地方病防治杂志,2005,20(5):272-276.
[9]Juan Esteban Ugalde,Diego JoséComerci,Susana Leguizamón M,et al.Evalution of Brucella abortus phosphoglucomutase(pgm)mutant as a new live rough-phenotype vaccine[J].Infect Immun,2003,71(11):6264-6269.
[10]闫广谋,王兴龙,任林柱,等.布鲁氏菌分子标记、毒力缺失疫苗株△S19-2的构建[J].中国兽医学报,2007,27(5):690-694.

