结核分枝杆菌小分子热休克蛋白Hsp16.3基因缺失突变菌株对感染小鼠肺泡巨噬细胞凋亡率的影响及其时相性变化
庹清章,董江涛,田玺择,刘云霞,董伟杰,刘丹霞,李微,吴芳,章乐,张万江
(石河子大学医学院病理生理学教研室/新疆地方与民族高发病教育部重点实验室,石河子 832002)
结核病是由结核分枝杆菌(Mycobacterium Tuberculosis)引起的一种世界性传染病,也是单一致病菌感染导致死亡率最高的感染性疾病。结核分枝杆菌感染人体后,主要被宿主巨噬细胞吞噬,未被机体免疫系统清除而潜伏下来的结核分枝杆菌,也主要寄生于宿主巨噬细胞内。近期研究发现,结核分枝杆菌小分子热休克蛋白Hsp16.3对结核分枝杆菌在宿主巨噬细胞中的潜伏扮演着重要作用,因此对敲除Hsp16.3基因而得到的结核分枝杆菌突变菌株在感染的不同时期宿主巨噬细胞凋亡率的研究,可为深入探讨结核分枝杆菌小分子热休克蛋白Hsp16.3在感染宿主巨噬细胞中的作用奠定基础,从而为结核病的发病机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
8周龄SPF级(无特定病原体动物)昆明小鼠,雌雄各半,共160只,体重(18~20)g,购于石河子大学实验动物中心。
1.1.2 菌种
结核分枝杆菌H37Rv和卡介苗(BCG)菌株购于中国药品生物制品检定所,结核分枝杆菌H37Rv株Hsp16.3基因缺失突变株(△H37Rv)和卡介苗菌株Hsp16.3基因缺失突变株(△BCG)由本课题组提供。
1.1.3 主要试剂
Mycobacterium Tuberculosis 65kD antibody(只针对结核分枝杆菌的65kD的小鼠单克隆抗体)、FITC荧光标记的二抗(山羊抗小鼠)、Annexin V-FITC/PI调亡检测试剂盒(美国Biovision公司)。
1.1.4 主要仪器
激光共聚焦显微镜、流式细胞仪(德国Partec-PAS)、生物安全柜等。
1.2 方法
1.2.1 实验动物分组
实验动物随机分为H37Rv菌株组、△H37Rv菌株组、BCG组和△BCG组。每组40只,不同时间段各设5只。
1.2.2 结核病小鼠模型的建立
方法参见文献[1]:在生物安全柜内,取在改良罗氏培养基上生长2~3周状态良好的结核分枝杆菌菌落,置灭菌研菌器中,加少量含0.05%Tween-20的生理盐水溶液充分研磨,使其成均匀浑浊的菌悬液。麦氏比浊法调细菌浓度约1.0×107CFU/mL。将各组不同菌悬液经小鼠尾静脉分别注射到对应分组的每只小鼠体内,注射量为0.3mL(约含活菌量3×106CFU/mL)。感染小鼠置生物安全三级实验室内,IVC笼具中饲养。
1.2.3 小鼠肺泡巨噬细胞的分离
小鼠于感染后第1、3、5、7、9、11、13、15d经眼球放血,脱颈处死,暴露气管,用消毒好的组织剪在气管上做一切口(切勿剪断),用连有注射器的无菌软皮管从切口处插入气管,丝线固定,用预热至37℃的PBS液行支气管肺泡灌洗,1.0mL×10次,收集支气管肺泡灌洗液,4℃1500r/min离心10 min,PBS液洗涤细胞1次。弃上清,加入含10%胎牛血清的DMEM培养液,转入细胞培养瓶中。置37℃、5%CO2孵箱中培养4h,弃上清液和非贴壁的细胞,贴壁的即为小鼠肺泡巨噬细胞。
1.2.4 激光共聚焦显微镜观察各组感染小鼠肺泡巨噬细胞
收集感染小鼠肺泡巨噬细胞,经爬片、固定、封闭后,滴加稀释后的一抗(稀释度1∶1500),均匀铺于玻片上,湿盒内放置,4℃过夜。PBS冲洗3min×3次,滴加荧光二抗(稀释度1∶500),室温2h,PBS冲洗干净,硝酸甘油封片,于激光共聚焦显微镜下观察荧光强度及着色部位。
1.2.5 小鼠肺泡巨噬细胞凋亡检测
收集各组、各时间点小鼠肺泡巨噬细胞,Annexin V-FITC/PI染色,1h内流式细胞仪检测细胞凋亡,Cellquest软件获取数据。
1.2.6 统计学分析
2 结果
2.1 应用激光共聚焦显微镜观察各组感染小鼠肺泡巨噬细胞
感染小鼠肺泡巨噬细胞内结核分枝杆菌膜上的热休克蛋白Hsp65与一抗(只针对结核分枝杆菌的65kD的小鼠单克隆抗体)结合,再与FITC(绿色荧光)标记的二抗结合。在激光共聚焦显微镜下,结核分枝杆菌四种类型菌株感染的小鼠肺泡巨噬细胞内均可见大量绿色荧光(图1),表明结核分枝杆菌4种类型菌株均被小鼠肺泡巨噬细胞大量吞噬。

图1 激光共聚焦显微镜检测感染小鼠肺泡巨噬细胞Fig.1 Detection of the infected mice alveolar macrophages by CLSM
2.2 结核分枝杆菌4种类型菌株分别感染小鼠后诱导小鼠肺泡巨噬细胞凋亡的流式细胞技术分析
经流式细胞技术检测,Cellquest软件分析得出细胞凋亡率(图2)和各时间点各感染组凋亡情况(表1)。根据检测结果,我们建立了结核杆菌感染小鼠肺泡巨噬细胞的凋亡率——时间曲线(图3)。
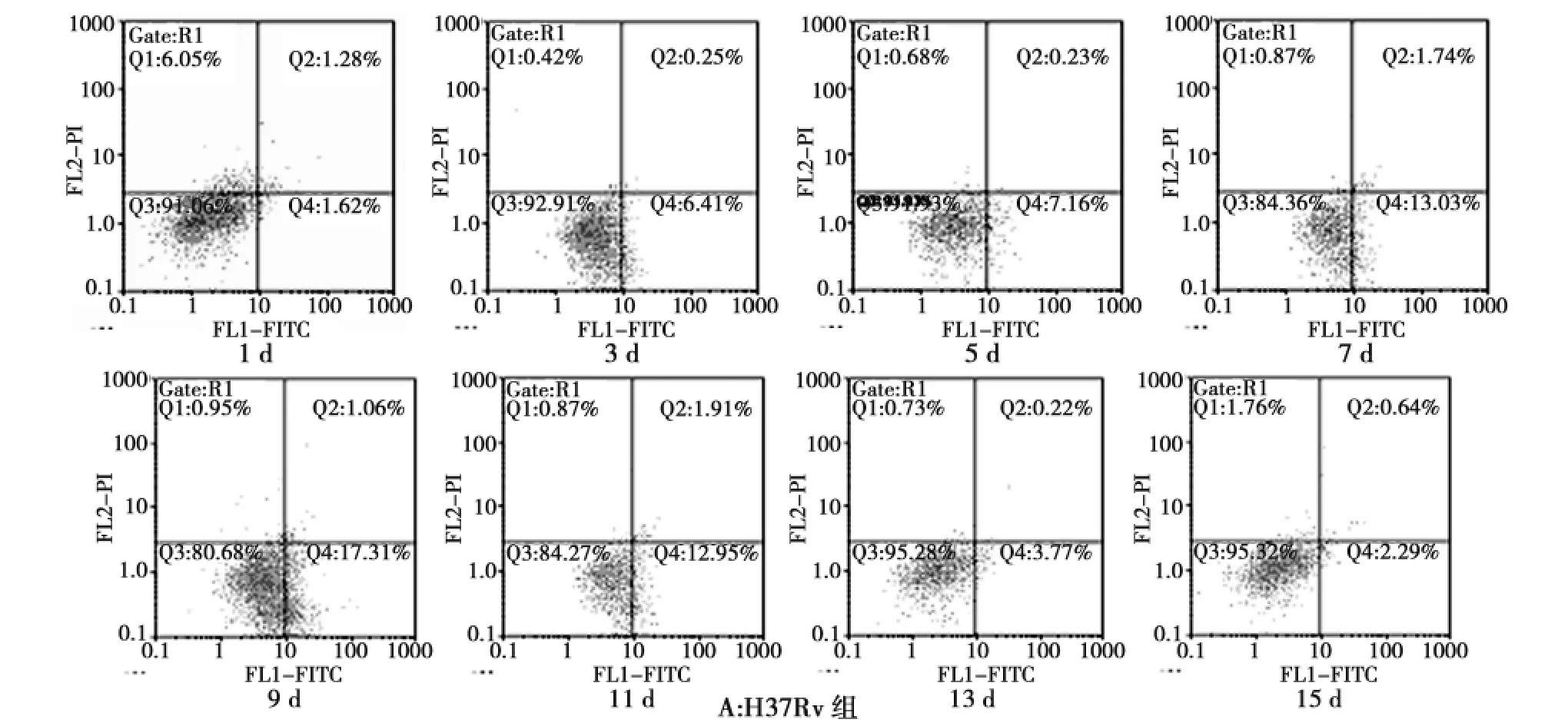
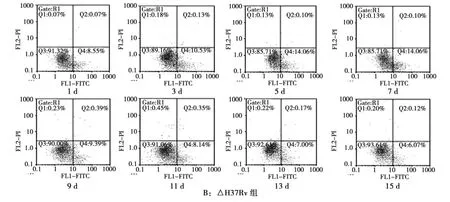

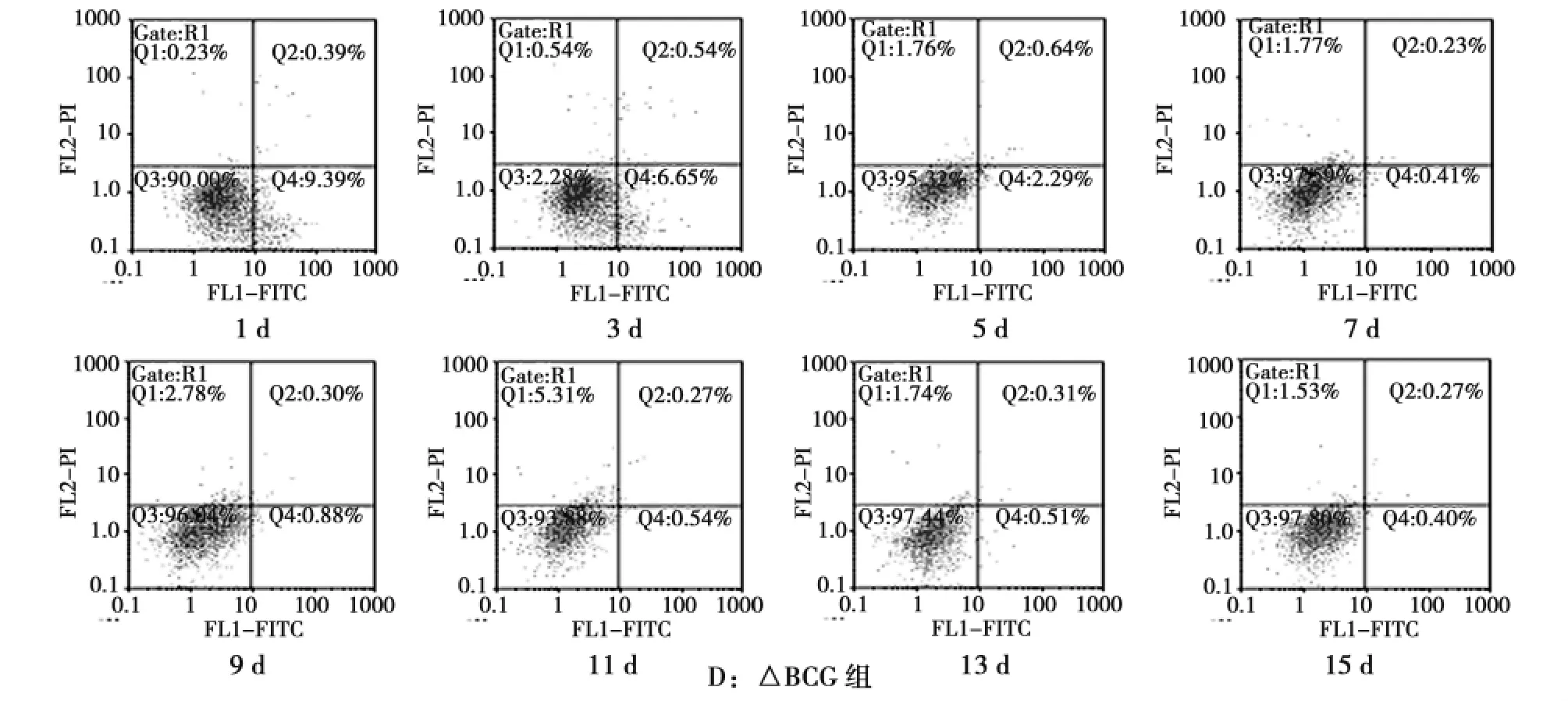
图2 巨噬细胞凋亡的流式图Fig.2 Time-dependent effect of the infected mice alveolar macrophage apoptosis
表1 各组不同时间点巨噬细胞凋亡情况 %,¯Tab.1 The apoptosis rate of macrophages at different time points in each group

表1 各组不同时间点巨噬细胞凋亡情况 %,¯Tab.1 The apoptosis rate of macrophages at different time points in each group
时间/d 数量 H37Rv △H37Rv BCG △BCG 1 5 1.68±0.28 8.64±0.38 0.60±0.09 9.46±0.43 3 5 6.46±0.39 10.79±0.43 0.84±0.22 6.75±0.63 5 5 7.19±0.34 14.39±1.15 1.63±0.97 2.40±0.36 7 5 12.80±0.56 17.77±0.44 1.49±0.77 0.44±0.11 9 5 17.41±0.68 9.25±0.35 2.49±0.72 0.89±0.11 11 5 12.61±1.53 8.22±0.35 1.13±0.99 0.55±0.06 13 5 3.38±1.28 7.00±0.19 1.16±0.28 0.52±0.04 15 5 2.23±0.18 6.06±0.16 0.57±0.12 0.41±0.05

图3 各组巨噬细胞凋亡率-时间曲线Fig.3 The relationship between apoptosis rate and infection time
从图3可以看出:
1)小鼠感染结核分枝杆菌H37Rv株Hsp16.3基因缺失突变株(△H37Rv)后,巨噬细胞的凋亡率逐渐上升,至感染7d时达到高峰,随后逐渐降低。
2)与H37Rv株感染组相比,1~7d内,各时间段△H37Rv菌株组巨噬细胞凋亡率均显著高于H37Rv菌株组,差异有统计学意义(P<0.05),随时间延长,巨噬细胞凋亡程度发生了逆转,9~11d内,△H37Rv菌株组巨噬细胞凋亡率低于H37Rv菌株组,而13~15d内,△H37Rv菌株组巨噬细胞凋亡率高于H37Rv菌株组,差异均有统计学意义(P<0.05)。
3)△BCG组凋亡率1~7d内呈现明显下降趋势,7d后巨噬细胞凋亡率变化趋于平稳,与BCG组相比,1~5d内,△BCG组凋亡率显著高于BCG组,差异有统计学意义(P<0.05),7~15d内,△BCG组与BCG组巨噬细胞凋亡率无明显差异。
3 讨论
结核分枝杆菌是典型的胞内致病菌,主要在巨噬细胞等宿主免疫系统的细胞内存活和繁殖。结核分枝杆菌感染人体后,主要被宿主巨噬细胞吞噬,未被机体免疫系统清除而潜伏下来的结核分枝杆菌,也主要寄生于宿主巨噬细胞内。宿主巨噬细胞在结核分枝杆菌与宿主相互作用的过程中具有重要作用,结核分枝杆菌感染的后果以及结核病的发生与否与宿主巨噬细胞密切相关[2]。宿主巨噬细胞发生凋亡后,可杀死寄生于其内的结核分枝杆菌,阻止结核分枝杆菌在体内的播散,并能激活邻近未感染的巨噬细胞,增强机体对结核分枝杆菌的杀伤能力[3]。因此,巨噬细胞的凋亡情况对于寄生于其中的结核分枝杆菌的命运至关重要。也正因如此,结核分枝杆菌要想成功地在宿主巨噬细胞中存活,就必须通过某些机制对宿主巨噬细胞的凋亡进程进行干预和调控[4]。
在结核分枝杆菌感染的过程中,结核分枝杆菌与宿主巨噬细胞相互作用及相互适应,可调控宿主巨噬细胞的调亡。一方面,结核分枝杆菌可诱导巨噬细胞凋亡;另一方面,结核分枝杆菌亦具有抑制巨噬细胞凋亡的作用,当这两种作用达到平衡时,结核分枝杆菌则以休眠状态存在于巨噬细胞中,形成所谓的“逃避”,使自身的存活、繁殖与宿主的一系列免疫反应达到一种动态平衡[5]。
结核分枝杆菌小分子热休克蛋白(sHSPs,small heat shock proteins)Hsp16.3是近年研究发现的结核分枝杆菌中一个存在于膜上的主要抗原蛋白,由144个氨基酸组成,相对分子质量为16277u,等电点为4.85,序列分析表明它属于sHsps家族。结核分枝杆菌小分子热休克蛋白Hsp16.3是一个组成性表达蛋白,正常条件下有少量表达[6],在结核分枝杆菌进入静止生长期时结核分枝杆菌小分子热休克蛋白 Hsp16.3显著表达[7-8]。
结核分枝杆菌小分子热休克蛋白Hsp16.3对结核分枝杆菌在宿主巨噬细胞中的潜伏扮演着重要作用,结核分枝杆菌进入巨噬细胞后大量表达合成结核分枝杆菌小分子热休克蛋白Hsp16.3;敲除Hsp16.3基因而得到的突变菌株在体外的生长情况与正常菌株相同,但突变菌株不能在鼠骨髓衍生的巨噬细胞以及 THP-1细胞株中生长[9-10],说明结核分枝杆菌小分子热休克蛋白Hsp16.3可能对结核分枝杆菌在巨噬细胞中的潜伏起着保护作用,同时有研究进一步证明,结核分枝杆菌进入宿主巨噬细胞时诱导大量表达的Hsp16.3对结核分枝杆菌能够在宿主巨噬细胞内长期生长、繁殖和致病扮演着重要作用,一方面有助于结核分枝杆菌细胞膜增厚,以及增强结核分枝杆菌抵抗胁迫环境,如NO、氧自由基、缺氧等因素的抗氧化能力等,同时使结核分枝杆菌在宿主巨噬细胞内转变成静止期,有助于结核分枝杆菌在宿主巨噬细胞内成为滞留菌,长期在宿主巨噬细胞内生长繁殖[11-12]。尽管发现结核分枝杆菌小分子热休克蛋白Hsp16.3对于结核分枝杆菌在宿主巨噬细胞内的生存是必需的,但是其在体内的生理功能以及相关的保护机制却并不知道[13-14]。
本次实验中,我们通过流式细胞技术动态检测结核分枝杆菌小分子热休克蛋白Hsp16.3基因缺失突变菌株感染小鼠肺泡巨噬细胞的凋亡率在不同时间的变化情况,同时与结核分枝杆菌正常菌株对比,结果显示:小鼠感染结核分枝杆菌H37Rv株Hsp16.3基因缺失突变株(△H37Rv)后,巨噬细胞的凋亡率逐渐上升,至感染7d时达到高峰,随后逐渐降低,1~7d内,各时间段△H37Rv感染组巨噬细胞凋亡率均显著高于H37Rv菌株组(P<0.05),9~11d内,△H37Rv感染组巨噬细胞凋亡率反而低于H37Rv菌株组,而13~15d内,△H37Rv菌株组巨噬细胞凋亡率又高于H37Rv菌株组,差异均有统计学意义(P<0.05)。△BCG感染组凋亡率1~7d内呈现明显下降趋势,7d后巨噬细胞凋亡率变化趋于平稳,且1~5d内,△BCG组凋亡率显著高于BCG组(P<0.05),7~15d内,△BCG组与BCG组巨噬细胞凋亡率无明显差异。实验结果表明:结核分枝杆菌H37Rv株小分子热休克蛋白Hsp16.3基因缺失突变株在感染的早期和晚期诱导巨噬细胞凋亡的能力强于正常菌株(H37Rv株),而卡介苗菌株小分子热休克蛋白Hsp16.3基因缺失突变株只在早期阶段(1~5d内)诱导巨噬细胞凋亡的能力强于正常菌株(BCG),7d后与正常菌株(BCG)无明显差异。这一结果表明,结核分枝杆菌小分子热休克蛋白Hsp16.3在MTB感染的早期和晚期能够抑制小鼠肺泡巨噬细胞的凋亡,至于如何发挥这种抑制作用,有待进一步研究。
结核杆菌感染过程中,免疫细胞如巨噬细胞凋亡发生的时机及机制在抗结核中发挥的作用目前尚无定论。就诱导细胞免疫而言,在结核杆菌感染的初期,巨噬细胞大量凋亡将不利用巨噬细胞提呈抗原,机体难以建立有效的抗结核细胞免疫效应,而感染晚期发生的凋亡使结核杆菌失去了巨噬细胞提供的保护环境,机体易于将其杀伤。
结核病的发生与发展过程中伴随机体免疫细胞的凋亡是机体与结核分枝杆菌之间相互斗争的结果。对其机制的深入研究将有助于我们对结核病本身的认识,同时也为结核病的控制和根除提供新的思路。
[1]董江涛,徐芳,田玺择,等.不同毒力结核分枝杆菌感染小鼠对肺泡巨噬细胞的凋亡率及其时相性变化的影响[J].中国免疫学杂志,2012,28(5):389-392.
[2]Danelishvili L,McGarvey J,Li Y J,et al.Mycobacterium tuberculosis infection causes different levels of apoptosis and necrosis in human macrophages and alveolar epithelial cells[J].Cell Microbiol,2003,5(9):649-660.
[3]Riendeau C J,Kornfeld H.THP-1cell apoptosis in response to Mycobacterial infection[J].Infect Immun,2003,71(1):254-259.
[4]Keane J,Remold H G,Kornfeld H.Virulent Mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages[J].J Immunol,2000,164(4):2016-2020.
[5]Sly L M,Hingley-Wilson S M,Reiner N E,et al.Survival of Mycobacterium tuberculosis in host macrophages involves resistance to apoptosis dependent upon induction of antiapoptotic Bcl-2family member Mcl-1[J].J Immunol,2003,170(1):430-437.
[6]Mitra G,Saha A,Gupta T D,et al.Chaperone-mediated inhibition of tubulin self-assembly[J].Proteins,2007,67(1):112-120.
[7]Fu X,Chang Z.Identification of bis-ANS binding sites in Mycobacterium tuberculosis small heat shock protein Hsp16.3:evidences for a two-step substrate-binding mechanism[J].Biochem Biophys Res Commun,2006,349(1):167-171.
[8]Fu X,Chang Z.Identification of a highly conserved progly doublet in non-animal small heat shock proteins and characterization of its structural and functional roles in Mycobacterium tuberculosis Hsp16.3[J].Biochemistry(Mosc),2006,71(1):83-90.
[9]Fu X,Zhang H,Zhang X,et al.A dual role for the N-terminal region of Mycobacterium tuberculosis Hsp16.3 in self-oligomerization and binding denaturing substrate proteins[J].J Biol Chem,2005,80(8):6337-6348.
[10]Preneta R,Papavinasasundaram K G,Cozzone A J,et al.Autophosphorylation of the 16kDa and 70kDa antigens(Hsp 16.3and Hsp 70)of Mycobacterium tuberculosis[J].Microbiology,2004,150(7):2135-2141.
[11]Fu X,Chang Z.Temperature-dependent subunit exchange and chaperone-like activities of Hsp16.3,a small heat shock protein from Mycobacterium tuberculosis[J].Biochem Biophys Res Commun,2004,316(2):291-299.
[12]Fu X,Liu C,Liu Y,et al.Small heat shock protein Hsp16.3modulates its chaperone activity by adjusting the rate of oligomeric dissociation[J].Biochem Biophys Res Commun,2003,310(2):412-420.
[13]Gu L,Abulimiti A,Li W,et al.Monodisperse Hsp16.3 nonamer exhibits dynamic dissociation and reassociation,with the nonamer dissociation prerequisite for chaperone-like activity[J].J Mol Biol,2002,319(2):517-526.
[14]Valdez M M,Clark J I,Wu G J,et al.Functional similarities between the small heat shock proteins Mycobacterium tuberculosis HSP 16.3and human alphaB-crystallin[J].Eur J Biochem,2002,269(7):1806-1813.

