精氨酸激酶基因的蛋白表达及实时荧光定量分析
赵伊英,武万峰,汪小东,张建华
(石河子大学农学院,石河子 832003)
精氨酸激酶(Arginine Kinase,AK)(ATP:Argine L-phosphotransferase EC 2.7.3.3)属于磷酸原激酶家族中的重要一员,广泛的存在于无脊椎动物如昆虫、虾、蟹及软体动物中[1-4],起着类似于脊椎动物中肌酸激酶(Creatine Kinase,CK)(ATP:Creatine L-phosphotransferase EC 2.7.3.2)的作用,是一个与细胞内能量运转、肌肉收缩、ATP再生有直接关系的重要激酶[5-8]。
在昆虫体内,AK是唯一的磷酸原激酶,属于单亚基蛋白。在昆虫运动过程中,磷酸精氨酸是唯一有效形成ATP的磷酰基供体,能在一定时间内为剧烈运动提供能量,同时又维持 ATP的恒定[3]。AK是昆虫生命活动过程中参与能量代谢的关键酶,而且仅存在于无脊椎动物中,与脊椎动物中参与能量代谢的CK不同。因此,AK可以作为控制昆虫能量代谢的一个很好的靶标蛋白,可以减少农药的使用,减少环境压力,而且对高等动物的安全性良好[9]。
本实验在我们前期克隆获得石河子棉区棉铃虫AK基因的基础上,构建了原核生物表达载体pET28-AK,成功表达出了AK蛋白,为以后进行AK分子结构研究,深入理解AK基因的表达调控及功能提供了分子生物学基础。同时,还以棉铃虫16SrRNA作为内标基因,运用实时荧光定量PCR技术研究石河子田间品系棉铃虫与敏感品系棉铃虫体内AK基因的表达量,确定两品系棉铃虫生命代谢活动的能力,旨在推测其对外界环境适应能力强弱,为石河子地区棉铃虫的防治和施药提供依据。
1 材料与方法
1.1 材料
1.1.1 供试虫源、菌株
棉铃虫[Helicoverpa armigera (Hübner)]:石河子抗性品系(采集于石河子泉水地镇、桃花镇和农试场3个棉花种植区)、敏感品系(敏感品系由河南济源白云实业有限公司提供)。实验用棉铃虫的虫龄是六龄。
含AK基因的载体pMD18-AK,大肠杆菌菌株E.coli TOP10,BL21,原核表达载体pET-28a均为新疆兵团绿洲生态农业重点实验室保存。
1.1.2 质粒及主要试剂
Taq DNA聚合酶、限制性内切酶、T4-DNA连接酶、DNA Marker等均购自大连宝生物公司。
荧光定量PCR试剂盒购自北京博奥生物技术有限公司。DNA凝胶回收试剂盒、高纯总RNA快速提取试剂盒(离心柱型)等购自北京百泰克生物技术有限公司。
1.2 方法
1.2.1 AK基因在原核细胞中的蛋白表达
提取并纯化质粒pET-28a和pMD18-AK,分别用Bam HI和Hind III分别进行双酶切,回收目标片段,连接产物pET28a-AK转化E.coli TOP10感受态,PCR鉴定正确的阳性克隆后,提取重组质粒pET28a-AK,转化宿主菌BL21感受态细胞。
挑取含重组质粒pET28a-AK的菌落于LB液体培养基中过夜培养。取过夜培养物1mL接种于100mL新鲜的含Kan抗生素的LB液体培养基中,在37℃培养至菌液OD600约0.4~0.6时,加入IPTG至终浓度0.5mmol/L,37℃诱导5h后收获菌体,在冰水浴上进行超声波破碎细胞(4次,共15 s);然后离心(4℃,12000r/min,5min),收集上清液,SDS-PAGE电泳鉴定蛋白质的诱导表达情况。
对照为含非重组质粒pET-28a的BL21,处理的方式相同。
1.2.2 AK基因的实时定量PCR分析
采用Bio-Rad微量紫外分光光度计测定目标基因重组质粒的浓度和A260/280值,然后计算其拷贝数。
将重组质粒按10倍浓度进行稀释,从10-1~10-7拷贝数进行定量PCR扩增,通过PCR的扩增效率和标准曲线的线性关系确定其准确性。
标准曲线由SmartCycler II荧光定量PCR仪分析软件自动生成,相关系数用R2表示。
选取了16SrRNA作为内标基因,分别对16S RNA、石河子田间品系棉铃虫AK、敏感品系AK基因的质粒从10-1~10-7按10倍梯度稀释后进行定量PCR反应制作标准曲线。
实时定量PCR反应按三步法在SmartCycler II实时荧光定量PCR仪进行,模板cDNA为前期试验提取棉铃虫RNA后的反转录cDNA。
PCR 反应体系为:EvaGreen(20×)0.6μL,PCR buffer for EvaGreen(2)12.5μL,上下游引物各0.2μL,cDNA 模板2μL,hot start Taq(5U/μL)0.3μL,DEPC无菌水补齐到25μL。
反应条件为:95℃120s;95℃15s,54℃20 s,72℃20s,共45个循环。
所有数据被收集后,目标基因表达用内标基因进行校正,基因表达量以16SrRNA表达量的校正值作为参比值,用于比较不同时间点的相对表达差异。
2 结果与分析
2.1 重组质粒载体pET28-AK的构建
将原核表达载体pET-28a分别用BamH I和HindⅢ酶切回收(图1),再与前期我们已从含目标基因的克隆载体pMD18-AK(BamH I和HindⅢ酶切)回收的目标片段(图1)进行连接得到重组表达载体pET28a-AK。将其转化至大肠杆菌BL21中,PCR鉴定筛选阳性克隆菌株,获得重组表达载体pET28a-AK(图3)。

图1 pET-28a双酶切片段回收Fig.1 pET28-a digested by BamH I and HindⅢ

图2 BamH I和HindⅢ酶切pMD18-AK片段的电泳Fig.2 Electrophoresis fragment of pMD18-AK digested by BamH I and HindⅢ
2.2 精氨酸激酶蛋白的表达
原核表达结果表明,含非重组载体pET-28a的E.coli BL21,经诱导后未检测到目标条带,而含目标基因的重组载体的BL21,经过IPTG的诱导,在37ku左右出现特异性蛋白表达条带(图4),说明AK基因在其中成功表达。

图3 PCR鉴定结果Fig.3 Identification of colony PCR

图4 SDS-PAGE电泳图Fig.4 The picture of SDS-PAGE
2.3 实时荧光定量PCR
通过实时定量PCR扩增,得到内参基因和AK基因的系列模板量和Ct值线性关系的标准曲线及其主要参数(图5)。从图5可以看出,AK的标准曲线方程为:y=-0.297x+11.414,曲线的斜率为-0.297,相关系数为0.995。分别对16SrRNA、石河子田间品系AK、敏感品系AK的表达情况进行实时检测,表明石河子田间品系棉铃虫体内AK基因的表达量明显高于敏感品系棉铃虫体内AK基因的表达量。

图5 16SrRNA的标准曲线Fig.5 Standard curve of 16SrRNA
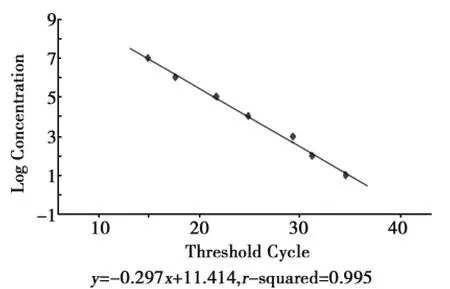
图6 AK的标准曲线Fig.6 Standard curve of AK
3 讨论
精氨酸激酶属于磷酸原激酶家族中的重要一员,起着类似于脊椎动物中肌酸激酶的作用,是一个与细胞内能量运转、肌肉收缩、ATP再生有直接关系的重要激酶,AK是节肢动物和软体动物中的唯一磷酸原激酶,在昆虫肌肉中,磷酸精氨酸是唯一有效的形成ATP的磷酰基供体,能在一定时间内为激烈运动的肌肉提供能量,同时又维持ATP的恒定水平。
在无脊椎动物体内,大多数精氨酸激酶均为组成型表达,表达范围广。由于精氨酸激酶与能量代谢密切相关,所以表达存在时空特异性,主要集中在大量需能的组织中。通过荧光定量PCR对凡纳滨对虾精氨酸激酶的表达进行分析,发现其表达分布很广,肌肉中表达量最高,而表皮中表达量最低[10-11]。在某些生物的生命史中,其表达量也有很大差异。在家蚕的生命周期中,随着龄期的增长,精氨酸激酶的表达量呈明显上升趋势,到熟蚕期达到最大,在蛹期表达量逐渐降低。通过基因上游转录因子结合位点及发育表达模式分析,家蚕精氨酸激酶基因的表达可能受蜕皮激素调控[12]。此外,研究还表明精氨酸激酶与果蝇早期的蜕皮激素有一定的关系[13]。精氨酸激酶的表达不仅具有时空特异性,还具有分工与性别的区别。红蚂蚁体内,精氨酸激酶的表达及蛋白活性顺序如下:工蚁>有翅的雌成虫>有翅的雄成虫>幼虫>工蚁蛹≈有翅蛹。在雌性有翅的红蚂蚁与工蚁体内,精氨酸激酶活性均是头部和胸部高于腹部;在雄性有翅的红蚂蚁体内,在头部与腹部精氨酸激酶的表达量比胸部高[14]。精氨酸激酶与能量利用及再生有紧密联系,可以由此推断生物体内的需能关系,进一步应用到害虫的防治中。
在大肠杆菌BL21表达棉铃虫AK蛋白,SDSPAGE电泳表明,棉铃虫AK成功的在原核细胞中得到表达,对AK的表达调控以及蛋白质水平的进一步研究和更好地探讨该基因与棉铃虫抗性与防治的相关机制等奠定了基础;并可在此基础上研究精氨酸激酶基本酶学性质,为开发以精氨酸激酶为靶标的新型害虫抑制剂提供理论依据。同时,本研究通告实时荧光定量PCR技术来研究AK基因在不同棉铃虫品系间表达量的差异,经过对石河子地区田间品系棉铃虫与敏感品系棉铃虫体内AK基因表达量分析,可推测石河子品系棉铃虫的生命代谢活动的能力要强于敏感品系棉铃虫的生命代谢的能力,从而为研究不同品系棉铃虫对外界环境适应能力,抗药性等方面提供重要依据。
[1]Perovic Ottstadt S,Wiens M,Schroder H C,et al.Argi-nine kinase in the demosponge Suberitesdomuncula:regulation of its expression and catalytic activity by silicic acid[J].Exp Biol,2005,208:637-646.
[2]Tanaka K,Suzuki T.Role of amino-acid residue 95in substrate specificity of phosphagen kinases[J].FEBSLett,2004,573:78-82.
[3]Holt S M,Kinsey S T.Osmotic effects on arginine kinase function in living muscle of the blue crab Callinectes sapidus[J].Exp Biol,2002,205:1775-1785.
[4]Kenyon G L,Reed G H.Creatine kinase:structure-activity relationships[J].Adv Enzymol,1983,54:367-426.
[5]Freddi Isaac Zuniga,Gina H,Ochoa Shannon D,et al.S-crystallin and arginine kinase bind F-actin in light-anddark-adapted octopus retinas[J].Current Eye Research,2004,28:343-350.
[6]Speed S R,Baldwin J,Wong R J,et al.Metabolic characteristics of muscles in the spiny lobster,Jasus edwardsii,and responses to emersion during simulated live transport[J].Comp Biochem Physiol B Biochem Mol Biol,2001,128:435-444.
[7]Edmiston P L,Schavolt K L,Kersteen E A,et al.Creatine kinase:a role for arginine-95in creatine binding and active site organization[J].Biochim.Biophys Acta,2001,1546,38:291-298.
[8]Schneider A,Wiesner R J,Grieshaber M K.On the role of arginine kinase in insect flight muscle[J].Insect Biochem,1989,19:471-480.
[9]朱雯静.蝗虫精氨酸激酶的活性中心及其抑制剂研究[D].济南:山东农业大学,2008.
[10]Yao C,Ji P,Kong P,et al.Arginine kinase fromLitopenaeus vannamei:cloning,expression and catalytic properties[J].Fish &Shellfish Immunology,2009,26:553-558.
[11]姚翠鸾,冀培丰,孔鹏,等.凡纳滨对虾精氨酸激酶的多克隆抗体制备及组织特异性表达分析[J].水产学报,2009,33(6):1026-1030.
[12]王华兵,徐豫松.家蚕精氨酸激酶基因的克隆、基因结构与表达分析[J].中国农业科学,2006,39(11):2354-2361.
[13]Collier G,James J.Arginine kinase and pyruvate kinase are coordinately controlled by the 75B″early″gene in Drosophila imaginal discs[J].Genetics,1987,116:12.
[14]Wang H,Zhang L,Zhang L,et al.Arginine kinase:Differentiation of gene expression and protein activity in the red imported fire ant,Solenopsis Invicta[J].Gene,2009,430:8-43.

