绵羊ISG15基因的克隆表达与纯化
崔茹鹏,沈文,鲁海富,孙延鸣
(石河子大学动物科技学院,石河子832003)
干扰素刺激基因 15(IFN-stimulated gene,isg15),编码蛋白为ISG15。但随后的研究发现,人的ISG15所编码的氨基酸序列实际包含165个氨基酸残基,分子质量约17.89 ku,由2个串联的与泛素同源的氨基酸序列组成,2序列间由脯氨酸残基桥接,氨基端及羧基端与泛素同源性分别为29%、31%,故又称ISG15为类泛素蛋白(ubiquitin like protein,Ubls)[1]。脊椎动物的多种细胞在受到干扰素、细菌脂多糖(LPS)、病毒感染等刺激后,ISG15可被高度诱导表达[2]。研究已证实,类泛素ISG15以及其蛋白质共价修饰对刺激细胞增殖、增强细胞抗病毒作用、促进白细胞趋化作用等先天免疫功能的过程中有着重要的作用[3-4]。细胞外的ISG15具有细胞因子的活性,参与细胞免疫的调节[5]。细胞内的ISG15在调节干扰素信号通路中起到了重要的作用[6]。目前已有一些对于ISG15功能的研究,但主要集中在人和小鼠上,其中对羊ISG15的研究更少,目前在羊上该基因是否也具有这些功能还有待进一步的研究。
本研究利用绵羊外周血淋巴细胞(PBMC)克隆获得了ISG15基因,将该基因克隆到原核表达载体p ET28a(+)中,并转化至大肠杆菌BL21(DE3)[7-10],通过优化表达条件,得到了ISG15的高效表达产物,且该表达产物易于纯化,为进一步研究绵羊ISG15的生物学功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1主要试剂
大肠杆菌(Escherichia coli)BL21(DE3)、DH5α和p ET-28a(+)载体由本实验室保存;TRIzol试剂购自Invitrogen公司;Taq DNA酶、T4DNA连接酶均购自北京天根生化科技有限公司;限制性内切酶HindⅢ和Eco RⅠ、DNA分子量标准、p MD18-T、蛋白质 Marker、IPTG 购自 Fermentas公司;凝胶回收试剂盒、质粒提取试剂盒购自上海捷瑞生物工程有限公司;淋巴细胞分离液购自上海生化试剂厂。
1.1.2实验动物
中国美利奴羊(新疆军垦型)5只。
1.2 方法
1.2.1引物设计与合成
根据GenBank中绵羊ISG15的基因序列(登录号:FJ844480)和 PET28a(+)多克隆位点,利用primer 5软件设计1对特异性引物,委托北京六合华大基因科技股份有限公司合成。
上游引物 P1为:5′-GAATTCATGGGCG-GGGACCTGA-3′,带有EcoRⅠ酶切位点和起始密码子;
下 游 引 物 P2 为:5′-AAGCTTTTTGCTACAACTTTATTCACTGCG-3′,带有 HindⅢ酶切位点和终止密码子。
1.2.2细胞总RNA的提取
从颈静脉无菌采取健康绵羊抗凝外周血,用淋巴细胞分离液密度梯度离心分离出PBMC,经PBS洗涤3次,用TRIzol试剂按照说明书提取总RNA:将PBMC 4℃4000 r/min离心5 min,弃上清,加入1 mL TRIzol试剂,混匀,室温静置10 min,充分裂解,加入200μL氯仿,混匀,室温静置5 min,4℃12000 r/min离心15 min;弃上清加入750 mL/L乙醇1 mL,振荡悬浮,7500 r/min离心5 min,弃上清干燥,加入无RNA酶的DEPC水中,于-70℃保存。
1.2.3 ISG15 cDNA的克隆及测序
按照RT-PCR试剂盒说明书进行操作:取上述制备的总RNA 1μg,加入20μL逆转录反应体系中,在AMV反转录酶的作用下,以Oligo(d T)为引物,于42℃50 min,95℃5 min,终止反应。将逆转录产物2μL加入到20μL的PCR反应体系,以P1、P2为引物进行扩增,反应条件为:95℃5 min,充分变性后进入循环体系:95℃30 s,55℃30 s,72℃30 s,35个循环,最后72℃延伸10 min,取PCR产物5μL在1.5%琼脂糖凝胶电泳进行鉴定。
将RT-PCR产物回收纯化,直接与p MD18-T载体连接,转化到DH5α大肠杆菌感受态中,对转化生长的菌落提取质粒,经Eco RⅠ、HindⅢ双酶切和PCR进行初步鉴定,并委托北京六合华大基因科技有限公司对其进行核苷酸序列测定,将鉴定正确的重组阳性质粒命名为p MD18-ISG15。
1.2.4原核表达载体pET28a-ISG15的构建与鉴定
将上述重组质粒p MD18-ISG15用P1、P2引物进行PCR扩增,并回收纯化,将纯化的PCR产物和表达载体p ET-28a分别用EcoRⅠ和 HindⅢ双酶切,分别回收ISG15和pET-28a(+)的目的基因片段,并用T4DNA连接酶连接,构建重组表达质粒p ET28a-ISG15,然后转化至E.coli BL21(DE3)感受态,挑取单菌落,提取质粒,用EcoRⅠ和 HindⅢ双酶切和PCR进行初步鉴定,并委托北京六合华大基因科技有限公司测序,用DNAStar软件分析插入片段的正确性,将鉴定正确的重组阳性质粒命名为p ET28a-ISG15。
1.2.5 pET28a-ISG15的诱导表达
将鉴定正确的重组质粒转化至E.coli BL21感受态细胞,接种于2×LB培养液37℃培养过夜,次日按1%比例转种于同样培养液,至A600达到0.5~0.6时,加入IPTG(终浓度为1.0 mmol/L)进行诱导,诱导4 h后离心收集菌体,溶于2×SDS凝胶加样 缓 冲 液 (50 mmol/L Tris-HCl、100 mmol/L DTT、2%SDS、10%甘油)中,100℃5 min,然后进行SDS-PAGE电泳,考马斯亮蓝染色,分析目的蛋白表达情况,同时设空载体和不加IPTG的对照。
1.2.6表达产物的纯化
将表达产物用Ni2+-NTA树脂进行纯化。大量收集诱导表达的菌体,超声破碎,将上清用0.45 μm滤膜过滤,滤液装入Ni2+-NTA树脂层析柱中,用洗脱液多次重悬树脂,取洗脱液进行SDSPAGE,分析目的蛋白的纯化效果。
2 结果
2.1 RT-PCR扩增
以绵羊PBMC细胞总RNA为模板,经RTPCR扩增,在分子量大小约541 bp位置可见清晰的扩增条带,与预期片段大小一致(图1)。
DNA测序结果与Gen-Bank中报道羊的序列相似性为98.48%(测序结果略),说明已经成功克隆了绵羊ISG15基因。
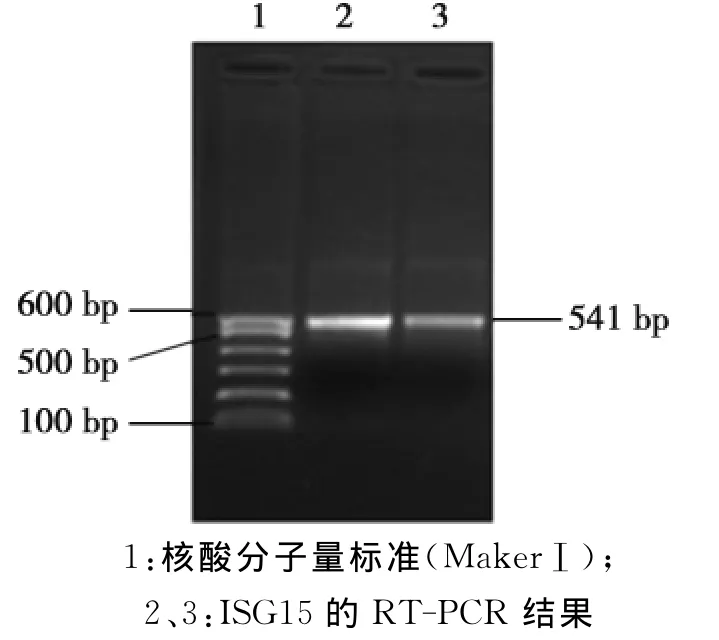
图1 ISG15基因的RT-PCR扩增结果Fig.1 The RT-PCR amplification results of the ISG15 gene
2.2 重组质粒的酶切、PCR及测序鉴定
将重组质粒p ET28a-ISG15经EcoRⅠ和 HindⅢ双酶切鉴定及PCR鉴定,得到与目的基因大小一致的片段(图2、3),并且将重组质粒进行序列测定,结果表明编码ISG15的基因已经正确地插入到原核表达载体p ET-28a的克隆位点(测序结果略)。
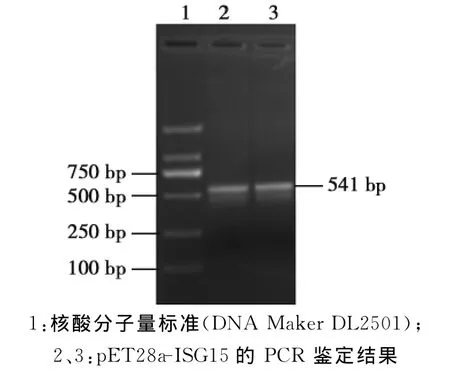
图2 重组质粒pET28a-ISG15的PCR扩增结果Fig.2 PCR analysis of recombinant plasmid pET28a-ISG15
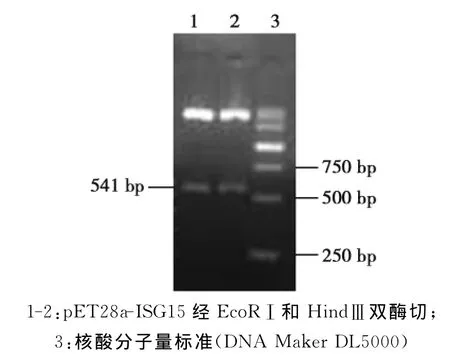
图3 重组质粒pET28a-ISG15的双酶切鉴定结果Fig.3 The restriction enzyme analysis of the recombinant plasmid pET28a-ISG15
2.3 ISG15融合蛋白的表达与鉴定
将鉴定正确的重组质粒转化至E.coli BL21感受态细胞,用终浓度为1.0 mmol/L IPTG诱导4 h后收集菌体,经裂解后取上清进行SDS-PAGE电泳,考马斯亮蓝染色,结果显示目的条带为25 ku,与预期结果一致,而非重组的p ET-28a(+)中未见明显条带,说明重组质粒p ET28a-ISG15获得了表达(图4)。

图4 pET28a-ISG15在E.coli BL21中表达产物的SDS-PAGE分析Fig.4 The expression product of pET28a-ISG15 in E.coli BL21 by SDS-PAGE
2.4 表达蛋白的纯化
目的蛋白经Ni2+-NTA树脂纯化后,得到单一的条带,纯化效果较好(图5)。

图5 pET28a-ISG15表达纯化产物的检测Fig.5 The purification of pET28a-ISG15 expressed product by SDS-PAGE analysis
3 讨论
本试验根据GenBank中的绵羊ISG15基因序列设计特异性引物,利用 RT-PCR[11-12]的方法克隆得到绵羊ISG15基因,并将绵羊ISG15基因克隆到高效表达载体p ET-28a(+)中进行表达。本试验选用p ET-28a(+)载体作为表达载体,主要是由于p ET-28a的MCS前面没有信号肽,直接用IPTG诱导表达,并且p ET-28a带有his标签,便于后续的蛋白纯化工作。本试验采用Ni2+-NTA树脂对目的蛋白进行分离纯化,由于带有his标签的目的蛋白能够与Ni2+-NTA树脂特异性结合,分离的目的蛋白纯度较高,而且Ni2+-NTA树脂可再生反复利用,因此本试验采用Ni2+螯合亲和层析法[13]将目的蛋白纯化。另外,为了提高目的蛋白的表达量,本试验对IPTG的不同用量及不同诱导时间分别进行了筛选与优化,找到了最佳表达条件,即当IPTG为1.0 mmol/L且诱导4 h时,ISG15融合蛋白获得了高效表达,表达的蛋白分子量为25 ku,为今后对该基因的功能研究奠定了基础。
[1]Zhao C,Beaudenon S L,Kelley M L,et a1.The Ubc H8 ubiquitin E2 enzyme is also the E2 enzyme for ISG15,an IFN-alpha/beta-induced ubiquitin-like protein[J].Proc Natl Acad Sci USA,2004,101(20):7578-7582.
[2]Ritchie K J,Hahn C S,Kim K I,et a1.Role of ISGl5 protease UBP43(USPl8)in innate immunity to viral infection[J].Nat Med,2004,10:1374-1378.
[3]Kim K I,Zhang D E.ISG15 not just another ubiquitinlike protein[J].Biochem Biophys Res Commun,2003,307(3):431-434.
[4]Ritchie K J,Hahn C S,Kim K I,et a1.Role of ISG15 protease UBP43(USP18)in innate immunity to viral infection[J].Nat Med,2004,10(12):1374-1378.
[5]刘畅,乔文涛,王琛,等.类泛素蛋白ISG15及其在先天免疫中的作用[J].生物化学与生物物理进展,2006,33(11):1023-1029.
[6]Malakhova O A,Yan M,Malakhov M P.Protein ISG ylation modulates the JAK-STAT signaling pathway[J].Genes Dev,2003,17(4):455-460.
[7]唐利燕,陈创夫,王志远,等.布鲁氏菌bp26基因的原核表达及BP26-间接ELISA方法的初步建立[J].石河子大学学报:自然科学版,2009,27(4):437-440.
[8]倪伟,才学鹏,乔军,等.小反刍兽疫病毒融合蛋白基因的克隆、序列分析及表达[J].石河子大学学报:自然科学版,2011,29(1):35-39.
[9]张艳,陈创夫,张辉,等.布鲁氏菌 Wbo A基因的原核表达与鉴定[J].石河子大学学报:自然科学版,2011,29(2):189-192.
[10]赵志超,孙敬礼,黄涛,等.梅山与杜洛克母猪发情前期卵巢中差异表达基因的分离与鉴定[J].石河子大学学报:自然科学版,2012,30(2):167-170.
[11]王鹏雁,陈创夫,余兴龙,等.轮状病毒VP7基因的克隆及核苷酸序列分析[J].石河子大学学报:自然科学版,2002,6(2):87-90.
[12]曹体婷,赵宗胜,刘贤侠,等.鹌鹑及与鸡的杂交后代3β-HSD和P-450c17基因的cDNA部分序列克隆[J].石河子大学学报:自然科学版,2009,17(4):445-448.
[13]王文加,郭晓林,韦安慧,等.基于Fe3O4@SiO2/Ni-NTA磁性微球的His-tag融合蛋白纯化体系的建立[J].高等学校化学学报,2012,33(2):303-307.

