缩节胺剂量对花铃期棉花生理特性的研究
邓小霞,江海澜,彭俊,周婷婷,孟新刚,汪静,王俊刚
(石河子大学农学院,石河子 832003)
新疆属典型的干旱、蒸发量大、无霜期短的大陆性气候。20世纪90年代初,随着新疆膜下滴灌技术的发展,播种面积、单产水平、总产量均跃居全国第一,成为我国主要的商品棉生产基地[1-3]。只要环境条件适宜,棉花就可长时间现蕾、开花、吐絮,但新疆无霜期比较短,作物需要在一定时间内完成生长发育的全过程,并且在产量上不能减少。为此,只有矮化棉株高度,增加单位面积的棉株数量,才能保障产量。同时为了更好的实现矮、密、早、膜的栽培模式[4],外源激素在棉花生产上得以大面积使用[5]。其中缩节胺(1,1-二甲基哌啶嗡氯化物)属于植物生长延缓剂,能控制棉花营养生长,降低植株高度,使节间缩短,株型紧凑,利于通风透光,减少棉花蕾铃脱落[6],同时还有增加叶绿素含量,促进棉铃发育[7],增强光合效率和根系活力,塑造理想株型、改善通风透光条件,创造高光效群体等作用[8];缩节胺还能增加叶片中钙与磷的水平,提高细胞膜的稳定性,增加植株抗逆性[9]。
尽管缩节胺在棉花上应用技术趋于成熟,给棉花生产带来巨大的经济效益,但实际应用过程中常出现缩节胺剂量用量过大[10]、喷施时间不合理等现象,使棉花受到生长过慢等不利影响,进而导致棉花减产,棉农收入减少[11]。棉花花铃期是营养生长与生殖生长并进时期,是棉花产量形成的关键时期[12],然而在此期间,因虫害及季节性干旱等逆境胁迫导致蕾铃脱落增加,铃重减轻,产量与品质严重下降[13-14]。所以,该时期缩节胺的合理使用对棉花产量形成和品质提高的意义重大。鉴于此,本文研究了花铃期棉花对不同浓度缩节胺的生理响应,旨在从叶绿素、植物渗透调节物质和丙二醛含量变化方面为干旱区花铃期棉花合理化控、提高产量和品质及缩节胺诱导棉花抗虫性研究提供一定的理论基础。
1 材料与方法
1.1 材料
供试材料为花铃期棉花(新陆早44号);供试药剂为安阳市小康农药有限责任公司生产。
1.2 方法
1.2.1 试验设计
选择石河子大学农学院试验站(E 86°、N 44°)试验田,试验地南北走向,宽膜覆盖。膜宽1.4m,行距为(30cm+50cm+30cm)、株距10cm,于2011年4月23日播种,棉种不作任何药剂处理,水肥化控等栽培管理措施与一般大田相同。采用完全随机区组设计,供试药剂剂量共设置5个,分别为0、0.25、0.5、1.0和1.5g/L(每666.67m2用水30 kg)。选取生长势一致的花铃期棉花(全部开花),于2011年6月30日按照不同的缩节胺剂量进行均匀喷雾,喷药后1、4、7、10d时测定棉花体内叶绿素、可溶性蛋白、丙二醛(MDA)、脯氨酸(Pro)含量的变化。每个处理3次重复。
1.2.2 棉花叶片生理指标的测定
于喷药后第1、4、7、10d早晨,采取各棉株上部倒三叶,将其放入冰盒冷藏等待分析测定。叶绿素含量测定用丙酮、乙醇等体积混合液浸提,在645、663nm波长下测定吸光值,方法参照唐前瑞[15];丙二醛含量测定采用硫代巴比妥酸法[15];可溶性蛋白质含量测定采用考玛斯亮蓝(G-250比色法)[16];游离脯氨酸含量测定采用酸性茚三酮法[16]。
1.2.3 数据处理
使用Excel进行数据处理,并采用SPSS 17.0统计软件进行方差分析和多重比较。
2 结果与分析
2.1 缩节胺对花铃期棉花叶绿素含量的时序变化
结果见图1。
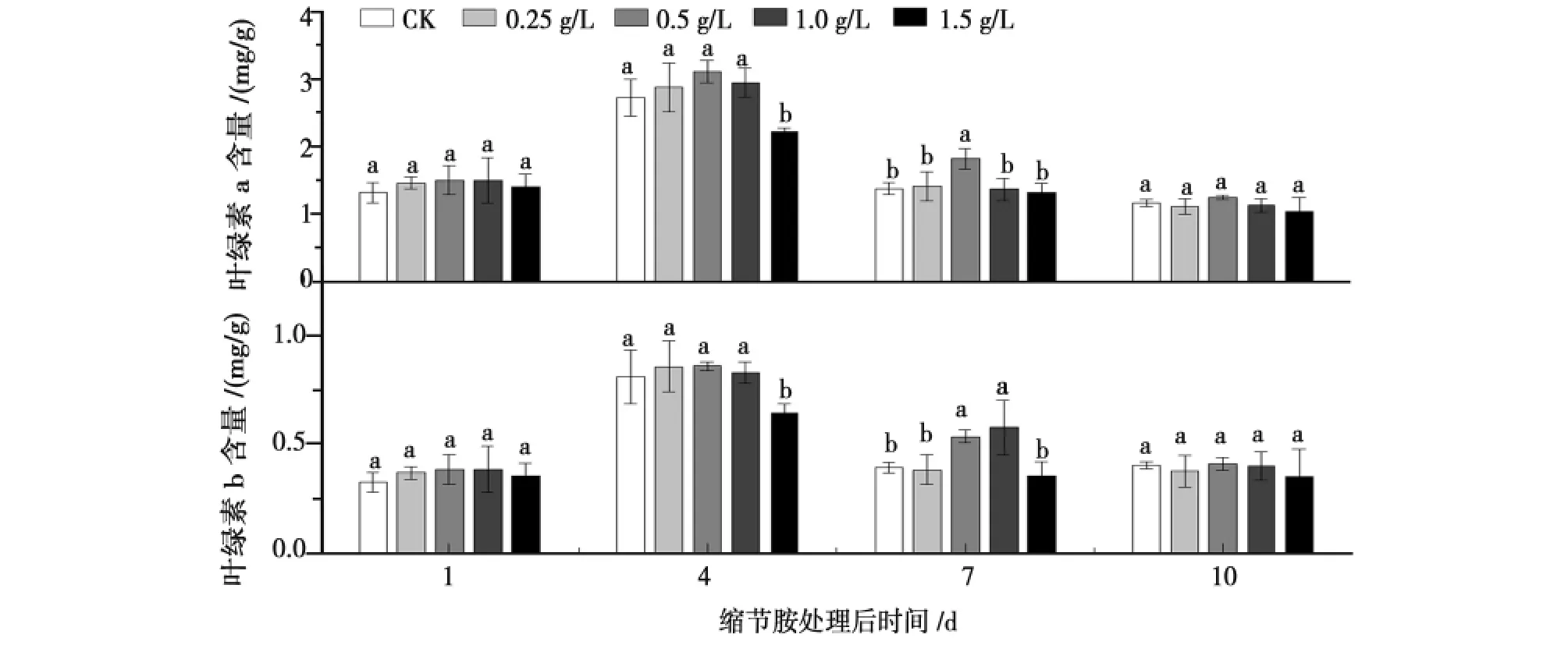
图1 缩节胺对花铃期棉花叶绿素含量的影响Fig.1 Effect of DPC on chlorophyll contents in cotton during flowering and boll-setting period
由图1可知,各浓度处理下的棉花叶绿素含量变化差异有统计学意义。喷施缩节胺后,棉花叶绿素含量呈现先上升后降低的趋势。而0.5g/L缩节胺处理后棉花叶绿素a、b含量在第1、4天时高于其他各处理,且在喷药后4d叶绿素a和叶绿素b含量达到最高,分别为3.11、0.86mg/g;而1.5g/L处理的棉花叶绿素含量则始终低于其它处理。随着缩节胺浓度的增加棉花叶绿素的含量先上升后下降,并在第4天时1.5g/L处理的棉花叶绿素a显著低于对照18.45%,叶绿素b含量显著低于对照20.32%,且第4天时1.5g/L处理的叶绿素a、b均显著低于其它处理(P<0.05),而剩余处理之间叶绿素含量变化差异无统计学意义(P>0.05)。
2.2 缩节胺处理对花铃期棉花可溶性蛋白含量的时序变化
由图2可知,在各浓度缩节胺处理后,棉花可溶性蛋白含量变化差异有统计学意义。喷施低浓度(0.25、0.5g/L)缩节胺后,随着时间的延长,棉花可溶性蛋白含量增加,并在第10天后0.25g/L处理的显著高于对照77.83%,0.5g/L处理的显著高于对照74.59%。而喷施高浓度(1.0、1.5g/L)的棉花蛋白含量在第1、4天时较低,随后可溶性蛋白含量增加。喷施缩节胺10天后,1.0g/L处理的可溶性蛋白含量是各浓度中且是该处理期最大值,为3.84mg/g,显著高于对照(P<0.05)。
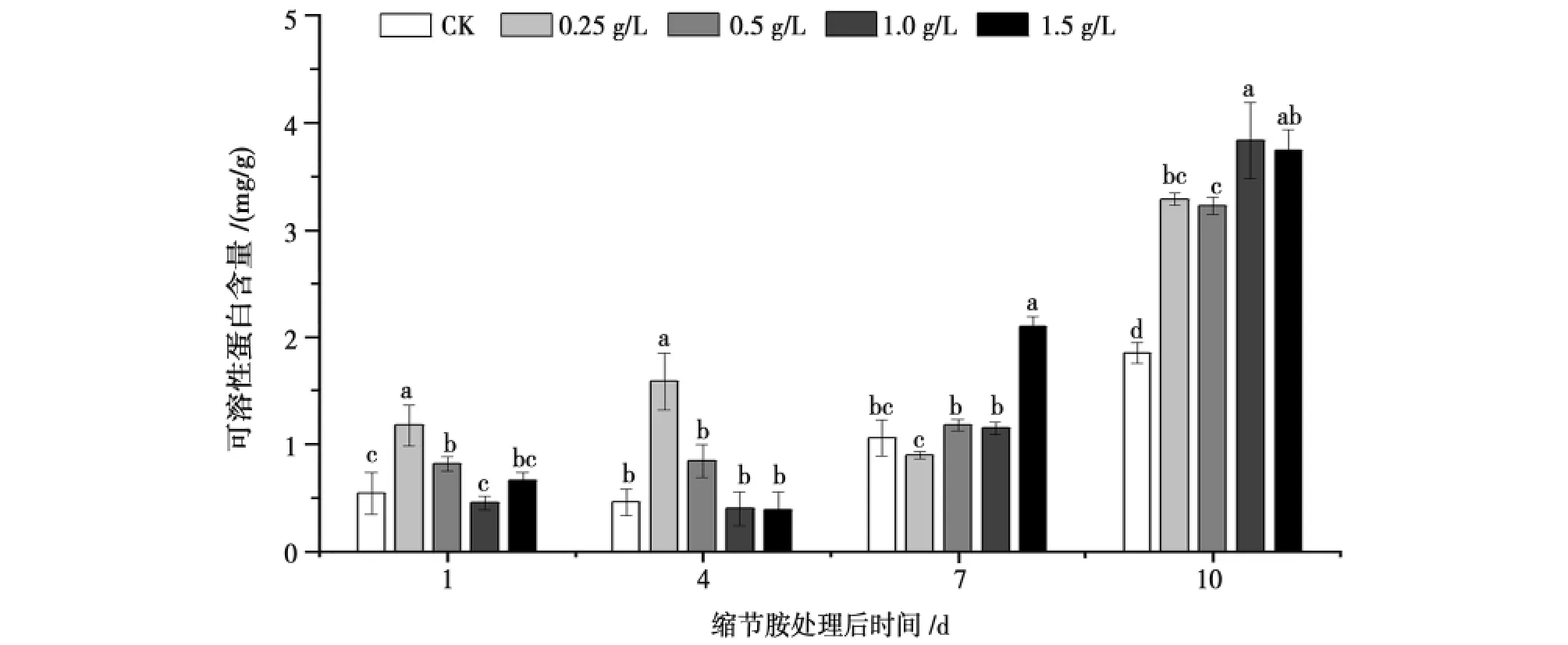
图2 缩节胺对花铃期棉花可溶性蛋白含量的影响Fig.2 Effect of DPC on soluble protein contents in cotton during flowering and boll-setting period
2.3 缩节胺对花铃期棉花游离脯氨酸含量的时序变化
由图3可知,喷施缩节胺后第1和第4天棉花脯氨酸含量随着缩节胺浓度增加,脯氨酸含量减少,1.5g/L处理的棉花脯氨酸含量下降最快,分别比对照下降了54.76%和56.89%,且与其它处理差异有统计学意义。而在喷施缩节胺7和10d后各浓度处理的棉花脯氨酸含量与对照之间差异无统计学意义,但是含量均低于对照。
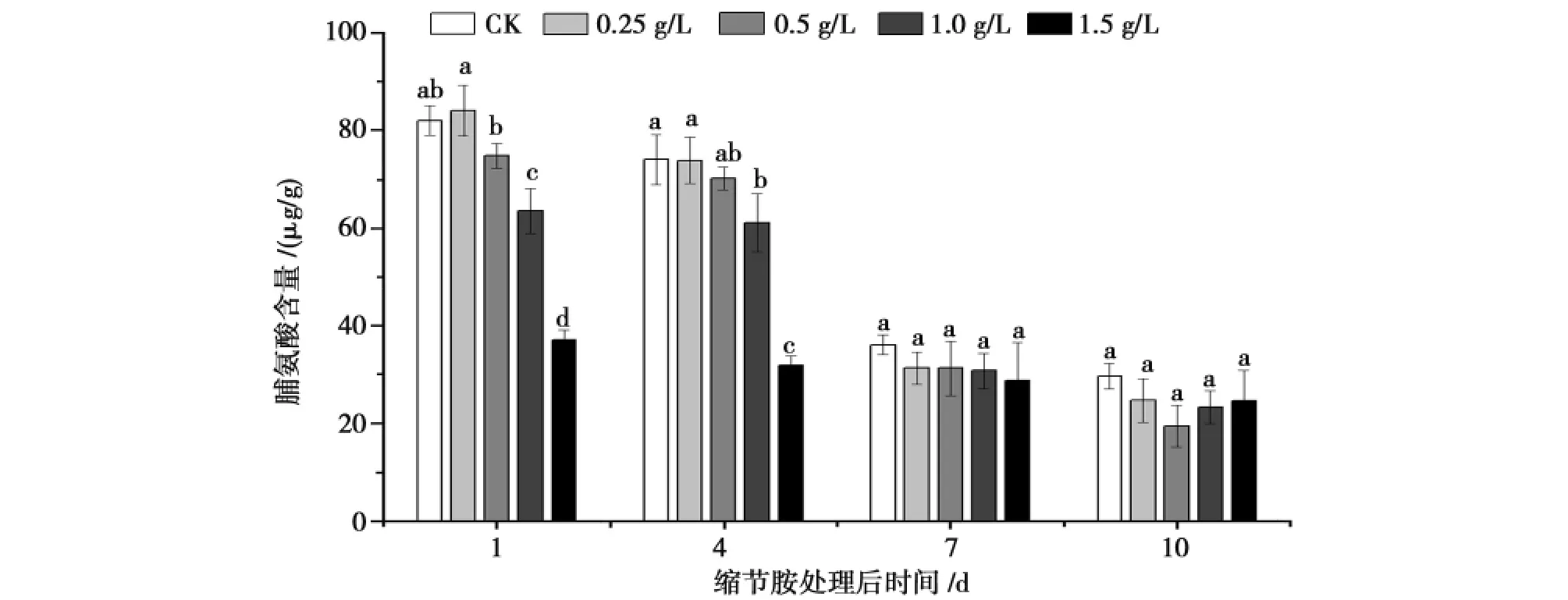
图3 不同缩节胺浓度对花铃期棉花脯氨酸含量的影响Fig.3 Effect of DPC on proline contents in cotton during flowering and boll-setting period
2.4 缩节胺对花铃期棉花丙二醛含量的时序变化
由图4可知,喷施缩节胺后第1天棉花丙二醛含量随着浓度的升高而降低但是各处理间的差异无统计学意义;喷施缩节胺4天后,各浓度处理的棉花丙二醛含量均高于对照,其中1.5g/L处理下的丙二醛含量比对照高21.43%,且差异有统计学意义;喷施缩节胺7和10d后,各浓度处理下的丙二醛含量与对照差异无统计学意义。
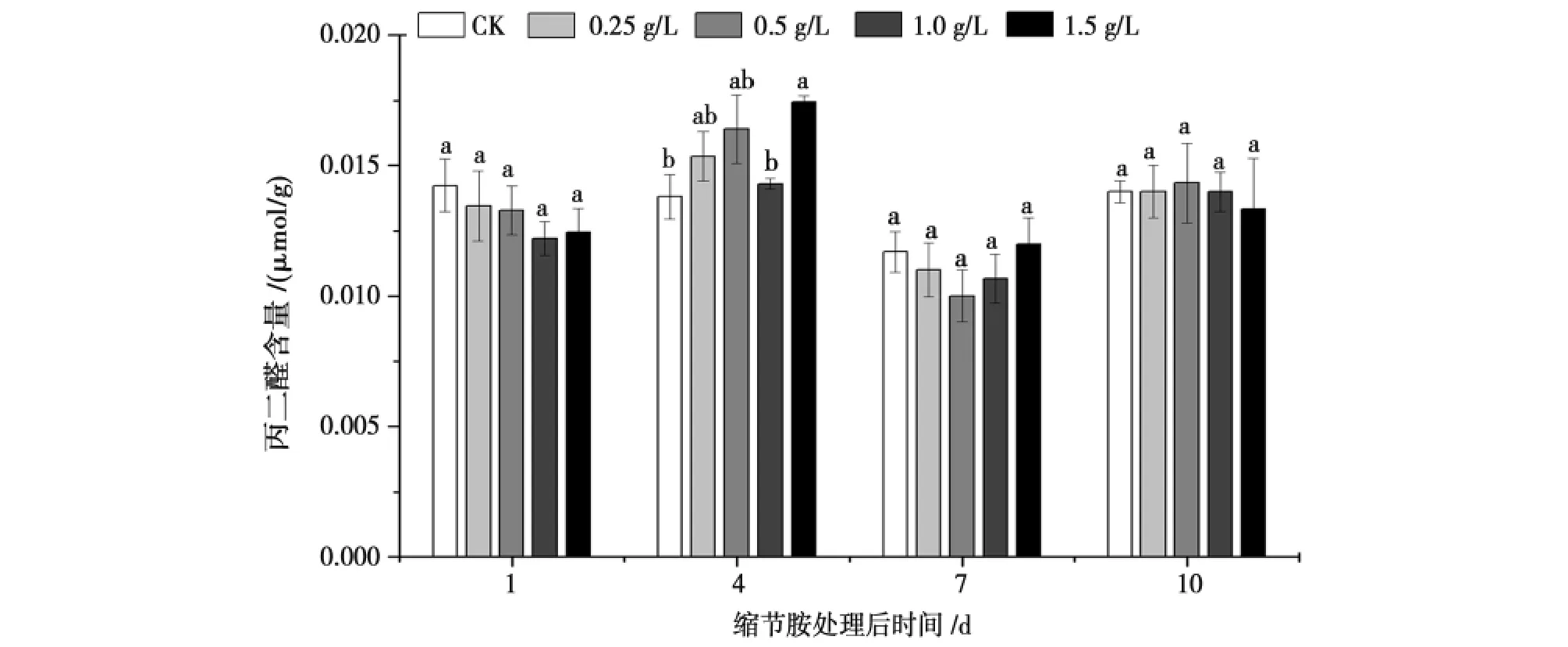
图4 不同缩节胺浓度对花铃期棉花丙二醛含量的影响Fig.4 Effect of DPC on MDA contents in cotton during flowering and boll-setting period
3 结论与讨论
叶绿素是植物光合作用的主要色素,叶绿素的破坏与降解会直接导致光合速率的降低,而出现植物叶片衰老死亡。已有研究表明,喷施缩节胺后棉花叶片增厚,植株体内叶绿素含量上升,从而光能利用率增加[17-18]。本试验显示:喷施缩节胺后,花铃期棉花的叶绿素a、b含量随时间增加呈先升后降的趋势,较低浓度缩节胺能提高花铃期棉花的叶绿素含量,而过高浓度不能提高叶绿素含量,说明低浓度缩节胺处理能促进花铃期棉花合成更多的叶绿素提高光合效率。试验过程中观察到,缩节胺浓度>1g/L时,棉花停止生长,叶片产生红斑,结合试验中生理指标的比较,高浓度(>1g/L)缩节胺处理则有可能对花铃期棉花造成不利影响;同时发现,在0.25与0.5g/L 2个低浓度处理之中,0.5g/L缩节胺处理的叶绿素含量在各次测定中均为最高,而过低浓度(<0.5g/L)并不能提高叶绿素含量。因此,作者认为要提高花铃期棉花的光合利用率,缩节胺的使用浓度应该控制在0.5g/L左右。可溶性蛋白是一种少见的亲和溶质的有机化合物,能够增加植物细胞耐渗透能力及抗胁迫能力[19-21],在植物体内充当氮素代谢的代谢库,同时在植物进行同化物代谢过程中作用重大[22]。脯氨酸是植物蛋白质的组分之一,并可以游离状态广泛存在于植物体中,在干旱、盐渍等胁迫条件下,许多植物体内脯氨酸大量积累,提高自身细胞液的浓度,降低渗透势,维持细胞正常的膨压[23],常作为反映植物受胁迫程度的重要指标之一[24]。本试验结果表明,在喷施缩节胺后,花铃期棉花体内的可溶性蛋白含量和脯氨酸含量的变化在时间上有着较大的差异。用低浓度缩节胺处理,棉花在前期可溶性蛋白含量持续上升,而脯氨酸含量先降后升;用高浓度缩节胺处理,棉花可溶性蛋白含量上升而脯氨酸含量则一直下降;同时,在施药10d后,各处理的棉花可溶性蛋白含量均显著高于对照,而脯氨酸含量则与对照差异无统计学意义。由此可见,喷施缩节胺后花铃期棉花主要通过积累可溶性蛋白来提高自身的抗逆性,缩节胺的应用浓度应控制在0.25~0.5g/L,有利于花铃期棉花提高抗逆性。
植物体内活性氧的产生和清除处于相对动态平衡中,但在逆境条件下体内活性氧自由基产生的速度超出了植物自身清除的能力,发生膜脂过氧化作用而产生丙二醛。因此,丙二醛含量与植物抗逆性有着密切相关[25-27]。试验发现:喷施缩节胺后,花铃期棉花体内丙二醛含量除了施药4d后1.5g/L处理与对照差异有统计学意义,且高于对照21.43%;其它各浓度与对照在第1、4、7和10天均与对照差异无统计学意义,并且这些处理组棉花丙二醛含量均比对照低,高浓度(1.5g/L)缩节胺处理花铃期棉花在施药4d后丙二醛含量比对照高,但是在施药7和10d这种现象就会消失,说明虽然高浓度处理会对花铃期棉花造成一定的不利影响,但是这种胁迫会随着时间的延长而逐渐消失,不会对棉花后续生长造成更大伤害。进而提高了花铃期棉花的膜系统稳定性,减少膜损伤程度,提高花铃期棉花叶片抗逆能力;同时在缩节胺的应用浓度最好不超过1.5 g/L,以免缩节胺带来负面效应。
综上所述,在棉花花铃期对缩节胺剂量的控制显的尤为重要,喷施高浓度缩节胺在短期内会对棉花造成一定的危害胁迫,不利于棉花更好的生长,而喷施低浓度(0.25~0.5g/L)的缩节胺进行化学调控,不仅能达到控制棉花营养生长,而且能很好的提高花铃期棉花的抗逆性。
[1]新疆统计局.新疆统计年鉴[M].北京:中国统计出版社,2009.
[2]杨淑萍,危常州,梁永超.海岛棉不同基因型幼苗对盐胁迫的生理响应[J].石河子大学学报:自然科学版,2010,28(6):670-673.
[3]罗宏海,赵瑞海,杨新军,等.高产棉花叶面积载荷量与光合生产的关系及对冠层结构的影响[J].石河子大学学报:自然科学版,2011,29(1):6-10.
[4]周运刚,王俊刚,马天文,等.缩节胺对棉蚜种群繁殖的影响[J].西北农业学报,2011,20(5):199-202.
[5]罗宏海,张亚黎,张旺锋,等.新疆滴灌棉花花铃期干旱复水对叶片光和特性及产量的影响[J].作物学报,2008,34(1):171-174.
[6]刘瑞显,郭文琦,陈兵林,等.干旱条件下花铃期棉花对氮素的生理响应[J].应用生态学报,2008,19(7):1475-1482.
[7]蔡红涛,汤一卒,刁品春,等.棉花花铃期土壤持续干旱胁迫对产量形成的调节效应[J].棉花学报,2008,20(4):300-305.
[8]周晓舟,周晓欢.植物生长调节剂对桑树幼苗生长的影响[J].广西蚕业,2006(3):7-11.
[9]罗宏海,赵瑞海,韩春丽,等.缩节胺(DPC)对不同密度下棉花冠层结构特征与产量性状的影响[J].棉花学报,2011,23(4):334-340.
[10]刘春芳,王志利,罗湘宁,等.缩节胺(DPC)在棉花生产上的应用研究[J].西北农业学报,1997,6(1):81-83.
[11]徐立华,杨长琴,李国锋,等.缩节胺对高品质棉成铃与品质的影响[J].棉花学报,2006,18(5):294-298.
[12]李颖,陈金湘,李矗矗,等.缩节胺在棉花上的应用概况[J].2008,22(5):457-459.
[13]伊黎,卢华平,张登科,等.棉花使用缩节胺产生负效应分析[J].江西棉花,2011,33(4):28-30.
[14]王铭伦,韩广清,王福青,等.DPC对花生叶片生理功能的调节效应[J].西北植物学报,2000,20(6):1238-1241.
[15]唐前瑞.红木遗传多样性及其叶色变化的生理生化研究[D].长沙:湖南农业大学,2001.
[16]李玲.植物生理学模块实验指导[M].北京:科学出版社,2009.
[17]刘春芳,王志利,罗湘宁,等.缩节胺(DPC)在棉花生产上的应用研究[J].西北农业学报,1997,6(1):81-83.
[18]陈德华,陈源,杨长琴,等.氮肥与缩节胺配合对Bt棉源库特征和铃重的影响[J].棉花学报,2002,14(3):147-l50.
[19]郑莎莎,孙传范,孙红春,等.不同外源激素对花铃期棉花主茎叶生理特性的影响[J].中国农业科学,2009,42(12):4383-4389.
[20]周运刚,王俊刚,马天文,等.不同DPC(缩节胺)处理对棉花生理生化特性的影响[J].新疆农业科学,2010,47(6):1142-1146.
[21]周莉娜,曲东,邵丽丽,等.干旱胁迫下硫营养对小麦光合色素及MDA含量的影响[J].西北植物学报,2005,25(8):1579-1583.
[22]郭丽,贾秀领,张凤路,等.定位水氮组合对冀5265小麦叶片硝酸还原酶、可溶性蛋白及产量的影响[J].华北农学报,2010,25(1):180-184.
[23]潘晓云,曹琴东,王根轩.膜脂过氧化作为扁桃品种抗寒性鉴定指标研究[J].生态学报,2002,22(11):1902-1912.
[24]孙存华,李扬,贺鸿雁,等.PEG6000渗透胁迫对藜幼苗叶片渗透调节物质的影响[J].安徽农业科学,2007,35(25):7784-7786.
[25]罗立津,徐福乐,洪淑珠,等.甲哌鎓对甜椒幼苗抗寒性的诱导作用研究[J].农药学学报,2010,12(2):142-148.
[26]刘琳,毛凯,干友民,等.抗寒锻炼对假俭草SOD、POD活性及 MDA含量的影响[J].湖北农业科学,2005(5):87-89.
[27]齐建波,荣新民,陈虎,等.不同水分胁迫水平对葡萄叶水势及生理指标的影响[J].石河子大学学报:自然科学版,2011,29(4):438-441.

