山楂中多糖的提取及化学特性分析
王玉荣,金玉兰 *,朴美子,任 航
(1.青岛农业大学化学与药学院,山东 青岛 266109;2.青岛农业大学 食品科学与工程院,山东 青岛 266109;3.青岛橙果环保科技发展有限公司,山东 青岛 266101)
山楂别名山里红、酸枣,蔷薇科,山楂属,主要分布在我国的山东、河南、山西、河北、辽宁等地,具有很高的食用及药用价值。山楂的主要成分为多糖,并且主要以果胶的形式存在。近年来,多糖因其营养、医疗保健等功能以及无毒、无副作用,受到国内外学者的关注,从各种生物材料中寻找与提取具有一定生理活性的多糖成分的研究十分活跃[1]。ENRIQUE G等[2]从海草中提取出海藻多糖,并对化学组分进行了分析。唐礼可[3]通过动物实验研究发现山楂多糖具有显著的抗疲劳作用。闫启光[4]将山楂多糖进行小鼠实验,发现山楂能增强小鼠的免疫力。杜丽娟等[5]对果胶进行分解后,测定分解物有抗氧化能力。戴远臣等[6]对山楂多糖的提取工艺进行了优化,证实山楂多糖对保多利亚乳杆菌的生长有促进作用。本研究以山楂果肉和山楂整果为原料,分别在4℃、50℃、100℃条件下提取山楂多糖,研究了山楂果肉、全果在不同提取温度时多糖的提取率、黏度以及蛋白质、还原糖、中性多糖、酸性多糖的含量及其抗氧化性,为山楂工业化综合应用提供了依据。
1 材料与方法
1.1 材料与试剂
鲜山楂:购于青岛城阳大润发超市;牛血清标准蛋白质样品:原平皓(天津)生物技术有限公司;考马斯亮蓝G-250、1,1-二苯基-2-三硝基苯肼(DPPH):美国Sigma公司;咔唑:阿拉丁试剂(上海)有限公司;无水乙醇、浓硫酸、葡萄糖、3,5-二硝基水杨酸(dinitrosalic acid,DNS)、酒石酸钠、苯酚,均为国产分析纯(AR)试剂。
1.2 仪器与设备
THZ-82型恒温振荡器、CU-600B型电热恒温水浴锅:上海福玛实验设备有限公司;TGL-16M型高速台式冷冻离心机:长沙湘仪仪器有限公司;RE-52AA型旋转蒸发议:上海亚荣生化仪器厂;FD-ID-80冷冻干燥机:北京博医康实验仪器有限公司;NDJ-1型旋转黏度计:上海昌吉地质仪器有限公司;WH-2微型旋涡混合仪:上海沪西分析仪器厂有限公司;DU-800型紫外分光光度计:美国贝克曼公司。
1.3 试验方法
1.3.1 山楂中多糖的提取[7]
新鲜山楂蒸馏水清洗,晾干表面水分,将一部分去除果核。分别称取山楂全果和果肉各50g,加入10倍体积的蒸馏水,4℃、50℃、100℃分别水浴振荡(120r/min)提取6h、3h、3h后,提取液6000r/min离心10min,保留上清液。残渣按相同方法再提取2次,合并3次上清液。
将提取液浓缩至1/2体积,加入2倍体积95%vol乙醇,室温条件下静置2h,6000r/min离心5min,得粗多糖沉淀,用95%vol乙醇洗2次,冷冻干燥,山楂中粗多糖的提取率按下式计算:
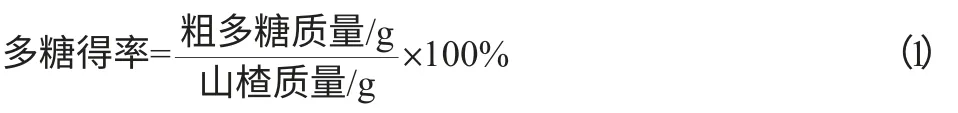
1.3.2 黏度的测定
1.3.3 蛋白质含量测定
山楂中蛋白质含量的测定采用Bradford法[8]。以牛血清蛋白(bouine serum albumin,BSA)标准溶液绘制标准曲线,在波长595nm处测吸光度值,BSA浓度(μg/mL)为横坐标,吸光度值(OD)为纵坐标绘制标准曲线,结果见图1。配制浓度为10mg/mL的多糖溶液,取100μL样品,加1mL考马斯亮蓝工作液,混匀,静置2min,在波长595nm处测吸光度值,参照标准曲线得出蛋白质含量。
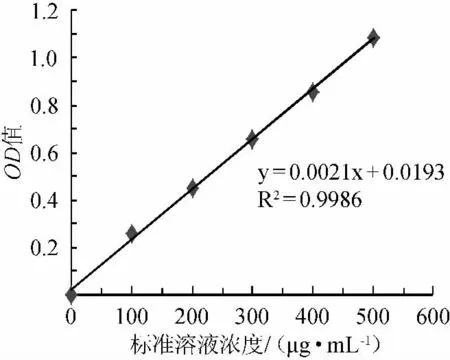
图1 蛋白质含量测定标准曲线Fig.1 The standard curve of determination of protein content
1.3.4 还原糖的含量测定
DNS法[9]测定还原糖含量。称取185g酒石酸钾钠溶于500mL蒸馏水,温热溶解,再加入6.5g的3,5-二硝基水杨酸和262mL氢氧化钠(2mol/L)溶液,溶解后加入5g苯酚和5g亚硫酸钠,搅拌溶解。冷却后加蒸馏水定容至1000mL,配制成DNS试剂贮存于棕色瓶中(暗处保存7d~10d)备用。将葡萄糖经105℃干燥至质量恒定,准确称取200mg蒸馏水溶解,于200mL容量瓶中定容,得1mg/mL葡萄糖标准液。以葡萄糖为标准液绘制标准曲线,结果见图2。取500μL的2mg/mL多糖溶液,加入DNS试剂500μL,摇匀,沸水浴5min,流水冷却,加4mL蒸馏水,混匀,在波长540nm处测吸光度值。
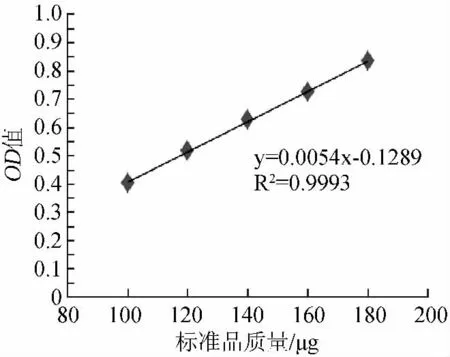
图2 还原性含量测定标准曲线Fig.2 The standard curve of determination of reducing sugar content
1.3.5 中性多糖的测定
用改良的苯酚-硫酸法[10]测定山楂多糖中中性多糖的含量。精密量取0、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL葡萄糖标准液于具塞试管中,加蒸馏水至2mL,再加入5%苯酚1mL,摇匀,迅速加入5mL硫酸,摇匀,放置15min,沸水浴10min,迅速冷却至室温,在波长490nm处测吸光度值,得中性多糖含量(x)与吸光度值(y)关系的线性回归方程:y=0.0059x+0.0038,R2=0.9991。取400μL 1mg/mL的多糖溶液,补蒸馏水至2mL,再加入5%苯酚1mL,迅速加入5mL硫酸,混匀,静置15min,沸水浴10min,迅速冷却至室温,在波长490nm处测吸光度值。
图3 中性多糖含量测定标准曲线Fig.3 The standard curve of determination of neutral polysaccharides content
1.3.6 酸性多糖的测定
酸性多糖的测定采用硫酸-咔唑法[11]。多糖经水解生成己糖醛酸,在强酸中与咔唑试剂发生缩合反应,生成紫红色化合物,产生紫外吸收,且在一定浓度范围内,其呈色强度与己糖醛酸含量成正比。称取Na2B4O7·10H2O 0.478g,溶于100mL硫酸溶液中,配制成四硼酸钠-浓硫酸溶液。以葡萄糖为标准溶液,在波长530nm处测吸光度值,绘制标准曲线:y=0.001x+0.1442,R2=0.9965。取1mg/mL多糖溶液200μL于具塞试管,加蒸馏水至500μL,再加入四硼酸钠-硫酸溶液2.5mL,摇匀,沸水浴20min,迅速冷却至室温,加入0.15%咔唑,室温避光2h,在波长530nm处测吸光度值。
会上,厅机关、退休老干部、先进单位和先进个人代表亓文辉、姜清春、李明启、高永福、吴庆刚、于学峰、王吉贵、许锡宁、常林春作了发言。
1.3.7 DPPH自由基清除能力的测定
配制浓度为1mg/mL的山楂多糖溶液,用蒸馏水作空白,分别向样品管、样参管内加样品溶液500μL,样品管和对照管各加1×10-4mol/L DPPH试剂2.4mL,样参管加无水乙醇2.4mL,全部加水至4mL,充分混匀后,室温黑暗处静置反应30min,在波长517nm处测吸光度值,按式(2)计算山楂多糖对DPPH自由基的清除率。

图4 酸性多糖含量测定标准曲线Fig.4 The standard curve of determination of acidic polysaccharidescontent
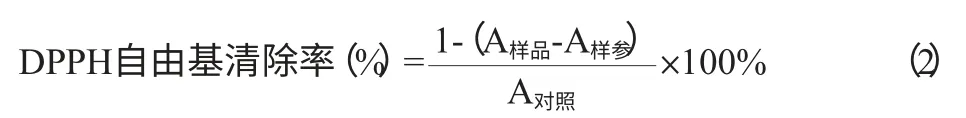
式中:A样参、A样品、A对照分别表示对照管和样品管的吸光度值。
1.3.8 羟自由基(·OH)清除能力的测定
采用邻二氮菲-Fe2+法进行羟自由基(·OH)清除能力的测定,并参照KIM JH 等[12]的方法进行改良。蒸馏水为空白,分别向未损伤管、损伤管、样参管中加入水1.25mL、1mL、0.75mL,样参管和样品管各加样品1mL,未损伤管、损伤管、样品管中各加7.5×10-3mol/L邻二氮菲0.25mL,向4个管中各加1.5×10-4mol/L磷酸缓冲液(pH7.4)3.25mL后,充分混匀,向未损伤管、损伤管、样品管中加入7.5×10-4mol/L FeSO40.25mL,迅速混匀,损伤管和样品管加入0.1%H2O20.25mL,37℃水浴90min,在波长536nm处测吸光度值,并按照式(3)计算羟自由基清除率。

式中:A未损伤、A损伤、A样品、A样参分别表示未损伤管、损伤管、样品管、样参管的吸光度值。
2 结果与讨论
2.1 提取温度对多糖提取效果的影响
温度对多糖提取效果的影响见图3。在4℃、50℃和100℃条件下对新鲜的山楂果肉、全果提取多糖时,100℃时多糖得率最高,山楂果肉、全果多糖得率分别达到3.72%、3.65%,说明山楂中多糖基本存在于果肉中。50℃时,提取率分别为2.37%、2.78%。4℃提取山楂多糖得率最低为2.05%、2.17%。这可能由于温度升高,多糖的溶解度增大或者高温破坏了山楂的组织结构,使多糖更易溶出。李艳红[13]用微波提取鲜山楂中多糖40min,提取率为2.06%;刘巧利等[14]加14倍体积的水,并浸泡1h,加热回流3h,提取多糖的最高得率为3.8%,方法相对复杂,成本高,且黄酮得率达到2.56%,多糖得率仅高出0.08%。

图5 不同温度提取山楂果肉、全果多糖的提取率比较Fig.5 Comparison of the extraction yields of hawthorn polysaccharides by different extraction temperature
2.2 提取温度对山楂多糖黏度的影响
提取温度对山楂多糖黏度的影响见图4。随着提取温度的升高,山楂果肉和全果提取的多糖黏度均降低。在多糖浓度相同时,山楂果肉和全果提取的多糖黏度并无显著差异。当多糖浓度为10mg/mL时,在室温条件下测多糖的黏度,4℃提取果肉、全果多糖黏度分别是166mPa·s、158mPa·s,100℃提取时最低分别为38mPa·s、30mPa·s。多糖分子质量、分子的构造与支链的个数等都影响多糖的黏度[15]。在相同提取温度时,以山楂果肉和全果为原料水提的多糖黏度相近。本实验中不同温度提取多糖黏度有明显的差异,这可能是由于冷水、热水可溶性多糖本身性质的不同,或者是提取温度的升高引起多糖性质的改变。

图6 不同温度提取山楂果肉、全果多糖的黏度比较Fig.6 Comparison of the viscosity of hawthorn polysaccharides by different extraction temperature
2.3 提取温度对山楂多糖化学成分的影响
不同温度条件下提取的山楂多糖的化学成分见表1。随着温度的升高,多糖中的蛋白质含量下降,提取温度为4℃时,山楂果肉和山楂果中的蛋白质含量为4.78%和4.60%,当温度提高为100℃时蛋白质含量分别降为3.50%和3.57%。山楂多糖中还原糖的量随着温度的升高而升高,相反,中性多糖和酸性多糖含量随着温度的升高而下降。因此,可以推测山楂的提取过程中随着温度的变化其多糖成分的结构级分子质量可能发生了改变,从而引起其还原糖量增加,中性多糖和酸性多糖的含量下降。
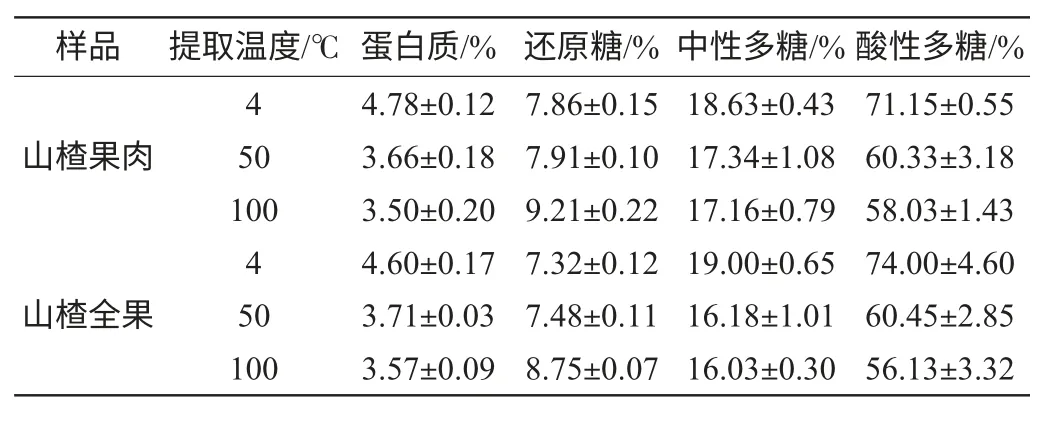
表1 不同温度提取山楂多糖的化学特性Table 1 The chemical properties of hawthorn polysaccharides by different extraction temperature
2.4 提取温度对山楂多糖DPPH自由基和·OH自由基清除能力的影响
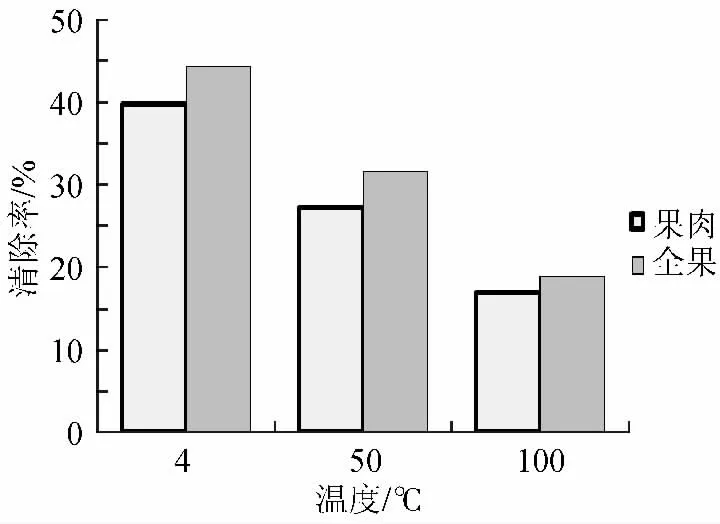
图7 提取温度对山楂果肉、全果多糖DPPH清除率的影响Fig.7 Effects of different extraction temperature on DPPH radical scavenging activity of hawthorn polysaccharides

图8 提取温度对多糖·OH清除率的影响Fig.8 Effects of extraction temperature on hydroxyl radical scavenging capacity of hawthorn polysaccharides
提取温度对山楂多糖DPPH自由基和·OH自由基清除能力的影响见图7、图8。4℃提取的山楂多糖对自由基的清除能力最高,多糖浓度为1mg/mL时,山楂果肉、全果多糖的DPPH自由基清除能力分别为39.7%、44.2%,对·OH自由基的清除能力分别为26.1%、14.9%。100℃提取的山楂多糖对DPPH自由基的清除能力最低,分别为16.8%、18.8%,对·OH自由基的清除能力分别为19.9%、13.0%。这表明山楂核中含有影响山楂多糖抗氧化能力的成分,可提高山楂多糖清除DPPH自由基的能力。王振斌等[16]对超声波提取的无花果多糖的抗氧化性进行了研究发现,无花果多糖浓度为0.2%时,对·OH自由基的最高清除率为30.3%。杜丽娟等[17]对山楂果胶酶解物进行研究发现,其在1.0%浓度条件下对DPPH自由基清除率甚至达到100%,为天然食品抗氧化剂及抗氧化食品的开发提供了依据。
3 结论
本研究将山楂果肉与整果分开提取多糖,研究表明山楂中的多糖主要存在于果肉中。从新鲜山楂果肉、全果中提取的粗多糖呈淡黄色,不溶于乙醇,难溶于冷水,易溶于热水,对DPPH自由基有很高清除能力,表现出一定的抗氧化性。100℃提取时,得率最高分别为3.72%和3.65%,4℃提取的多糖黏度最高,多糖溶液为10mg/mL时,山楂果肉、全果的黏度分别是166mPa·s 和158mPa·s,多糖浓度为1mg/mL时,山楂多糖对DPPH自由基和·OH表现出一定的清除作用。随着提取温度的上升,山楂粗多糖中还原糖的量增加,相反中性多糖和酸性多糖含量降低,自由基清除能力下降。在相同提取温度时,山楂果肉和山楂果的提取率和多糖成分无明显的差异,但对其抗氧化能力有一定影响。
[1]李艳红.山植多糖的提取、分离纯化及结构研究[D].太原:山西大学硕士论文,2006.
[2]ENRIQU G,JOSE A.,IASI PR..Isolation and chemical characterization of algal polysaccharides from the green seaweed Ulva clathrata(Roth)C.Agardh[J].J Appl Phycol,2011,23:537-542.
[3]唐礼可.山楂多糖抗疲劳作用实验研究[J].云南中医中药杂志,2008,29(2):32-33.
[4]闫启光.山楂多糖对小鼠免疫功能的影响[J].中国中医药咨讯,2009(6):134.
[5]杜丽娟,李拖平,王 娜,等.山楂果胶分解物抗氧化作用研究[J].食品研究与开发,2009,30(6):18-20.
[6]戴远臣,侯红漫,张公亮.山楂多糖的提取条件优化及对保加利亚乳杆菌的增殖影响[J].中国酿造,2012,31(1):136-140.
[7]赵晨淏,刘钧发,冯梦莹,等.不同提取方法对龙眼多糖性质的影响[J].现代食品科技,2012,28(10):1298-1301,1305.
[8]DANIEL MB,MICHAEL DR,STUART JE.Protein Method[M].New York:John Wiley&Sons Canada,Ltd.,1996.
[9]王俊刚,张树珍,杨本鹏,等.3,5-二硝基水杨酸(DNS)法测定甘蔗茎节总糖和还原糖含量[J].甘蔗糖业,2008(5):45-49.
[10]李小平.红枣多糖提取工艺研究及其生物功能初探[D].西安:陕西师范大学硕士论文,2004.
[11]郭 欣,高向东,杨晓兵.酸性多糖中的葡萄糖醛酸与中性糖的含量测定[J].中国生化药物杂志,2004,25(2):100-101.
[12]KIM J H,NAM S H,RICOL C W,et al.A comparative study on the anti-oxidative and anti-allergic activities of fresh and aged black garlic extracts[J].Int J Food Sci Tech,2012,47(6):1176-1182.
[13]李艳红.微波法与热水法提取山楂多糖的比较研究[J].基层医学论坛,2009,13(4):346-348.
[14]刘巧利,王柳云,严建业,等.山楂中总黄酮和多糖的提取工艺研究[J].中南林业科技大学学报,2010,30(9):162-165.
[15]王 娜,张陈云,戚雨妲,等.山楂果胶的提取及其食品化学特性[J].食品工业科技,2007,28(11):87-89,92.
[16]王振斌,孙亚钊,郭 强.超声波对无花果多糖抗氧化活性的影响[J].食品工业科技,2013,34(3):97-99.
[17]杜丽娟,李拖平,王 娜,等.山楂果胶分解物抗氧化作用研究[J].食品研究与开发,2009,30(6):18-20.

