丙戊酸钠对胃癌SGC-7901细胞的放疗增敏作用
陈秀萍 楚建军 王忠超
目前研究认为组蛋白去乙酰化酶(HDAC)在胃癌组织中的表达水平明显高于癌旁正常黏膜组织,提示HDAC1参与胃癌的发生发展。丙戊酸钠(valproic acid,VPA)已广泛用于癫痫和精神疾病治疗中,越来越多的研究表明,丙戊酸钠作为组蛋白去乙酰化酶抑制剂具有抗肿瘤的作用,但关于其在肿瘤放疗方面的作用报道较少。本实验应用不同浓度的丙戊酸钠作用胃癌细胞系SGC-7901,观察其细胞毒性及放射增敏用,并探讨其机制,为丙戊酸钠应用于胃癌放射治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器 人胃癌细胞株SGC-7901细胞由苏州大学附属第四人民医院肿瘤研究所提供;胎牛血清购自杭州四季青公司,高糖DMEM、胰蛋白酶、四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)、Giemsa染色、凯基细胞周期检测试剂盒均购自南京凯基生物公司;注射用丙戊酸钠购自南开允公药业有限公司。美国Varian公司23EX医用直线加速器,FACS Vantage SE型流式细胞仪为美国BD公司产品。
1.1.2 细胞照射方法 应用6MV X线等中心照射,机架旋转180度,源皮距为100 cm,射野大小为10 cm×10 cm,剂量率为200 cGy/min。根据不同的照射剂量计算相应的Mu值。为使剂量平均分布,及细胞达最大吸收剂量,照射时其上下各置1.5 cm厚的组织等效填充物。
1.1.3 细胞培养 将人胃癌细胞株SGC-7901细胞置于含有10%胎牛血清、链霉素和青霉素各100 U/mL的高糖DMEM培养液中,置于37℃、5%CO2饱和湿度培养箱中培养,培养至70% ~80%融合时,用PBS洗涤,0.25%胰酶消化传代继续培养。取对数生长期细胞进行实验。
1.2 方法
1.2.1 MTT法检测丙戊酸钠对SGC-7901细胞抑制率 取对数生长期SGC-7901细胞,消化制成细胞悬液,设空白组(只有培养液,不含有细胞和丙戊酸钠)和对照组(含有细胞和培养液但不加丙戊酸钠),4 000个细胞/孔接种于96孔培养板,培养24 h后,弃去旧培养液,加入用DMEM培养液稀释的200 μL不同浓度的丙戊酸钠(0.75、1.5、3.0、4.0、8.0 mmol/L),每个浓度取3个时间点检测(24、48、72 h),设6个复孔,培养24、48、72 h 后加 MTT 50 μL 再培养 4 h。弃上清,加150 μL DMSO,避光平板摇床震荡10 min,使结晶颗粒充分溶解,酶标仪检测各孔490 nm处的吸光度(OD)值。实验重复3次。计算各组细胞增殖抑制率。细胞增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%,根据半数抑制浓度(IC50),计算丙戊酸钠作用胃癌细胞株SGC-7901细胞不同时间点后50%的细胞生长抑制的浓度,即IC50。上述实验重复3次。
1.2.2 细胞周期检测 实验分为4组。对照组:加入不含丙戊酸钠的培养液培养48 h;单纯放疗组:加入培养液培养4 h后进行4 Gy照射,继续培养44 h;药物组:加入含3.0 mmol/L的丙戊酸钠的培养液培养48 h;联合组:加入含3.0 mmol/L的丙戊酸钠的培养液培养4 h后进行4 Gy照射,继续培养44 h。收集细胞1×106/ml,用预冷的70%乙醇固定,染色前洗去固定液,用 PBS洗 3遍,加 100 μL RNase A 37℃水浴 30 min,加入400 μL PI染色混匀,4℃避光30 min,应用流式细胞仪检测,记录细胞周期各时相的百分比,每组重复3个样本,取平均值。
1.2.3 细胞凋亡检测 实验分组同1.2.2,收集(1~5) ×105/ml细胞,加入 500 μL 的 Binding Buffer悬液细胞,加入5 μL Annexin V-FITC 混匀,加入5 μL PI混匀。室温避光反应15 min,1 h内应用流式细胞仪检测。
1.3 统计学处理
应用统计软件包SPSS 17.0进行方差分析,计量资料以表示。
2 结果
2.1 不同浓度丙戊酸钠作用不同时间胃癌SGC-7901细胞抑制率
MTT检测结果显示,丙戊酸钠可显著抑制SGC-7901细胞生长,呈浓度、剂量依赖性(图1),各组间比较P<0.05。根据丙戊酸钠对胃癌SGC-7901细胞的生长抑制率计算其作用24、48、72 h的 IC50分别为19.83、3.67、2.75 mol/L。
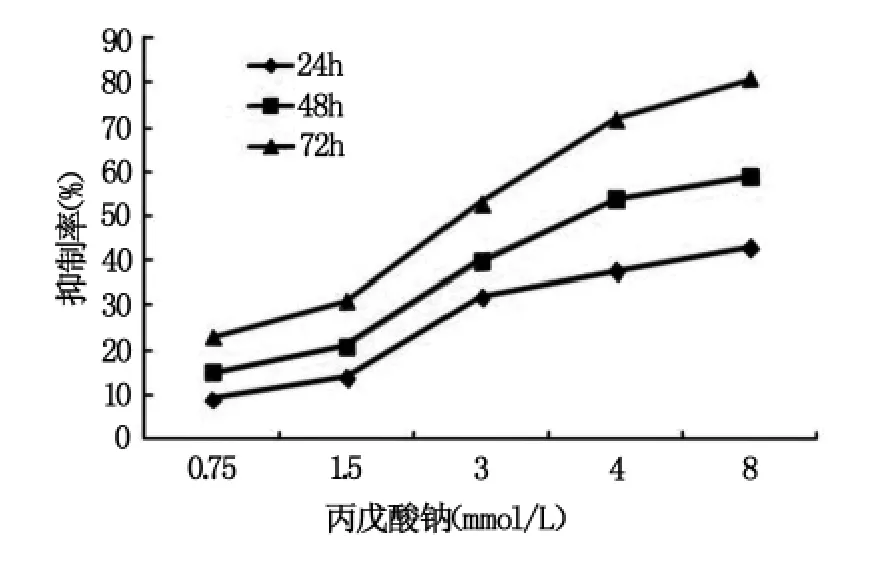
图1 不同浓度丙戊酸钠对胃癌SGC-7901细胞的抑制
2.2 流式细胞术检测各组SGC-7901细胞周期的分布
SGC-7901细胞经丙戊酸钠和放疗处理后,G0/G1期细胞比例增大,S期细胞比例明显减小,而这种情况在丙戊酸钠联合放疗组中更为明显,差异均具有统计学意义(P <0.05)(表1)。
表1 FCM检测SGC-7901细胞周期分布(,%)
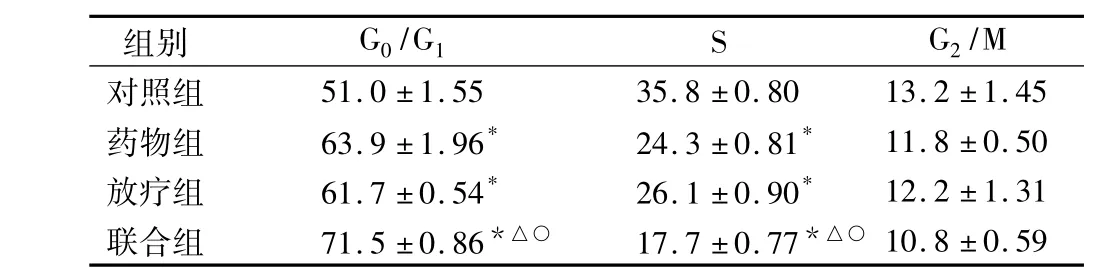
表1 FCM检测SGC-7901细胞周期分布(,%)
*为与对照组比较P<0.05,△为与药物组比较 P<0.05,○为与放疗组比较,P <0.05
/M对照组组别 G0/G1 S G2 10.8 ±0.59 51.0 ±1.55 35.8 ±0.80 13.2 ±1.45药物组 63.9 ±1.96* 24.3 ±0.81* 11.8 ±0.50放疗组 61.7 ±0.54* 26.1 ±0.90* 12.2 ±1.31联合组 71.5±0.86*△○ 17.7±0.77*△○
2.3 流式细胞术检测各组SGC-7901细胞凋亡情况
丙戊酸钠组、放疗组、联合组SGC-7901细胞凋亡率均高于对照组,差异具有统计学意义(P<0.05),且联合组凋亡率高于丙戊酸钠组及放疗组(P<0.05)(表2)。
表2 FCM检测SGC-7901细胞凋亡情况(,%)

表2 FCM检测SGC-7901细胞凋亡情况(,%)
*为与对照组比较P<0.05,△为与药物组比较 P<0.05,○为与放疗组比较P<0.05
组别 凋亡率(%)2.69 ±0.07药物组 20.35 ±0.49*放疗组 14.89 ±1.13*联合组 31.32 ±1.03对照组*△○
3 讨论
胃癌是最常见的恶性肿瘤之一。每年约有60余万人因胃癌死亡,居癌症死因的第2位[1]。随着放射源的发展,放射生物学的进步以及治疗方法的改进,特别是直线加速器应用于临床后,已有研究报道,术后辅助的放疗或放化疗不仅能提高胃癌的局控率,而且还能提高胃癌患者的生存率[2]。Mayo Clinic组的研究结果提示:增加放疗剂量可以明显提高胃癌患者的术后局部控制率和长期生存率。但胃周围重要器官如肝、小肠、肾和脊髓等对放射线耐受性[3],限制了治疗剂量的提高。由于胃癌对放疗的敏感性有限,因此放射增敏剂可以用于增强放疗敏感性[4]。
组蛋白乙酰化/去乙酰化及其调节酶的异常与胃癌发生、发展存在密切的联系。其中组蛋白乙酰化酶(HAT)和组蛋白去乙酰化酶(HDAC)是组蛋白乙酰化的关键酶,决定着组蛋白的乙酰化程度,参与肿瘤异常基因表达。组蛋白去乙酰化酶(HDAC)活性改变与肿瘤的发生相关。近期研究发现,HDAC出现在调节细胞周期和凋亡的蛋白复合体中。HDACs调节各种组蛋白和非组蛋白的乙酰化,控制基因的转录调控,参与细胞周期、增殖、存活、DNA修复和分化[5]。组蛋白的乙酰化和去乙酰化之间的平衡是调节基因表达的1个重要因素,通常认为组蛋白的高乙酰化是活跃转录染色质的1个标志,而低乙酰化则与转录抑制有关[6]。丙戊酸钠(VPA)是治疗癫痫的1种传统药物,毒副作用比较小。近期研究证实其是HDAcs特异性抑制剂之一,能使染色体成阻抑结构而抑制基因的转录[7],在体外对于多种肿瘤细胞系有抑制细胞增殖作用。因此,增强HAT表达和(或)降低HDACs表达就成为肿瘤治疗研究的新思路。HDACs抑制剂在治疗肿瘤中的作用也日益受到重视。
本实验观察选择性HDAC抑制剂丙戊酸钠对胃癌SGC-7901细胞增殖抑制、细胞周期和细胞凋亡,探讨其放射增敏机制。我们将VPA应用于胃癌细胞系SGC-7901,通过体外实验证实,VPA可明显抑制胃癌细胞的生长,并且此抑制作用呈剂量与时间依赖趋势,G0/G1期细胞群比例增加,S期细胞群比例明显减少,而这种趋势在丙戊酸钠联合放疗组中更为;在诱导细胞凋亡方面,各试验组均有不同程度凋亡增强,与对照组比较差异有统计学意义,丙戊酸钠联合放疗组凋亡趋势更加明显。上述结果表明,丙戊酸钠、放疗均能使细胞周期阻滞在G0/G1期,且联合组对G0/G1期的阻滞作用更加显著。一般来说,不同时相细胞的放射敏感性有区别[8],G2/M期对放射线最为敏感,其次是G1期,S期则最不敏感。有实验研究表明,丙戊酸钠可以通过上调P21(Waf/cip1),Mad1的表达及其下调Cyclin A,c-Myc的表达使BGC823细胞阻滞于G1期,并通过诱导Caspase 9和Caspase 3的活性来调节凋亡[9]。
综上所述,丙戊酸钠对胃癌细胞SGC-7901有较好的抑制效果,其机制可能与丙戊酸钠改变了细胞周期分布、增加了放射敏感性有关。对丙戊酸钠放疗增敏作用及其机制的进一步研究必将为胃癌的治疗开辟出新的途径。
[1]郑 奇,龙 剑,邱 卓.进展期胃癌的综合治疗现状及进展〔J〕.实用癌症杂志,2009,24(3):324.
[2]李夷民,吴君心,潘建基.胃癌术后放射治疗的进展〔J〕.实用癌症杂志,2007,22(5):532.
[3]Jansen Ep,Saunders MP,Boot H,et al.Prospective study on late renal toxicity following postoperative chemoradiotherapy in gastric cancer〔J〕.Int J Radiat Oncol Biol Phys,2007,67:781.
[4]Xinhua Liao,Xiangming Che,Wei Zhao,et al.Effects of propranolol in combination with radiation on apoptosis and survival of gastric cancer cells in vitro〔J〕.Radiation Oncology,2010,5:98.
[5]K Ted Thurnl,Scott Thomasl,Amy Moorel,et al.Rational therapeutic combinations with histone deacetylase inhibitors for the treatment of cancer〔J〕.Future Oncol,2011,7(2):263.
[6]Rea S,Eisenhaber F,O'Carroll D,et al.Regulation ofchromatin st ructure by site2specific histone H3met hylt ransferases〔J〕.Nature,2000,406(6796):593.
[7]Marks PA,Rifkind RA,Richon VM,et al.Histone deacetylases and cancer:causes and therapies〔J〕.Nature,2001,1:194.
[8]Pawlik TM,Keyomarsi K.Role of cell cycle in mediating sensitivity to radiotherapy〔J〕.Int J Radiat Oncol Biol Phys,2004,59(4):928.
[9]Zhao X,Yang W,Shi C,et al.The G1phase arrest and apoptosis by intrinsic pathway induced by valproic acid inhibit proliferation of BGC-823 gastric carcinoma cells〔J〕.Tumour Biol,2011,32(2):335.

