高效脂肪酶产生真菌的筛选、鉴定及产酶条件优化
■郭 威 郭晓军 袁洪水 王星懿 王世英 朱宝成
(河北农业大学生命科学学院,河北保定 071000)
酶制剂[1]是酶经过提纯、加工后的具有催化功能的生物制品,近年来一直是国内外动物营养研究的热点之一。脂肪酶作为工业酶制剂中重要的生物催化剂之一,在饲料行业中有着广泛的研究潜力和应用前景。王琰等[2]建立了具有陕西特色的应用于饲料行业的微生物脂肪酶菌种库,K.Nar⁃reborg等[3]研究了猪胰脂肪酶粗提物与胆汁盐对脂肪消化的影响,均处于起步阶段。
脂肪酶广泛存在于动物、植物和微生物中[4]。目前已发现至少有60多个属的微生物可以产生脂肪酶[5]。研究发现,微生物脂肪酶可提高断奶仔猪的生产性能,减轻断奶仔禽、仔畜的营养应激[6],比动物脂肪酶酶解作用的pH值和温度范围更宽,便于工业化生产获得高纯度酶制剂[7],因此成为工业生产脂肪酶的主要来源。
据报道,微生物是有效的脂肪酶产生者,并且霉菌能够产生大量的脂肪酶[8]。本文从富含油脂的土壤中分离到1株产脂肪酶的真菌,经鉴定属于黑曲霉属,命名为GW-1,同时对该菌株的产酶条件进行了优化,获得了其最佳产酶条件。本试验将为酶制剂的生产提供重要的种质资源,并为该菌株的工业化生产提供重要的依据。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
土样采自河北农业大学餐厅周围富含油脂的土壤。
1.1.2 培养基
真菌富集培养基:(NH4)2SO40.5 g、NH4NO30.1 g、NaCl 0.1 g、MgSO4·7H2O 0.1 g、K2HPO40.5 g、FeSO4·7H2O 0.1g,10 ml橄榄油。用0.1 mol/l NaOH 调节溶液pH值至8.0。
种子培养基:(NH4)2SO45.0 g、K2HPO41.0 g、MgSO4·7H2O 0.5 g、葡萄糖20 g、蛋白胨25 g、橄榄油10 ml、蒸馏水1 000 ml,pH值8.0,115 ℃灭菌30 min。
发酵培养基:(NH4)2SO41.0 g、MgSO4·7H2O 1.0 g、NaH2PO41.0 g、K2HPO42.0 g、橄榄油10 ml、黄豆粉 20 g、蔗糖 10 g、蒸馏水 1 000 ml,pH 值8.0,115℃灭菌30 min。
分离初筛培养基[9-10]:(NH4)2SO40.5 g、NH4NO30.1 g、NaCl 0.1 g、MgSO4·7H2O 0.1 g、K2HPO40.5 g、FeSO4·7H2O 0.1 g、琼脂20 g,溴甲酚紫2 mg,蒸馏水1 000 ml、pH值8.0,121 ℃灭菌15 min后,于60℃左右加含溴甲酚紫的聚乙烯醇橄榄油乳化液(12 ml/100 ml)。
橄榄油乳化液的配制:将橄榄油与2%的聚乙烯醇溶液按1∶3(v/v)混合,4℃静置1 h后于组织搅拌机中高速匀浆3 min即得。
斜面保藏培养基(PDA培养基[10]):马铃薯200.0 g/l,蔗糖 20.0 g/l、琼脂20.0 g/l。
1.2 试验方法
1.2.1 菌株的筛选
将采集的土壤进行富集培养[10]、平板分离和摇瓶发酵复筛[7],将产酶能力较高菌株挑选出来供进一步试验。
1.2.2 脂肪酶活力测定
采用橄榄油乳化液方法[11]测定脂肪酶活力。
酶活力单位定义:37℃、pH值7.0条件下,以每分钟产生1 μmol脂肪酸所需的酶量定义为1个脂肪酶国际单位(U)[11-12]。
1.2.3 菌种鉴定
1.2.3.1 形态学鉴定[13]
观察真菌菌落形态、颜色、有无色素产生等特征,根据《常见与常用真菌》进行菌种鉴定。
1.2.3.2 分子生物学鉴定
以该菌株的基因组DNA为模板进行ITS基因序列分析[14],PCR扩增其ITS序列,PCR扩增产物送北京福尔彻科技有限公司进行测序,将所得序列与GenBank数据库中序列进行Blast分析比对,并构建系统进化树。
1.2.4 产脂肪酶菌株的发酵条件优化
1.2.4.1 单因素试验
通过单因素试验确定产脂肪酶菌株产酶的最佳碳源、氮源、无机盐和诱导物。
1.2.4.2 正交试验
培养基组成和培养条件对产酶的影响分别按正交试验表L9(34)设计进行。
2 结果
2.1 菌种筛选
土样经富集、涂布平板后分离得到13株产脂肪酶菌株,经摇瓶发酵复筛得到产酶能力较强的GW-1菌株,经测定酶活达到19.86 U/(ml·min)。该菌在溴甲酚紫筛选培养基上形成明显水解圈(见图1),故选择GW-1作为后续试验研究菌株。
2.2 菌株鉴定
2.2.1 形态学鉴定
菌株GW-1在PDA培养基上28℃培养2~5 d。菌落迅速蔓延,初为白色,后变成鲜黄色直至褐色厚绒状,背面无色或中央略带黄褐色,见图2。
结合以上GW-1菌落形态观察,符合黑曲霉菌的相关描述,初步确定GW-1菌可能为黑曲霉菌。
2.2.2 菌株的分子学鉴定
以菌株GW-1的基因组DNA为模板,采用真菌ITS序列通用引物进行PCR扩增,在700 bp处有一条特异性条带(见图3)。PCR产物测序结果表明,片段长787 bp,有典型的ITS序列特征。
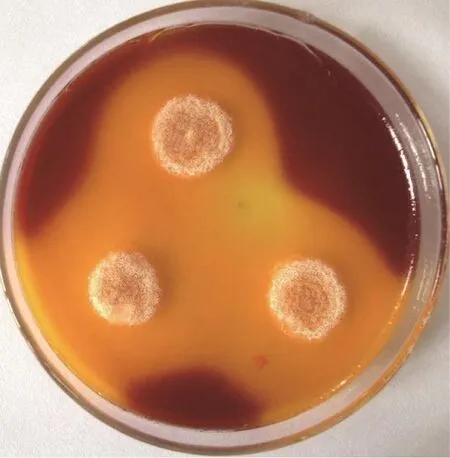
图1 菌株GW-1在溴甲酚紫培养基上形成明显水解圈

图2 菌株GW-1菌落形态
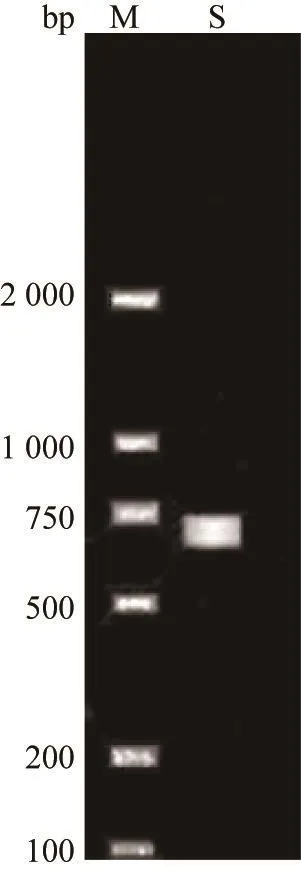
图3 GW-1菌株的ITS序列PCR产物电泳
将得到的扩增序列在NCBI网站上进行序列同源性比对。取与GW-1菌一致性在99%以上的序列,用MEGA5.0进行多序列比对并构建基因进化树(见图4)。结果显示,菌株GW-1与菌株CASMBSEF 15位于同一族群,亲缘关系最近,表明菌株GW-1属于曲霉菌属的Aspergillus niger。因此,将该菌命名为Aspergillus niger GW-1。
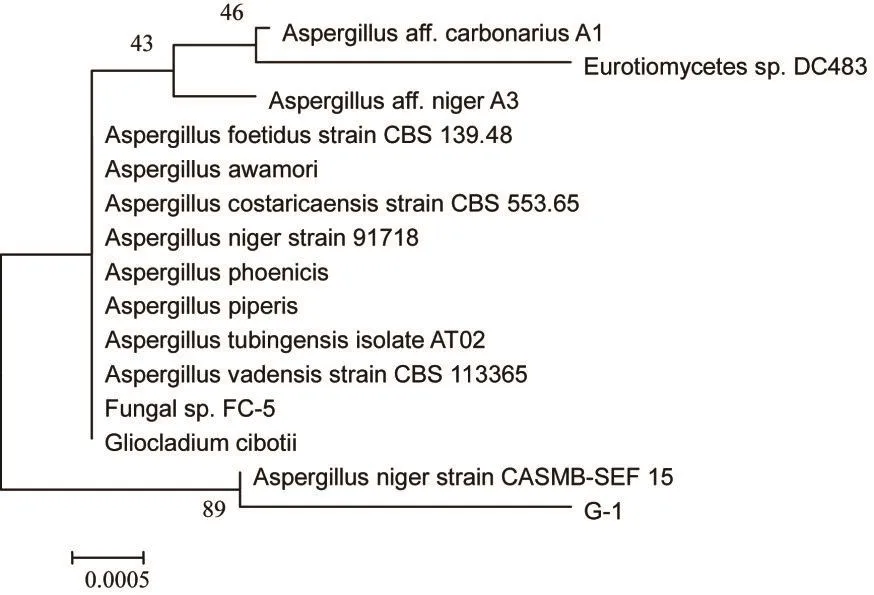
图4 GW-1菌株的ITS rDNA系统发育树
2.3 GW-1菌株产酶条件的优化
2.3.1 单因素试验
2.3.1.1 碳源对GW-1菌株产酶的影响(见图5)
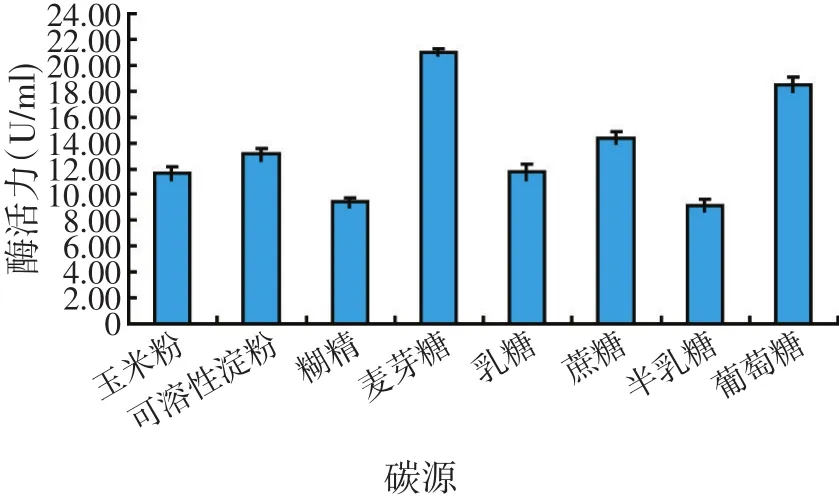
图5 碳源对产酶的影响
将菌株在不同碳源培养基中培养,分别测定发酵液脂肪酶活力,结果表明,碳源为麦芽糖和葡萄糖时该菌株产酶能力较高。由于两者酶活相当,故考虑到成本问题,选用葡萄糖作为最佳碳源。
2.3.1.2 氮源对GW-1菌株产酶的影响(见图6)
将菌株在不同氮源的发酵培养基中培养,分别测定发酵液脂肪酶活力,结果表明,菌株在5种氮源发酵培养基中产脂肪酶活力依次为黄豆粉>蛋白胨>酵母膏>尿素>牛肉膏。因此,GW-1菌株发酵产酶的最适氮源为黄豆粉。
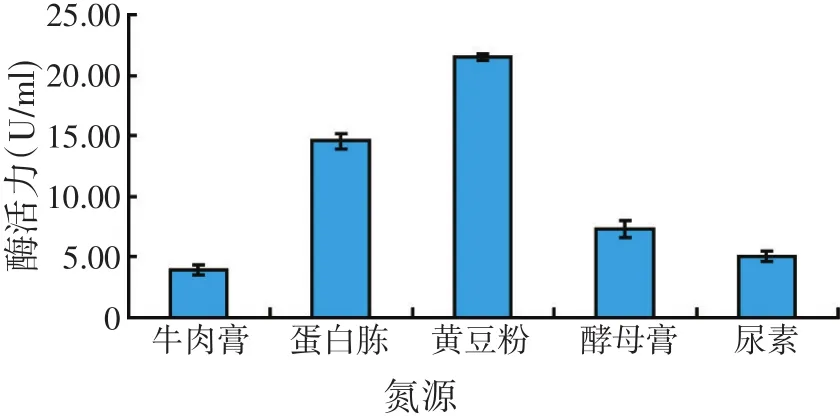
图6 氮源对产酶的影响
2.3.1.3 金属离子对GW-1菌株产酶的影响(见图7)
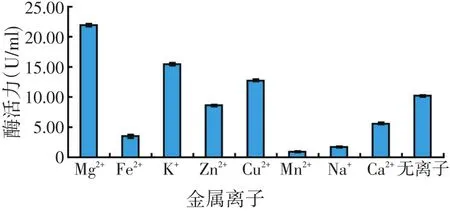
图7 金属离子对产酶的影响
将菌株在含有不同金属离子的发酵培养基中培养,分别测定发酵液脂肪酶活力。结果表明,Mg2+对该菌株产酶有明显的促进作用,K+和Cu2+也有不同程度的促进作用,而Fe2+、Na+、Zn2+、Mn2+和Ca2+分别有不同程度的抑制作用,其中Mn2+抑制作用最强,这与亓小宇报道的结果相一致[15]。
2.3.1.4 诱导物对GW-1菌株产酶的影响(见图8)
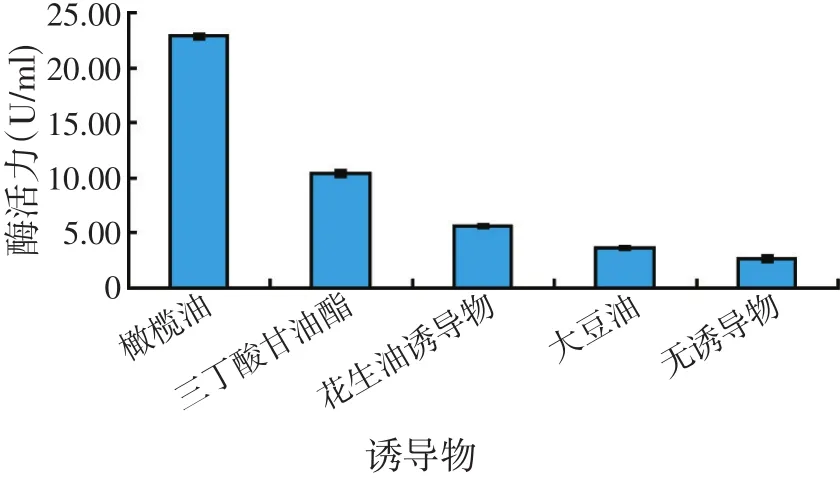
图8 诱导物对产酶的影响
在发酵培养基中添加不同种类的油脂作为脂肪酶的诱导剂,研究不同种类油脂对该菌株产酶的影响。结果表明,以橄榄油作为诱导剂效果最佳,是未添加诱导油脂的7.6倍。
2.3.2 正交试验
2.3.2.1 培养基组分配比正交试验
根据单因素的优化结果选取葡萄糖为碳源、黄豆粉为氮源、MgSO4·7H2O为无机盐,橄榄油为诱导物,改变碳、氮源以及无机盐和诱导物的浓度,进行正交试验,摇床振荡培养4 d,试验结果见表1。
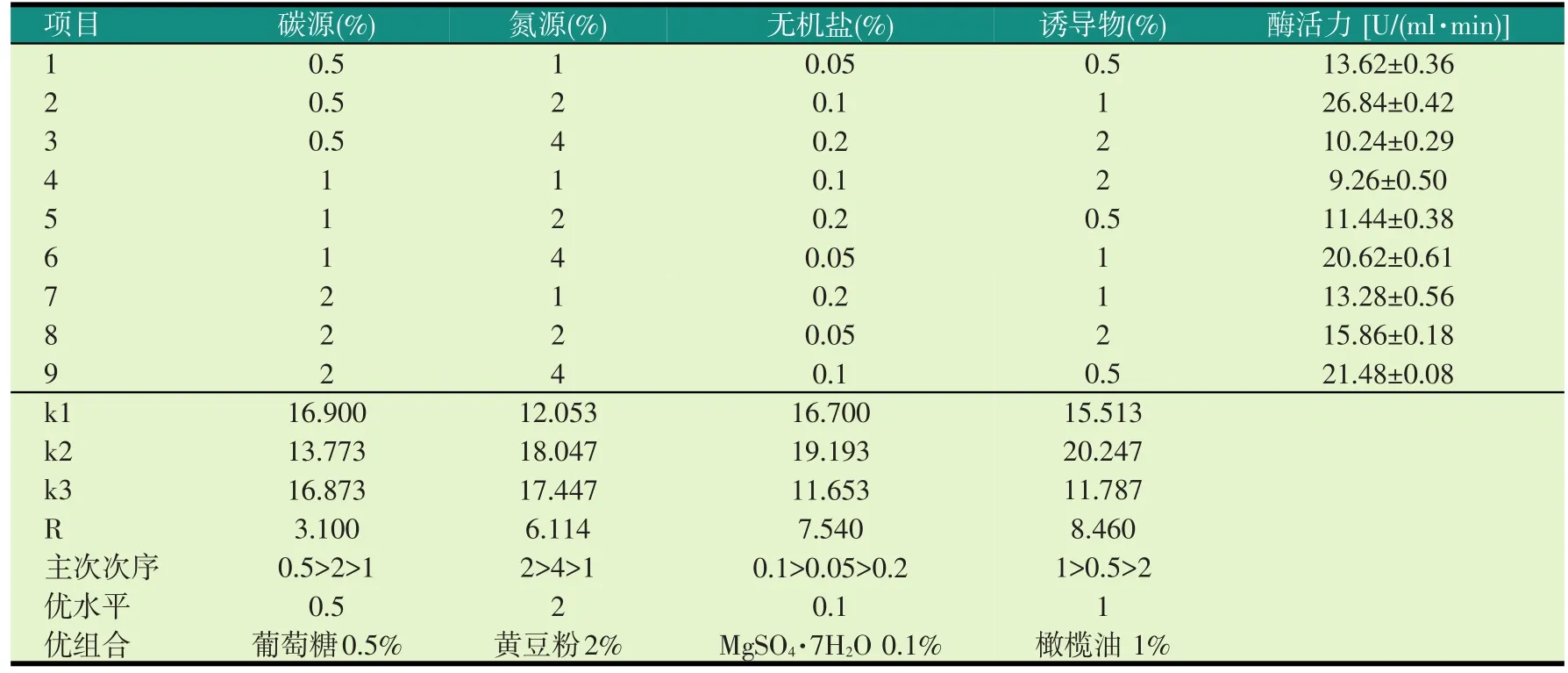
表1 培养基组分配比正交试验结果分析
对表1中的数据进行直观分析,得知各因素极差大小为R诱导物>R无机盐>R氮源>R碳源,即培养基中影响产酶的各因素主次顺序为:诱导物、无机盐、氮源、碳源。因此优化后的培养基为:葡萄糖0.5%、黄豆粉2.0%、MgSO4·7H2O 0.1%、橄榄油1%。菌株GW-1在此最优发酵条件下发酵测得的酶活为26.84 U/ml。
2.3.2.2 培养条件正交试验
以0.5%葡萄糖、2.0%黄豆粉、0.1%MgSO4·7H2O、1%橄榄油配制培养基,考察pH值、培养时间、装液量和接种量对GW-1菌株产酶的影响。对发酵培养条件进行优化,经过不同培养时间的摇床培养,按照不同的接种量,再将其分别接种到不同pH值和装液量的发酵培养基中摇床培养4 d后测定酶活力。结果表明,不同培养条件对产酶有着重要影响(见表2)。
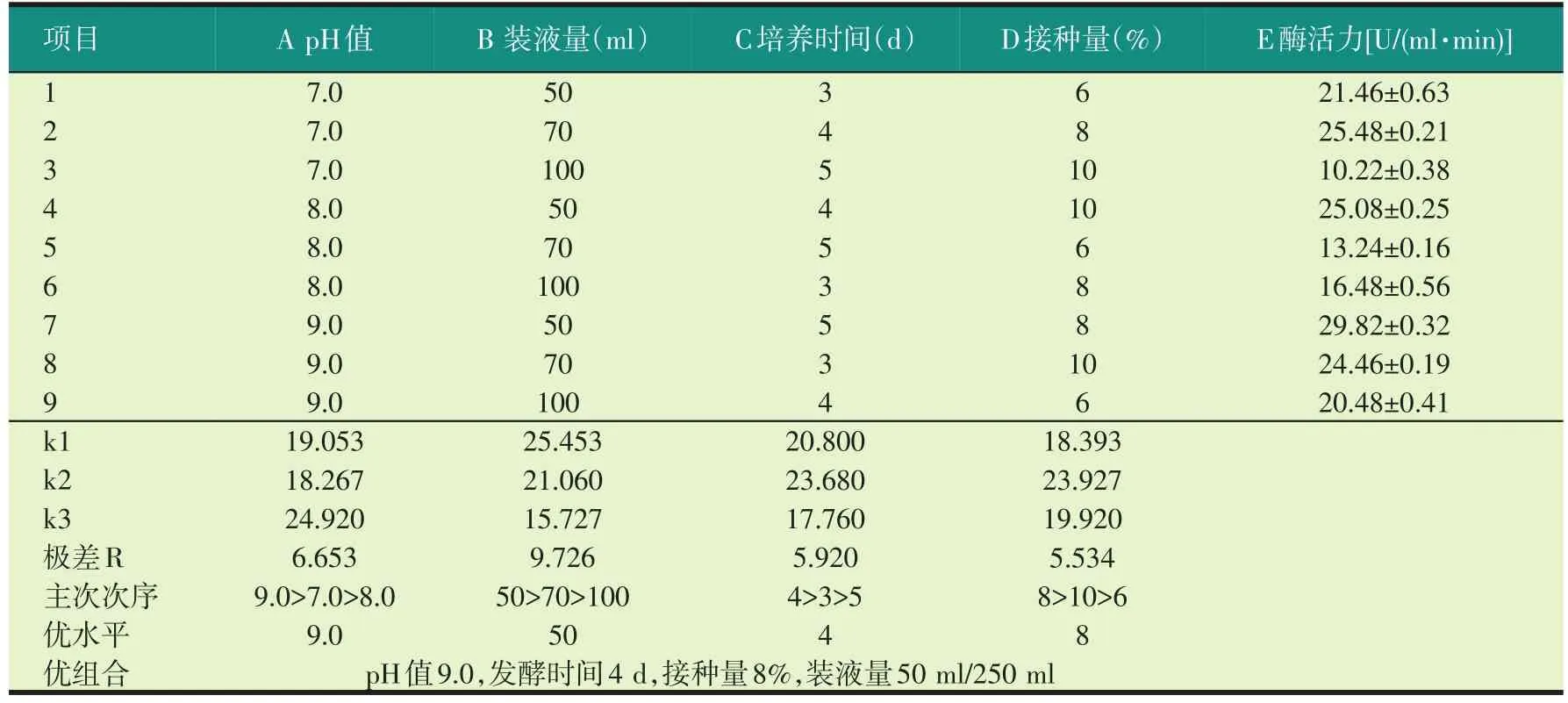
表2 培养条件正交试验结果分析
对表2中数据直观分析得知,各因素极差的大小为RB>RA>RC>RD,培养条件中影响脂肪酶产生的各因素主次顺序为:B>A>C>D,最佳的组合是A3B1C2D2。
由于正交试验处理中不包含有上述工艺条件组合,为此选取最佳A3B1C2D2组合和相近组合,即正交试验中脂肪酶产生最多的组合7在同等条件下进行验证。如表3所示,最佳组合脂肪酶酶活达到了39.82 U/(ml·min),而组合7的脂肪酶酶活为32.64 U/(ml·min),因此培养条件的最佳组合为初始培养基pH值9.0、培养时间4 d、接种量8%、装液量50 ml/250 ml,在此优化条件下脂肪酶酶活达到39.82 U/(ml·min)。
3 讨论
3.1 菌株的筛选与鉴定
产脂肪酶的微生物广泛分布在细菌、真菌和放线菌中。国内已进行了很多有关脂肪酶产生菌的筛选研究,已报道的菌株主要集中在假单胞菌属[16]、根霉属[17]和青霉属[9]等。本试验分离筛选获得的产酶菌株根据ITS基因序列并结合形态学鉴定为黑曲霉Aspergillus niger,而目前关于此属菌株能够产脂肪酶的研究报道很少,且黑曲霉有着发酵成本较低、较易成活等优势,具有较大的开发潜力和进一步深入研究的价值。
据报道,使用三丁酸甘油酯和吐温这样的人工脂质作为底物来检测脂肪酶活性被广泛推荐使用,但它们可能被酯酶水解而产生假阳性结果[18]。本文采用的橄榄油乳化法具有快速、灵敏的特点,由于使用天然底物故能筛选出真正产脂肪酶的菌株。
薛静等[19]报道的菌株09-7-1优化后脂肪酶活力达24.112 U/ml。赵伟等[20]报道的菌株CS1-1最大酶活达(37.6±0.8)U/ml。本研究获得的菌株GW-1在优化条件下,发酵液中粗酶活力可以达39.82 U/(ml·min),较上述报道的菌株脂肪酶活力高,充分显示了该菌株在产脂肪酶能力上的优越性。
3.2 碳源、氮源、金属离子及诱导物对GW-1菌株产酶的影响
关于碳源、氮源对细菌产酶活性的影响,一些研究指出以葡萄糖为碳源可获得理想的发酵效果[15],本试验结果与其基本一致;另外,报道中脂肪酶的发酵生产多采用牛肉膏为氮源[21],而本试验所选细菌以黄豆粉为氮源时,产酶效果明显好于以牛肉膏为氮源,这可能是因为微生物种类不同所致,并且也降低了生产成本。
与Rohit等[22]报导的结果相一致,本研究获得的菌株GW-1产酶依赖Mg2+浓度,添加微量Mg2+时产酶活性最高,但浓度过大会抑制该菌株的产酶活性。Fe2+、Na+、Zn2+和 Mn2+有不同程度的抑制作用,这种抑制效应可能是由于金属离子改变了酶活性部位的构象所引起。
大多数水解酶类是诱导酶,很多菌株产生的脂肪酶也多属于诱导酶,在培养基中添加适量油脂、表面活性剂及其某些结构类似物可有效促进产脂肪酶菌产酶或提高酶活性[23]。在体积分数为1%橄榄油的条件下产酶可提高7.6倍,但过多的橄榄油又会抑制脂肪酶的产生,这可能是因为油脂降解后的脂肪酸对脂肪酶有阻遏抑制的作用。
4 结论
获得1株高产脂肪酶真菌,该菌株产脂肪酶的报道较少。
通过正交试验,该菌株GW-1产酶活力较优化前提高了100.50%。

