TCD结合体位改变对脑血流自动调节评估在神经系统疾病中的应用价值
张金俏, 陈嘉峰, 邢英琦
TCD结合体位改变对脑血流自动调节评估在神经系统疾病中的应用价值
张金俏, 陈嘉峰, 邢英琦
脑血流自动调节(Cerebral autoregulation,CA)是指脑血流在动脉血压(Arterial blood pressure,ABP)和脑灌注压(Cerebral perfusion pressure,CPP)发生改变时保持相对稳定的能力。临床通过改变血压后测量脑血流的变化以反映CA的方式有很多,如:大腿袖带、下肢负压、冷加压试验,握拳动作、Valsalva动作等。经颅多普勒超声(Transcranial Doppler,TCD)是在生理和病理情况下测定脑血流速度和脑自动调节能力的有效工具[1],它结合体位改变对脑血流进行测量是一种更方便更易接受的方法,不论对卒中预后进行评估还是某些自主神经疾病的辅助诊断方面,均发挥了重要作用。近年来对CA的评价日益受到关注,TCD结合体位改变对脑血流进行测量可以对CA进行评估,卒中、多系统萎缩、焦虑症等疾病的发生发展与CA均密切相关,本文拟对缺血性脑血管病和其他神经系统疾病的TCD结合体位改变时脑血流变化的表现和价值进行综述。
1 TCD结合体位改变的检查方法
体位改变在目前被分为主动体位改变和被动体位改变。
1.1 倾斜试验检查方法 被动体位改变最常用的方法为倾斜试验(head-up tilt table tests,HUT),1986年由Kenny等[2]首次将其应用于临床,在对15例多次出现不明原因晕厥的患者和10例未曾出现过晕厥的正常对照组研究发现,在倾斜角40度的倾斜位保持60min,症状性患者的收缩压从150±32mmHg下降为56±9mmHg(P<0.001),心率从62± 9次/分下降为38±12次/min(P<0.001)。Zaidi等[3]对20例健康的受试者分别在4个不同角度进行试验,发现倾斜角小于60度时,对血流动力学影响较小。当倾斜角大于60度时,即使再继续增加倾斜角度,对心输出量和交感神经都没有进一步产生影响。因此研究认为60度是较实用的直立倾斜试验辅助诊断晕厥的倾斜角度。
1.2 卧立位脑血流检查方法 主动体位改变也称为卧立位脑血流改变,是通过经颅多普勒超声对受试者双侧大脑中动脉的流速进行监测,嘱其在仰卧位安静平躺2~3min,以此时形成的脑血流速度(cerebral blood flow velocity,CBFV)曲线为基线,嘱受试者在8s内迅速站起,并保持站立位2min,最后再次平躺2~3min,检查全过程要求在15min内完成,以此来观察各种波形的出现和流速的改变[4]。
2 卧立位脑血流变化机制
Smith等[5]研究认为健康的成年人由卧位变为立位时,心率会立即升高,并在8~15s时达到峰值后降落;动脉压和总的血管阻力在5~10s内迅速降低,而后迅速回调甚至高于基线。在正常的参与者中,假设直立位可以导致血流动力学的改变,其容易出现于起始的30s内。年龄为75岁以上的老年人中,体位性低血压的发生率较高,约为14%~20%,引起这种趋势的原因有:(1)循环系统本身的形态和功能改变; (2)自主神经功能的降低;(3)骨骼肌功能的损害[5]。
Xu等[4]将卧立位脑血流改变过程中形成的几个波形分别命名为X、W、H波(见图1),认为从卧位到立位时肌肉收缩所致动脉压的瞬间增高形成X波的上升支;变为立位后,由于血压急剧下降和压力反射调节机制所致的回调分别形成了X波的下降支和W波的上升支。由立位变为卧位时,血液再分布和神经反射调节可能是H波出现的潜在机制。站立时的CBFV平台曲线达不到卧位时的水平,这也反应了血压和脑自动调节之间的平衡被打破。
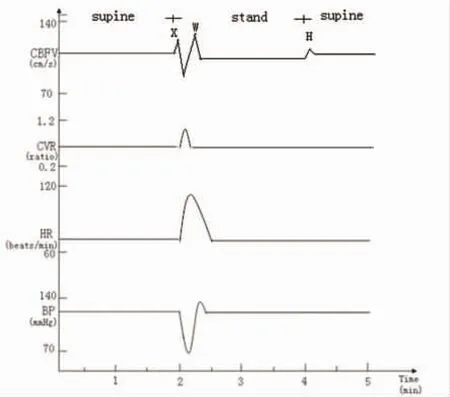
脑血流速度(CBFV);脑血管阻力指数(CVR);心率(HR);血压(BP)多采用先平卧2min,然后嘱患者迅速站立,站立2min后再重新恢复卧位。从卧位变为立位后,由于重力作用,先出现血压下降,随即心率加快、外周血管阻力增加,脑血流先下降,继而过度回调,出现W波,然后恢复至基线水平或者接近基线水平
3 应用的疾病和领域
3.1 卒中与体位改变的关系 脑自动调节能力常常在颈内动脉闭塞疾病中受到严重破坏,受损的CA是有症状或无症状颈内动脉狭窄或闭塞患者出现卒中或短暂性脑缺血发作(Transient Ischemic Attack,TIA)的重要危险因素[6]。CA严重下降,可预测无症状颈内动脉严重狭窄或者闭塞侧发生卒中和TIA的风险[7]。颈内动脉狭窄患者受损的CA在颈动脉内膜剥脱术后显著改善[8]。正常情况下,卧位变为立位时,由于重力和肌肉收缩作用使得血流再分布,回心血量减少,心搏出量减少,血压下降使颈动脉窦感受器激活,压力反射弧启动,继而交感神经兴奋导致心率反射性增加、心搏量增加、血压回升。当颈内动脉(internal carotid,ICA)严重狭窄或闭塞时,可造成患侧大脑半球血流灌注明显减低。用正电子发射断层扫描(Positron Emission Tomography,PET)对由颈内动脉严重狭窄所致肢体抖动性短暂性脑缺血发作的患者进行检查,基底节及大脑皮质出现明显低灌注状态[9]。Saqqur等[10]对16例有颅内动脉严重狭窄或存在血管机械压迫的患者进行TCD监测,这些患者分别在立位(63%)、坐位(44%)、行走(13%)及颈部过伸动作(6%)时出现神经系统症状。发现从静息到症状发生体位,除1例患者外其余有症状狭窄血管的平均血流速度(MFV)下降≥25%。分析原因为血管狭窄远端血流速度已经下降,随着体位改变血流进一步减低,导致此血管供血区出现低灌注,患者出现症状。Korpelainen等[11]研究认为卒中后出现体位性低血压并不常见,但Tang等[12]对49例既往出现过卒中的患者进行卧立位试验(Sit-Up Test)时发现,在姿势改变时有11例(22%)出现体位性低血压,或者脑灌注不足的症状。用这个简单的床边试验确定:超过20%的卒中患者容易出现体位性低血压和低灌注综合征。这也预示着他们存在更多的心脑血管疾病的独立危险因素。Gupta等[13]认为体位性低血压可出现脑灌注不足的症状(例如头晕、眼花),也可没有任何症状,即使没有出现低血压的症状,这部分人出现血流动力学改变、跌倒发作、晕厥的风险仍然较高。在卒中后自主神经功能也会受到影响,压力反射和血压控制功能障碍会导致脑灌注的不足。考虑到这些因素,确定卒中的患者是否存在体位性低血压对于预测心脑血管并发症是十分重要的。
3.2 多系统萎缩(multiple system atrophy,MSA)的体位性脑血流改变 多系统萎缩(MSA)的临床特点有:自主神经功能不全、肢体震颤、小脑性共济失调、锥体束症状、体位性低血压、尿失禁等。多系统萎缩(MSA)可分为以帕金森样症状为主,且对多巴胺反应欠佳的MSA-P型以及以小脑性共济失调为主要表现的MSA-C型。在MSA中,站立时脑灌注的不足主要与体位性低血压有关。Asahina等[14]对7例MSA患者和9例正常对照组通过TCD监测进行直立倾斜试验并通过近红外光谱分析法对MSA患者的脑血流动力学进行评估,在直立倾斜位置时平均动脉压在两组均出现下降,但MSA患者下降幅度(-40±6mmHg,-43%)约为正常对照组(-20±%mmHg,-21%)的2倍(P<0.001),MSA组心率上升(4±3/min,5%)明显低于正常对照组(8±5/min,12%)(P<0.05)。虽然被检查的MSA患者中,脑灌注压在直立倾斜实验时出现下降,但由于脑血管阻力的下降未导致严重血流速度的下降,故MSA的脑氧合作用没有严重下降。这些研究表明,MSA患者在直立性低血压时可以出现额外的脑血管舒张作用。脑血流灌注情况主要依赖于系统血压的自动调节能力,而不是脑自动调节能力。正常人群在站立时脑自动调节功能的激活需要平均动脉压至少为60mmHg,因此有体位性低血压的MSA患者的平均动脉压要维持在高于60mmHg的水平,以此来保证足够脑血流灌注。虽然 Jellinger等[15]在对42例后期确诊的MSA病例进行组织病理学研究时没有发现MSA-C型和MSA-P型自主神经和泌尿功能障碍存在差异;但Ozawa等[16]对100例MSA病例进行分析结果显示MSA-C比MSA-P表现出更多的自主神经功能不全的临床征象,但是这几项研究都是病例的回顾性分析。Schmidt等[17]通过病例的症状和自主神经测试对12例MSAC和26例MSA-P以及27例正常对照组发生自主神经功能不全的形式进行研究发现,MSA-P较MSA-C更易出现像血管舒缩功能、内分泌激活和胃肠道系统功能障碍等自主神经功能紊乱现象(P<0.05)。Claudia等认为皮肤交感神经反应试验是检测MSA-P和MSA-C显著差异唯一的方法:皮肤交感神经反应试验缺失在P型中为48%,C型为22%(P<0.05),而健康对照组仅为4%(P<0.001)。
Xu等[4]对可能的22例MSA和20例帕金森病(Parkinson disease,PD)患者及20例健康志愿者的CBFV曲线进行记录结果显示:MSA和PD患者CBFV在站立后的下降程度没有明显差异(9±7 vs.6±3cm/s,P=0.163),但MSA组“W”波消失率较高(见图2),“W”波出现在5/22(22.7%)的MSA患者中,显著低于PD患者(18/20,90%)和志愿者(20/20,100%)(P<0.001),但MSA和PD心脑血管自主调节功能不良的确切机制尚不明确。相对于正常志愿者和有自主神经功能障碍的PD患者,MSA患者中心压力感受器的衰竭更为严重。他们推测W波是否出现可能与中枢压力感受器的功能密切相关。因此卧立位脑血流改变可能对MSA及PD的鉴别提供一定的依据。
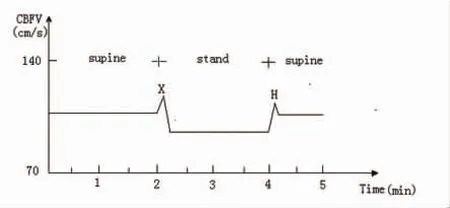
图2 MSA-C型患者主动体位改变时脑血流变化曲线
3.3 焦虑、抑郁的卧立位脑血流改变 焦虑症与自主调节功能衰竭有一定关系。Fiedorowicz等[18]认为焦虑是独立于肥胖、高血压、糖尿病的另外一种可导致血管疾病的危险因素。Czajkowska等[19]对年龄在30~75岁的无体位性低血压的74例受试者进行测试,结果显示:在焦虑症患者中会因为血压调控机制不全出现体位性低血压,在直立位出现临床症状。血压调节能力下降的个体出现认知和情感问题的风险会升高。出现体位性低血压时的血压调节能力降低与记忆力、注意力和高绝望指数密切相关。Yeragani等[20]发现焦虑症患者迷走神经兴奋性降低和交感神经功能增加,血压升高以及动脉顺应性降低并导致可能的动脉粥样硬化改变。Cohen等[21]在一项研究中报道:在66例不明原因晕厥的患者中,43%患有焦虑症,并发现焦虑症与直立倾斜试验阳性(出现症状性低血压和心动过缓定义为阳性)密切相关。Zhang等[22]及郭珍妮等[23]对焦虑症患者进行主动卧立位试验,发现焦虑症患者和正常对照组有明显的不同,从卧位快速变为立位时焦虑症患者CBFV的下降值更明显(见图3),考虑这可能与焦虑症患者脑血管自身调节受损,在体位改变时不能有效的保证脑血流灌注所致。
焦虑和抑郁常常同时出现,是预测心血管疾病事件独立危险因素[24]。抑郁的自主调节能力改变与心率变异率有关。心境状态比如抑郁的症状加重可使血管阻力增加,某些亚临床抑郁症状也可能与心血管疾病有关。在体位性低血压调节中,多巴胺的水平起到重要作用,并在抑郁的患者中受到累及[25~28]。但是关于抑郁的卧立位脑血流变化尚未有报道。
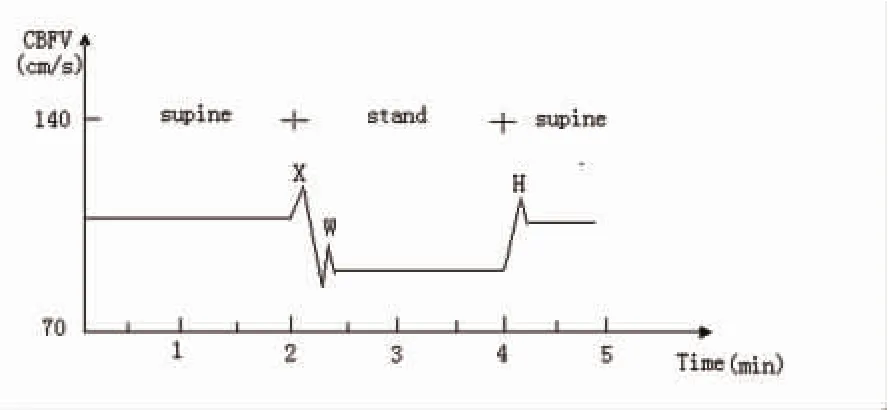
图3 焦虑症患者主动体位改变时脑血流变化曲线
3.4 晕厥与体位改变的关系 倾斜位诱导血管迷走性晕厥的机制尚不完全清楚,Bezold-Jarisch反射(心室壁感受器受化学性或机械性刺激诱发的血管迷走神经反射,在低血容量时可诱发,属于机体的保护性机制)是一个可能的原因[29]。晕厥患者的体位性低血压可能与受损的脑自动调节能力有关[30]。Lewis等[31]对17例血压正常的志愿者进行卧立位试验、60度倾斜试验并对大脑中动脉流速进行监测,发现清晨(P<0.01)和倾斜试验(P<0.01)时大脑中动脉的平均流速会低于基线水平的12%。这也支持流行病学资料显示的晕厥在清晨的发病率较高。有研究认为,先兆晕厥患者大脑中动脉平均脑血流速度基线值相比下降27.3% ± 14%(P<0.05),而 平均动脉血压持在高于基线2.0%± 27%的水平。用微小交感神经成像法在直立性血管迷走性反应时对患者进行研究,结果显示这部分患者肌肉交感神经活动在动脉血压下降时消失。尽管脑灌注不足可以用动脉血压的突然下降解释,但是并不能排除脑自动调节能力的改变会造成血管迷走神经反应事件的发生。这种可能性最初Grubb等[32]提出,并同时报道了在先兆晕厥前会出现舒张压和平均脑血流速度降低、搏动指数和脑血管阻力的升高,并总结为“血管舒缩能力失调”会导致直立位血管迷走反应。但是Grubb并没有确定脑血流速度的改变早于还是滞后于动脉血压的降低。Dan等[33]对15例参与者进行70度被动倾斜试验,通过TCD对脑血流动力学进行研究,并实时记录脑动脉血流速度和体循环动脉压,结果显示:8例男性出现前兆晕厥,6例男性和1例女性未出现。先兆晕厥的患者在脑部及全身血流动力学发生改变前出现头晕眼花、多汗、或持续155s(范围在25s~414s)疲劳的感觉。平均脑血流速度的改变比平均动脉血压的降低提前28s出现。脑部和全身血流动力学在无先兆晕厥的患者中保持不变。并得出结论:在伴有直立性和迷走神经性晕厥的患者中,先兆晕厥的症状及脑血流改变比动脉血压降低出现时间更早。Zhang等[34]对参与者在立位进行下肢加压试验,发现动态脑自动调节能力受损可以导致体位性低血压继而发生晕厥。Tellez等对晕厥的患者进行倾斜试验时发现血压下降的同时心电图上会出现RR间期缩短(P<0.001)。因此,对怀疑晕厥的患者进行体位改变的试验,可以为晕厥的诊断和治疗提供必要的客观依据。也有人对此提出相反意见,认为血管迷走神经性晕厥患者在进行倾斜试验时出现假阴性结果[35]。
4 其它应用
4.1 直立性心动过速综合征(postural orthostatic tachycardia syndrome,POTS) 是一种与体位有明确关系的窦性心动过速。有人用直立倾斜试验对其进行评价,发现POTS患者对体位变化反应异常敏感,并可以继发血管迷走神经性晕厥[36]。目前,已将此试验作为诊断POTS的标准方法:若倾斜后10min内心率增加大于30次/min(或最高心率达120次/min),血压无明显下降,并排除器质性心脏病和体位性低血压,即可诊断。
4.2 纯自主神经功能不良(pure autonomic failure,PAF)
是中枢神经系统退行性疾病并常常合并体位性低血压和晕厥,是周围自主神经选择性支配的结果,包括交感神经和副交感神经节后的衰竭。
4.3 精神心理性非癫痫样障碍(mental psychological non epileptic disorders,NEAD) 区分精神心理性非癫痫样障碍和真正的癫痫发作十分困难。长程脑电/视频记录是一种区别NEAD和癫痫发作的敏感工具,但是价格昂贵。Zaidi等[37]对21例反复癫痫样发作并在临床诊断为NEAD的患者进行倾斜试验。在试验过程中,17例患者(81%)出现典型的症状(15例患者出现非癫痫样肢体抖动,1例出现肌阵挛性抽搐,1例出现失神发作)而脑电图和血流动力学没有明显异常。患者在此试验未出现任何副作用和伤害,直立倾斜试验与目前的主动体位改变有异曲同工之处,因此可以作为诊断疑似NEAD患者并区别是否是真正癫痫发作的一种敏感工具。
综上所述:TCD结合主动体位改变观察在不同体位时脑血流的变化,可作为评估自动调节能力的首选方法。它可以为辨别缺血性脑血管病是由动脉-动脉栓塞还是低灌注引起提供依据,并对预测血管重度狭窄或闭塞患者卒中预后和复发风险提供重要信息;可为多系统萎缩、焦虑、晕厥等其他心脑血管疾病提供一定的诊断依据。TCD结合体位改变时脑血流变化情况以其独特的优点将为临床和科研提供更多有用的信息。
[1]Willie CK,Colino FL,Bailey DM,et al.Utility of transcranial Doppler ultrasound for the integrative assessment of cerebrovascular function[J].J Neurosci Methods,2011,196(2):221-237.
[2]Kenny RA,Ingram A,Bayliss J,et al.Head-up tilt:a useful test for investigating unexplained syncope[J].Lancet,1986,1(8494):1352-1355.
[3]Zaidi A,Benitez D,Gaydecki PA,et al.Haemodynamic effects of in
creasing angle of head up tilt[J].Heart,2000,83(2):181-184.[4]Xu WH,Wang H,Wang B,et al.Disparate cardio-cerebral vascular modulation during standing in multiple system atrophy and Parkinson disease[J].J Neurol Sci,2009,276(1-2):84-87.
[5]Smith JJ,Porth CM,Erickson M.Hemodynamic response to the upright posture[J].J Clin Pharmacol,1994,34(5):375-386.
[6]Diehl RR.Cerebral autoregulation studies in clinical practice[J]. Eur J Ultrasound,2002,16(1-2):31-36.
[7]Markus H,Cullinane M.Severely impaired cerebrovascular reactivity predicts stroke and TIA risk in patients with carotid artery stenosis and occlusion[J].Brain,2001,124(3):457-467.
[8]Mense L,Reimann M,Rudiger H,et al.Autonomic function and cerebral autoregulation in patients undergoing carotid endarterectomy[J]. Circulation journal:official journal of the Japanese Circulation Society,2010,74(10):2139-2145.
[9]Zaidat OO,Werz MA,Landis DM,et al.Orthostatic limb shaking from carotid hypoperfusion[J].Neurology,1999,53(3):650-651.
[10]Saqqur M,Sharma VK,Tsivgoulis G,et al.Real-time hemodynamic assessment of downstream effects of intracranial stenoses in patients with orthostatic hypoperfusion syndrome[J].Cerebrovasc Dis,2010,30(4):355-361.
[11]Korpelainen JT,Sotaniemi KA,Suominen K,et al.Cardiovascular autonomic reflexes in brain infarction[J].Stroke,1994,25(4):787-792.
[12]Tang A,Eng JJ,Krassioukov A.Application of the Sit-Up Test for orthostatic hypotension in individuals with stroke[J].Auton Neurosci,2012,168(1-2):82-87.
[13]Gupta V,Lipsitz LA.Orthostatic hypotension in the elderly:diagnosis and treatment[J].Am J Med,2007,120(10):841-847.
[14]Asahina M,Sato J,Tachibana M,et al.Cerebral blood flow and oxygenation during head-up tilt in patients with multiple system atrophy and healthy control subjects[J].Parkinsonism&Related Disorders,2006,12(8):472-477.
[15]Jellinger KA,Seppi K,Wenning GK.Grading of neuropathology in multiple system atrophy:proposal for a novel scale[J].Mov Disord,2005,20(Suppl 12):29-36.
[16]Ozawa T,Paviour D,Quinn NP,et al.The spectrum of pathological involvement of the striatonigral and olivopontocerebellar systems in multiple system atrophy:clinicopathological correlations[J].Brain: A journal of Neurology,2004,127(12):2657-2671.
[17]Schmidt C,Herting B,Prieur S,et al.Autonomic dysfunction in different subtypes of multiple system atrophy[J].Movement disorders: official journal of the Movement Disorder Society,2008,23(12): 1766-1772.
[18]Fiedorowicz JG,He JP,Merikangas KR.The association between mood and anxiety disorders with vascular diseases and risk factors in a nationally representative sample[J].Journal of Psychosomatic Research,2011,70(2):145-154.
[19]Czajkowska J,Ozhog S,Smith E,et al.Cognition and hopelessness in association with subsyndromal orthostatic hypotension[J].J Gerontol A Biol Sci Med Sci,65(8):873-879.
[20]Yeragani VK,Tancer M,Seema KP,et al.Increased pulse-wave velocity in patients with anxiety:implications for autonomic dysfunction[J].J Psychosom Res,2006,61(1):25-31.
[21]Cohen TJ,Thayapran N,Ibrahim B,et al.An association between anxiety and neurocardiogenic syncope during head-up tilt table testing[J].Pacing Clin Electrophysiol,2000,23(5):837-841.
[22]Zhang HL,Guo ZN,Yang G,et al.Compromised cerebrovascular modulation in chronic anxiety:evidence from cerebral blood flow velocity measured by transcranial Doppler sonography[J].Neurosci Bull,2012,28(6):723-728.
[23]郭珍妮,邢英琦,杨 乐,等.焦虑症患者卧立位脑血流调节研究初探[J].中风与神经疾病杂志,2011,28(1):50-52.
[24]Rutledge T,Linke SE,Krantz DS,et al.Comorbid depression and anxiety symptoms as predictors of cardiovascular events:results from the NHLBI-sponsored Women’s Ischemia Syndrome Evaluation (WISE)study[J].Psychosom Med,2009,71(9):958-964.
[25]Carney RM,Blumenthal JA,Stein PK,et al.Depression,heart rate variability,and acute myocardial infarction[J].Circulation,2001,104(17):2024-2028.
[26]Matthews SC,Nelesen RA,Dimsdale JE.Depressive symptoms are associated with increased systemic vascular resistance to stress[J]. Psychosom Med,2005,67(4):509-513.
[27]Carney RM,Rich MW,teVelde A,et al.The relationship between heart rate,heart rate variability and depression in patients with coronary artery disease[J].J Psychosom Res,1988,32(2):159-164.
[28]Frank JS,Horak FB,Nutt J.Centrally initiated postural adjustments in parkinsonian patients on and off levodopa[J].J Neurophysiol,2000,84(5):2440-2448.
[29]Abboud FM.Neurocardiogenic syncope[J].N Engl J Med,1993,328(15):1117-1120.
[30]Gur AY,Auriel E,Korczyn AD,et al.Vasomotor reactivity as a predictor for syncope in patients with orthostatism[J].Acta Neurol Scand,2012,126(1):32-36.
[31]Lewis NC,Atkinson G,Lucas SJ,et al.Is there diurnal variation in initial and delayed orthostatic hypotension during standing and headup tilt[J]?Chronobiol Int,2011,28(2):135-145.
[32]Grubb BP,Gerard G,Roush K,et al.Cerebral vasoconstriction during head-upright tilt-induced vasovagal syncope.A paradoxic and unexpected response[J].Circulation,1991,84(3):1157-1164.
[33]Dan D,Hoag JB,Ellenbogen KA,et al.Cerebral blood flow velocity declines before arterial pressure in patients with orthostatic vasovagal presyncope[J].J Am Coll Cardiol,2002,39(6):1039-1045.
[34]Zhang R,Zuckerman JH,Levine BD.Deterioration of cerebral autoregulation during orthostatic stress:insights from the frequency domain[J].J Appl Physiol,1998,85(3):1113-1122.
[35]Arce M,Femenia F,Palazzolo J,et al.Is the head-up tilt-test necessary in patients whit clinical diagnosis of vasovagal syncope[J].Archivos de cardiologia de Mexico,2011,81(4):287-291.
[36]Skerk V,Pintaric H,Delic-Brkljacic D,et al.Orthostatic intolerance:postural orthostatic tachycardia syndrome with overlapping vasovagal syncope[J].Acta Clin Croat,2012,51(1):93-95.
[37]Zaidi A,Crampton S,Clough P,et al.Head-up tilting is a useful provocative test for psychogenic non-epileptic seizures[J].Seizure-Eur J Epilep,1999,8(6):353-355.
1003-2754(2013)03-0273-04
R445.1
2013-01-10;
2013-02-19
(吉林大学白求恩第一医院神经内科,吉林长春130021)
邢英琦,E-mail:xingyq@sina.com

