不同浓度伊班膦酸钠对体外培养破骨细胞活性和骨吸收作用的影响
李鹏飞,贾楠,沈亚欣,杨建博,靳宪辉,丁文元,张为
(1.哈励逊国际和平医院骨病科,河北 衡水 053000;2.河北医科大学外科学教研室;3.河北医科大学第三医院脊柱外科,河北 石家庄)
不同浓度伊班膦酸钠对体外培养破骨细胞活性和骨吸收作用的影响
李鹏飞,贾楠,沈亚欣,杨建博,靳宪辉,丁文元,张为
(1.哈励逊国际和平医院骨病科,河北 衡水 053000;2.河北医科大学外科学教研室;3.河北医科大学第三医院脊柱外科,河北 石家庄)
目的 研究不同浓度伊班膦酸钠在体外对破骨细胞的抑制特点。方法 破骨细胞由小鼠的骨髓单核细胞诱导制备,小鼠的骨髓单核细胞经收集、计数、种植后,向培养液中加入各种必需的诱导细胞因子,实验组加入不同浓度的伊班膦酸钠,对照组加入同等量的膦酸盐缓冲液;在无菌条件下培育5天,通过比较各组不同浓度伊班膦酸钠对破骨细胞(细胞核>3个)形成的抑制浓度,观察此浓度下的伊班膦酸钠对破骨细胞的粘附、迁移和骨吸收能力的影响。结果 伊班膦酸钠可以抑制体外破骨细胞的形成,其最低有效抑制浓度为1×10-5mol/L。1×10-4mol/L浓度下其作用更为显著,但高浓度对破骨细胞的粘附能力没有明显影响。结论 体外培养中高浓度的伊班膦酸钠有显著的抗破骨细胞作用,对临床骨巨细胞瘤的治疗有重要指导意义,提示局部应用高浓度药物会有更明显的疗效。
破骨细胞;骨巨细胞瘤;伊班膦酸钠;双膦酸盐
双膦酸盐是一种焦磷酸盐类似物,无毒性[1],伊班膦酸钠为第三代氨基-双膦酸盐,其抗骨质破坏作用使其已广泛应用于对骨巨细胞瘤、骨转移瘤的辅助治疗中[2-5]。文献应用大量病例研究对伊班膦酸钠辅助治疗骨巨细胞瘤、骨转移瘤的报道,并取得了满意的临床疗效[6]。本研究通过体外细胞培养试验来观察不同浓度伊班膦酸钠对鼠类破骨细胞的影响,逐步解释我们的临床发现,并进一步指导临床治疗工作。
1 材料与方法
1.1 实验材料
C57小鼠来自河北医科大学动物实验室,伊班膦酸钠来自河北医科大学生物工程中心。通过磷酸盐缓冲液制备所需浓度的伊班膦酸钠溶液,调整PH值为7.4,并经滤过灭菌。
1.2 分离与培养
动物试验通过河北医科大学动物实验中心批准,动物处置方法符合动物伦理学要求。C57小鼠的破骨细胞通过体外培养其骨髓单核细胞而产生[7]。骨髓单核细胞取自8周龄小鼠的股骨和胫骨,收集计数后种植于12孔板内,并在含有10%FBPS、30 μg/l鼠类重组巨噬细胞集落刺激因子(M-CSF,Peprotech,Rocky Hills,NC) 及 20 μg/l鼠类重组 NF-κB受体活化因子RANKL的α-MEM培养基中培养3天。第4天,将细胞培养基转换为含有10%纤维蛋白降解产物、40 μg/l鼠类重组巨噬细胞集落刺激因子及60 μg/l鼠类重组NF-KB配体激活因子的α-MEM培养基中,并继续培养5天。
1.3 抗酒石酸酸性磷酸酶染色分析
在破骨细胞培养的第4天,将浓度分别为1×10-4mol/l,1×10-5mol/l,1×10-6mol/l,1×10-7mol/l的伊班膦酸钠溶液加入不同的分组中,同时对照组加入同等量的磷酸盐缓冲溶液。培养5天后,附壁细胞通过含10%甲醛的磷酸盐溶液固定在PBPS中,经过乙醇-丙酮液(1:1)处理后抗酒石酸酸性磷酸酶染色,然后进行显微镜(Nikon TE2000-S)下观察及记录,大于3核的复核抗酒石酸酸性磷酸酶染色阳性细胞被记录为成熟的破骨细胞。通过图像处理软件(Imaging-Pro)来计算复核的破骨细胞所占面积的百分率。
1.4 破骨细胞黏附性
将破骨细胞前体单细胞悬浊液分别置入96孔板中,5×104单细胞/培养孔,实验组含有浓度分别为1×10-4mol/l,1×10-5mol/l,1×10-6mol/l,1×10-7mol/l伊班膦酸钠溶液,对照组为磷酸盐缓冲液。培养40 min后,应用磷酸盐缓冲液将没有附壁的细胞小心洗掉,并对附壁细胞进行染色并计数。
1.5 活动性分析
应用 8 μm 孔径滤网(Costar,Boston,MA)处理后,加入30 μg/l巨噬细胞集落刺激因子(M-CSF),实验组分别含伊班膦酸钠 1×10-4mol/l,1×10-5mol/l,1×10-6mol/l,1×10-7mol/l,对照组为含有 30 μg/l MCSF的磷酸盐缓冲液。应用等量的的破骨细胞加于滤网上,测量分析通过滤网的破骨细胞数量。
1.6 骨吸收性分析
小心分离破骨细胞后,将提取的破骨细胞单细胞悬浊液植入96孔板,5×104单细胞/培养孔,加入40 μg/l M-CSF 和 60 μg/l RANKL,将骨板培养基(ALPCO Diagnostic,Windham,NH)置于 96孔板内。实验组伊班膦酸钠浓度分别为1×10-4mol/l,1×10-5mol/l,1×10-6mol/l,1×10-7mol/l;对照组为磷酸盐缓冲液。于37℃,5%CO2的条件下培养5天,冲洗骨板培养基上的破骨细胞,应用0.5%四硼酸钠、1%甲苯胺蓝的磷酸盐缓冲溶液染色,应用显微镜(Nikon TE2000-S)观察每个骨板培养基中溶骨孔的数量,并通过图像处理软件(Imaging-Pro)来计算溶骨孔所占面积的百分率。
1.7 统计学方法
统计结果应用SPSS 17.0软件统计学处理进行分析,采用Kruskal-Wallis H检验对结果进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 抑制破骨细胞的生成
在观察伊班膦酸钠剂量浓度对破骨细胞相关性的抑制作用时,采用Student-Newman-Keuls(SNK)多重比较检验结果显示:1×10-5mol/l浓度下,其抑制作用明显增强;1×10-4mol/l浓度下,破骨细胞生成被显著抑制,P<0.05(见图 1)。
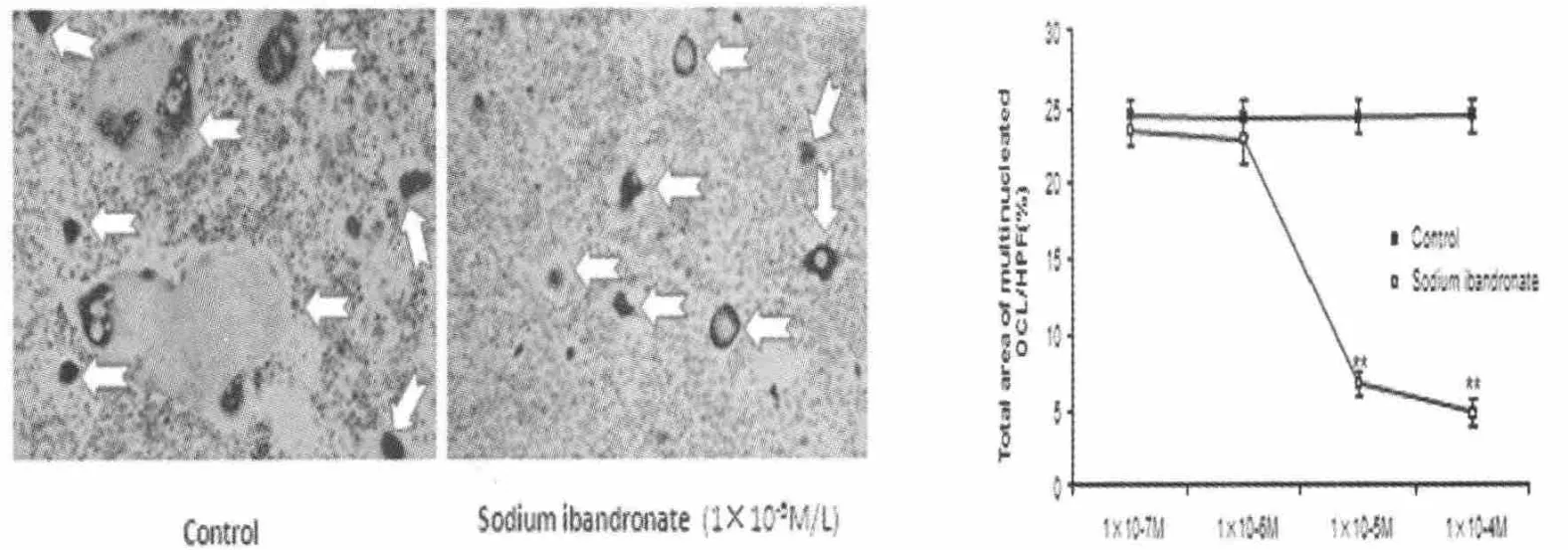
图1 1×10-5mol/L浓度下,伊班膦酸钠对破骨细胞形成抑制作用明显增强
2.2 没有明显抑制破骨细胞的黏附性
伊班膦酸钠在1×10-4mol/l浓度下明显抑制破骨细胞生成,同时观察此浓度下其对破骨细胞黏附性的影响。采用Kruskal-Wallis H检验,结果显示高浓度1×10-4mol/l伊班膦酸钠没有明显抑制破骨细胞的黏附性,P>0.05(见图 2)。

图2 1×10-5mol/L浓度下,伊班膦酸钠对破骨细胞黏附性的抑制作用不明显。
2.3 抑制破骨细胞的活动性
鉴于破骨细胞的活动性在骨吸收过程中的作用,我们观察伊班膦酸钠对破骨细胞活动性的影响。采用(Student-Newman-Keuls,SNK)多重检验进行组内比较结果显示:浓度为1×10-5mol/l明显抑制破骨细胞生成,而高浓度1×10-4mol/l的伊班膦酸钠显著较少了活动性细胞的数量,P<0.05(见图3)。

图3 1×10-5mol/L浓度下,伊班膦酸钠对破骨细胞移动性的抑制作用明显。
2.4 抑制破骨细胞的骨吸收作用
骨吸收是破骨细胞的主要功能,骨吸收的过程可通过计算溶骨孔的数量表现出来。采用(Student-Newman-Keuls,SNK) 多重检验,结果显示:1×10-5mol/l的伊班膦酸钠对M-CSF和 RANKL介导的骨吸收作用有明显抑制作用。而高浓度1×10-4mol/l的伊班膦酸钠作用更显著,P<0.05(见图4)。
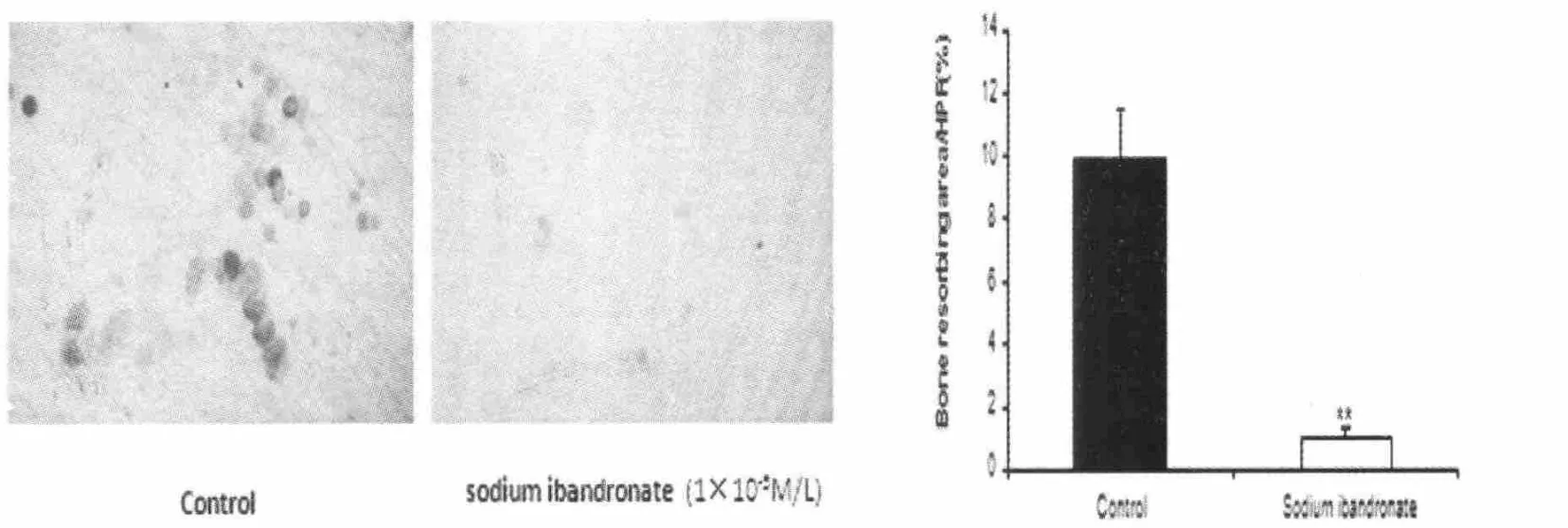
图4 1×10-5mol/L浓度下,伊班膦酸钠对鼠类重组巨噬细胞集落刺激因子及鼠类重组NF-κB受体活化因子介导的骨吸收作用明显抑制
3 讨论
文献报道双膦酸盐的抗破骨细胞作用机制可能在体内,双膦酸盐与骨表面的羟(基)磷灰石紧密结合,之后被转运至骨吸收增加部位,抑制破骨细胞黏附,促进钙质沉积[9,10]。双膦酸盐经过甲羟戊酸途径直接作用于骨巨细胞瘤间质细胞,阻止蛋白质异戊二烯化,抑制前体细胞转化为破骨细胞样巨细胞,同时诱导成熟的破骨细胞凋亡[11-13]。
骨巨细胞瘤属于具有局部侵蚀破坏性的良性肿瘤,好发于长骨干骺端[14]。其骨组织破坏的病理机制可能是肿瘤间质细胞介导的造血前体细胞融合形成破骨细胞,最终导致骨质吸收和破坏[15]。从病理学角度看,骨巨细胞瘤主要由3种细胞构成:(1)大量的破骨细胞样巨细胞参与骨吸收和破坏;(2)梭形及成纤维细胞样的肿瘤间质细胞;(3)圆形单核细胞[16]。双膦酸盐类药物治疗的目标是抑制骨破坏、降低破骨细胞的复发率,从而避免手术治疗[17]。更重要的是,骨巨细胞瘤的不同细胞成分之间存在相互作用,并具有自分泌破骨细胞形成因子的功能[18]。作用于任何一种成分,都可以影响其自分泌作用,从而阻止病情恶化[19]。
伊班膦酸钠为第三代氨基-双膦酸盐,药效作用强大[20]。双膦酸盐家族因结构不同而效果略有差异,在抗骨吸收方面发挥着巨大的作用[21-23]。本研究体外细胞培养实验已经证明伊班膦酸钠对破骨细胞在黏附性、活动性、骨吸收等方面的作用。与其他双膦酸盐试剂一样,随着伊班膦酸钠的浓度增加其抑制破骨细胞活性的作用增强,值得注意的是其浓度在1×10-5mol/L时对破骨细胞骨吸收和活动性抑制明显增强。本实验中,伊班膦酸钠在1×10-4mol/L的高浓度下作用最强,此浓度对破骨细胞骨吸收和活动性抑制最强,并且1×10-5mol/L浓度已经远高于其药理学浓度。双膦酸盐类似的特点也在动物实验中得到验证:大剂量的双膦酸盐可抑制钛颗粒诱发骨溶解,而药理学浓度的作用较小[24-26]。在治疗骨质疏松方面,伊班膦酸钠的效果亦取决于剂量相关,在某个特定剂量下患者年骨密度增加最显著,此剂量为最显著剂量[27]。最近的研究表明,伊班膦酸钠可以有效抑制破骨细胞的黏附性[28-30]。这与我们预期的抑制破骨细胞与骨的结合是双膦酸盐抗骨质吸收的机制相悖[31-33]。我们认为这与培养基底部没有钙质面有关,但仍需要进一步的试验研究证实。
在体外培养实验中,高浓度的伊班膦酸钠可以直接作用于破骨细胞的表面受体。将体外培养实验与临床所见结合起来看,我们认为局部组织的双膦酸盐浓度在治疗骨巨细胞瘤及骨转移瘤中起重要作用。鉴于双膦酸盐的促骨质沉积和修复作用,已经在动物模型中应用安全剂量进行局部注射。其在发挥促成骨细胞和修复骨组织作用的同时,没有出现不良反应的报道。双膦酸盐局部注射对肿瘤表面的残余骨起到抗吸收的作用,体外细胞培养及动物实验已证明局部应用的可行性,但仍需要进一步的临床试验研究来证实其安全及有效性。
[1] Campanacci M,Baldini N,Boriani S,et al.Giant-cell tumor of bone[J].J Bone Joint Surg(Am) 1987,69(1):106-114.
[2] Zheng MH,Robbins P,Xu J,et al.The histogenesis of giant cell tumour of bone:a model of interaction between neoplastic cells and osteoclasts[J].Histol Histopathol,2001,16(4):297-307.
[3] Robinson D,Einhorn TA.Giant cell tumor of bone:a unique paradigm of stromal-hematopoietic cellular interactions[J].J Cell Biochem,1994,55(1):300-303.
[4] Arpornchayanon O,Leerapun T.Effectiveness of intravenous bisphosphonate in treatment of giant cell tumor:a case report and review of the literature[J].J Med Assoc Thai,2008,91(5):1609-1612.
[5] Tse LF,Wong KC,Kumta SM,et al.Bisphosphonates reduce local recurrence in extremity giant cell tumor of bone:a casecontrol study[J].Bone,2008,42(1):68-73.
[6] Shimada Y,Hongo M,Miyakoshi N,et al.Giant cell tumor of fifth lumbar vertebrae:two case reports and review of the literature[J].Spine J,2007,7(1):499-505.
[7] Yang FC,Chen S,Robling AG,et al.Hyperactivation of p21ras and PI3K cooperate to alter murine and human neurofibromatosis type 1-haploinsufficient osteoclast functions[J].J Clin Invest,2006,116(11):2880-2891.
[8] 李鹏飞,靳宪辉,李华,等.双膦酸盐类药物治疗脊柱骨巨细胞瘤二例报告[J]. 中华肿瘤防治杂志,2012,19(8):627-628.
[9] Cheng YY,Huang L,Lee KM,et al.Bisphosphonates induce apoptosis of stromal tumor cells in giant cell tumor of bone[J].Calcif Tissue Int,2004,75(2):71-77.
[10]董梅,陈学鹏,冯奉仪,等.双膦酸盐治疗恶性肿瘤骨转移的研究进展[J]. 中华肿瘤杂志,2007,29(11):801-803.
[11]Khan DC,Malhotra S,Stevens RE,et al.Radiotherapy for the treatment of giant cell tumor of the spine:a report of six cases and review of the literature[J].Cancer Invest,1999,17(5):110-113.
[12]Chen ZX,Gu DZ,Yu ZH,et al.Radiation therapy of giant cell tumor of bone:analysis of 35 patients[J].Int J Radiat Oncol Biol Phys,1986,12(1):329-334.
[13]Boonekamp PM,van der Wee-Pals LJ,van Wijk-van Lennep MM,et al.Two modes of action of bisphosphonates on osteoclastic resorption of mineralized matrix[J].Bone Miner,1986,1(12):27-39.
[14]Bidwell JK,Young JW,Khalluff E.Giant cell tumor of the spine:computed tomography appearance and review of the literature[J].J Comput Tomogr,1987,11(2):307-311.
[15]Murphey MD,Andrews CL,Flemming DJ,et al.From the archives of the AFIP.Primary tumors of the spine:radiologic pathologic correlation[J].Radiographics,1996,16(3):1131-1158.
[16]Kwon JW,Chung HW,Cho EY,et al.MRI findings of giant cell tumors of the spine[J].AJR J Roentgenol(Am),2007,189(5):246-250.
[17]Shaw NJ,Bishop NJ.Bisphosphonate treatment of bone disease[J].Arch Dis Child,2005,90(6):494-499.
[18]Morris CD,Einhorn TA.Bisphosphonates in orthopaedic surgery[J].J Bone Joint Surg(Am),2005,87(11):1609-1618.
[19]Hart RA,Boriani S,Biagini R,et al.A system for surgical staging and management of spine tumors.A clinical outcome study of giant cell tumors of the spine[J].Spine,1997,22(7):1773-1782.
[20]Chow LT,Kumta SM.Massive intestinal hemorrhage resulting from a polypoid tumor in the sigmoid colon:an unusual complication of a giant cell tumor of the fifth lumbar vertebra[J].Spine,2003,28(6):121-124.
[21]Shimizu K,IdoK,FujioK.Totalspondylectomyand spinal shortening for giant-cell tumour of spine[J].Lancet,1996,348(1):342.
[22]Weinstein JN,McLain RF.Primary tumors of the spine[J].Spine,1987,12(1):843-851.
[23]Luckman SP,Hughes DE,Coxon FP,et al.Nitrogen-containing bisphosphonatesinhibitthe mevalonatepathwayand prevent post-translational prenylation of GTP-binding proteins,including Ras[J].J Bone Miner Res,1998,13(6):581-589.
[24]Green JR.Antitumor effects of bisphosphonates[J].Cancer,2003,97(4):840-847.
[25]Rogers MJ,Gordon S,Benford HL,et al.Cellular and molecular mechanisms of action of Bisphosphonates[J].Cancer,2000,88(2):2961-2678.
[26]Chang SS,Suratwala SJ,Jung KM,et al.Bisphosphonates may reduce recurrence in giant cell tumor by inducing apoptosis[J].Clin Orthop Relat Res,2004,426(1):103-109.
[27]Wermelin K,Suska F,Tengvall P,et al.Stainless steel screws coated with bisphosphonates gave stronger fixation and more surrounding bone.Histomorphometry in rats[J].Bone,2008,42(12):365-371.
[28]Yang SC,Chen LH,Fu TS,et al.Surgical treatment for giant cell tumor of the thoracolumbar spine[J].Chang Gung Med J,2006,29(8):71-78
[29]Wermelin K,Tengvall P,Aspenberg P.Surface-bound bisphosphonates enhance screw fixation in rats-increasing effect up to 8 weeks after insertion[J].Acta Orthop,2007,78(9):385-392.
[30]Stadelmann VA,Gauthier O,Terrier A,et al.Implants delivering bisphosphonate locally increase periprosthetic bone density in an osteoporotic sheep model[J].A pilot study.Eur Cell Mater,2008,16(15):10-16.
[31]Pautke C,Kreutzer K,Weitz J,et al.Bisphosphonate related osteonecrosis of the jaw:A minipig large animal model[J].Bone,2012,51(3):592-599.
[32]Schubert M,Klatte I,Linek W,et al.The Saxon Bisphosphonate Register-Therapy and prevention of bisphosphonate-related osteonecrosis of the jaws[J].Oral oncology,2012,48(4):349-354.
[33]Ferlito S,Puzzo S,Palermo F,et al.Treatment of bisphosphonaterelated osteonecrosis of the jaws:Presentation of a protocol and an observational longitudinal study of an Italian series of cases[J].British journal of oral and maxillofacial surgery,2012,50(5):425-429.
Effects of different concentrations of sodium ibandronate on the activity and resorption of osteoclast in vitro
LI Peng-fei,JIA Nan,SHEN Ya-xin,et al.
(1.Department of Orthopedics,Harrison International Peace Hospital,Hengshui,Hebei 053000;2.Department of Surgery Feaching and Research Seation of Hebei Medical Univercity;3.Department of Spinal Surgery,The Thrid Hospital Affiliated to Hebei;Medical University.)
ObjectiveTo evaluate the inhibitory effect of sodium ibondronate on osteoclasts in vitro.MethodsMouse osteoclasts were generated in vitro by using mouse bone marrow mononuclear cells(BMMNCs).Firstly,various concentrations of sodium ibandronate and coequal amount of phosphate-buffered saline were added to cell culture medium,multinucleated cells(>3 nuclei) were scored in each group and comparisons on formation of osteoclasts were performed.Then,high concentrations of sodium ibandronate were added to experimental/investigational cell culture medium and no ibandronate in control group.Comparisons between the two groups on osteoclasts in terms of adhesion,migration,bone resorption were performed.ResultsOsteoclasts formation was suppressed by sodium ibandronate in vitro,and most pronounced effect was found at 1×10-5mol/L.The migration and bone resorption of osteoclasts were significantly suppressed at this concentration.The effect was more obvious at 1×10-4mol/L.However,no effect was found on adhesion of osteoclasts.ConclusionSodium ibandronate was effective in suppressing osteoclast and decreasing resorption of giant cell tumor.A strong anti-osteoclast function at a high concentration in vitro suggested a topical way of application.
osteoclast;giant cell tumor;ibandronate;bisphosphonate.
电子邮箱:pengflyl@yahoo.com.cn
R783.1
A
1005-7234(2013)05-0372-05
10.3969/j.issn.1005-7234.2013.05.005
2013-02-02;
2013-08-05
李鹏飞(1985-),男,河北籍,主治医师,硕士
研究方向:脊柱外科
靳宪辉
电 话:18832816153
·临床研究·

