伤寒沙门菌质粒对巨噬细胞自噬过程的影响
王贝贝,阙凤霞,李嫄渊,吴淑燕,黄瑞
苏州大学基础医学与生物科学学院病原生物学系,苏州 215123
20世纪80年代中后期,我国暴发了多重耐药伤寒的严重流行,波及贵州、江苏、浙江等13个省市。针对此次伤寒流行来势凶猛,患者病情重、病死率高的特点,本实验室对苏州地区临床分离的591株伤寒沙门菌进行研究,发现所有多重耐药菌均携带一个98 600 000(约150 kb)的可接合传递大质粒,编码对10余种药物的抗性,属不相容性C群(IncC),称为pRST98[1]。本实验室前期研究证实,伤寒沙门菌质粒pRST98上存在与细菌血清抗性、黏附和定植有关的高度保守序列——沙门菌质粒毒力基因(Salmonellaplasmid virulence gene,spv)同源性高达99.6%的毒力基因。pRST98是既能介导细菌耐药性又能增强细菌毒力的具双重功能的嵌合型质粒[2]。
凋亡(apoptosis)和自噬(autophagy)是程序性细胞死亡(programmed cell death,PCD)的不同类型,两者在细胞的生存、发育和分化中都起重要作用。凋亡作为PCDⅠ型已被广泛认知。研究发现,沙门菌不仅可通过诱导巨噬细胞凋亡而逃避机体免疫系统的识别,还可将凋亡的巨噬细胞作为贮存库帮助其播散至全身[3,4]。近年来,一种异于凋亡的细胞死亡方式——自噬,受到广泛关注并逐步成为当前生物科学领域的研究热点。既往研究发现,自噬在机体抑制沙门菌存活或增殖、减轻机体损伤等方面具有重要作用,而携带伤寒沙门菌质粒pRST98的菌株可通过抑制细胞的自噬功能,实现其在机体内的存活[5]。但对有关伤寒沙门菌质粒pRST98抑制细胞自噬过程的时相未进一步研究。本研究应用自噬阻断剂氯喹(chloroquine,CQ)改变溶酶体中的pH值,阻断自噬后期的降解途径,探讨伤寒沙门菌质粒pRST98对细胞自噬作用的时相,为其致病机制的研究提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1菌株及细胞株携带pRST98的伤寒沙门菌野生株ST6系本室保存的临床分离菌株,pRST98消除株ST6-ΔpRST98和pRST98回补株ST6-c-pRST98由本实验室通过质粒消除和接合转移等方法构建。人单核-巨噬细胞系THP-1由苏州大学医学部张学光教授惠赠。
1.1.2试剂及仪器主要试剂及仪器包括RPMI 1640干粉(Gibco公司),胎牛血清(Hyclone公司),CQ、阿米卡星(amikacin,AMK)、佛波酯(phorbol-12-myristate-13-acetate,PMA)(Sigma公司);鼠抗β-actin(联科生物技术有限公司),兔抗p62、兔抗LC3(Abcam公司),鼠二抗、兔二抗(Abgent公司);PowerPac Basic 电泳仪(Bio-Rad公司),酶标仪(Biotek公司),Allegra X-15R低温高速离心机(Beckman-Coulter公司),Heraeus BB16UV型CO2培养箱(Heraeus公司)。
1.2 方法
1.2.1细胞和细菌培养人单核-巨噬细胞THP-1用含10% 胎牛血清的RPMI 1640常规培养。THP-1为单核细胞,在建立细胞感染模型前用50 ng/ml PMA诱导72 h,由悬浮细胞向贴壁细胞转化,呈阿米巴原虫样贴壁,细胞伸出伪足,富含颗粒,具有巨噬细胞的特点,转化率达90%,可用于实验。受试菌株ST6、ST6-ΔpRST98和ST6-c-pRST98接种于LB固体培养基,37 ℃培养过夜,挑单个菌落至3 ml LB液体培养基,培养14~16 h至对数生长期,600 nm处测定光密度(optical density,OD),求菌液浓度,同时计数平板菌落。
1.2.2噻唑蓝还原法测定CQ浓度对细胞存活率的影响参照文献[6,7],取对数生长期的THP-1细胞,接种于96孔板内,104个/孔,PMA诱导分化成熟。实验设调零组和实验组。实验组加入0、10、20、30、40、50、60、70和80 μmol/L的CQ,每组设5个复孔。培养24 h后,加入20 μl 噻唑蓝(methyl thiazolyl tetrazolium,MTT)还原溶液(5 mg/ml),继续培养4 h。弃去上清液,每孔加入150 μl二甲亚砜(dimethyl sulfoxide,DMSO),置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的OD值,计算细胞生长抑制率。细胞存活率(%)=实验组平均OD值/对照组平均OD值×100%。
以上述实验测定的CQ适宜浓度,将受试菌分别用含30 μmol/L CQ和不含CQ的LB液体培养基培养16 h至对数生长期,600 nm处测OD值,求菌液浓度,比较CQ对菌量的影响。以上每组均设3个复孔。
1.2.3细胞分组和培养将THP-1细胞分为CQ干预组及不加CQ对照组。每组再分4组,即ST6感染组、ST6-ΔpRST98感染组、ST6-c-pRST98感染组和空白对照组。将细胞浓度调整至2×105个/ml,按1 ml/孔加入24孔板,或将细胞浓度调整至3×106个/ml加入细胞培养瓶进行培养,后者用于蛋白免疫印迹法(Western blotting,WB)检测。参照预实验结果,用30 μmol/L CQ预处理PMA诱导分化的THP-1细胞6 h后,加入细菌。
1.2.4细胞感染模型制作参照预实验结果,按感染复数(multiplicity of infection,MOI)为50∶1(细菌∶细胞)将培养至对数生长期的ST6、ST6-ΔpRST98、ST6-c-pRST98加入细胞,100g离心10 min,继续在5% CO2、37 ℃条件下共培养1 h。弃上清液(此时定为0点),加入含100 mg/L的AMK培养液作用2 h,以杀死胞外菌,在0 h和2 h收集细胞进行检测。
1.2.5自噬蛋白LC3和p62的检测分别在0 h和2 h收集细胞,用于检测自噬相关蛋白LC3和p62。用预冷的磷酸缓冲液(phosphate buffered saline,PBS)洗1次,100g离心5 min,小心吸除上清液。在细胞中加入裂解液,超声裂解细胞,4 ℃ 13 200g离心20 min,吸取上清液后用二羧基二喹啉酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒测蛋白浓度。取60 μg样品上样,进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)(浓缩胶70 V,30 min;分离胶90 V,70 min),将蛋白转移至硝酸纤维素膜(300 mA,70 min),5%脱脂奶粉室温封闭1 h;加入鼠抗β-actin(1∶3 000稀释)、兔抗LC3(1∶1 000稀释)和兔抗p62(1∶1 000稀释),4 ℃孵育过夜。次日室温孵育1 h,用含Tween 20的Tris缓冲液(Tris buffered saline and Tween 20,TBST)洗3次,每次5 min;加入鼠二抗(1∶3 000稀释)、兔二抗(1∶3 000稀释),室温孵育90 min,TBST 洗3次,每次5 min;化学发光法显影,检测LC3和p62蛋白的表达。
1.2.6mRFP-GFP-LC3质粒转染后荧光显微镜观察自噬体和自噬溶酶体变化应用脂质体转染法将与单体红色/绿色荧光蛋白(monomeric red fluorescent protein-green fluorescent protein,mRFP-GFP)偶联的自噬蛋白LC3真核细胞表达载体mRFP-GFP-LC3 质粒导入巨噬细胞。取对数生长期的THP-1细胞,接种于铺有小圆玻片的24孔板,2×105个/孔,PMA诱导分化成熟。转染时,细胞融合度为80%~90%。弃去孔内含10%胎牛血清的RPMI 1640,用无血清RPMI 1640洗2次,每孔加500 μl无血清RPMI 1640,37 ℃、5% CO2培养1 h。用50 μl无血清RPMI 1640稀释0.8 μg质粒DNA,轻轻吹吸3~5次混匀。用50 μl无血清RPMI 1640稀释2 μl LipofectamineTM2000,轻轻吹吸3~5次混匀,室温静置5 min。混合转染试剂和质粒DNA稀释液,轻轻吹吸3~5次混匀,室温静置30 min。将转染复合物缓慢滴加至24孔板中,100 μl/孔,前后轻摇细胞板混匀。
1.3 统计学处理
用SPSS 17.0进行统计学数据处理,多个实验组均数间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 CQ阻断THP-1细胞自噬的浓度确定
用WB和MTT法确定CQ工作浓度。p62作为自噬的底物蛋白,主要在自噬溶酶体中降解。 CQ可通过破坏溶酶体中酸性水解酶的活性,使p62无法正常降解而累积。WB结果显示,30 μmol/L CQ作用细胞6 h后,p62已明显累积;40 μmol/L CQ作用细胞6 h后,累积程度达饱和(图1A、1B)。结合MTT法检测CQ对细胞活性的影响,30 μmol/L CQ作用24 h后,细胞存活率为58.58%;而40 μmol/L CQ作用24 h后,细胞存活率仅为46.03%(图1C)。细菌OD值测定结果表明,30 μmol/L CQ对ST6、ST6-ΔpRST98和ST6-c-pRST98菌量无明显影响,因此将30 μmol/L作为 CQ的工作浓度。
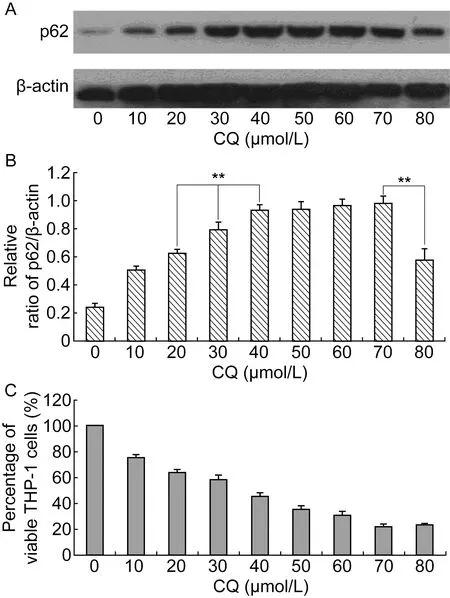
A: THP-1 cells were treated with various concentrations of CQ for 6 h. Total lysates were prepared and subjected to immunoblot analysis. B: Relative ratio of p62/β-actin was quantified (**P<0.01). C: THP-1 cells were treated with various concentrations of CQ for 24 h, and the influence of CQ on cell activity was detected by MTT.
图1CQ阻断THP-1细胞自噬的浓度确定
Fig.1DeterminationoftheconcentrationofCQinblockingofTHP-1autophagy
2.2 伤寒沙门菌质粒对THP-1自噬蛋白LC3Ⅱ与p62表达的影响
WB结果显示,细菌与THP-1作用0 h,CQ处理组LC3Ⅱ/β-actin值及p62/β-actin值明显高于对照组,其中突变株ST6-ΔpRST98LC3Ⅱ/β-actin值及p62/β-actin值的增加量均高于野生株ST6(图2A、2B、2D)。细菌与THP-1作用2 h,CQ处理组LC3Ⅱ/β-actin值及p62/β-actin值较对照组明显上升,但突变株ST6-ΔpRST98的上升量仍显著高于野生株ST6(图2A、2C、2E)。
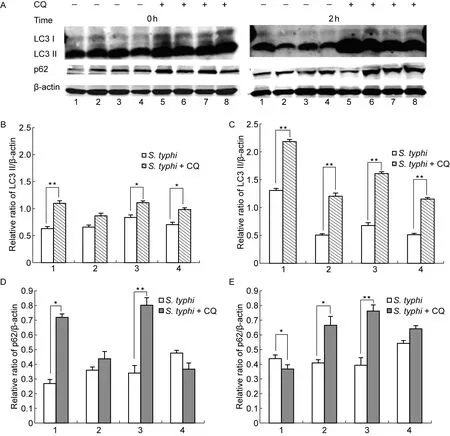
THP-1 cells were treated with 30 μmol/L CQ for 6 h or not. A: Total lysates were prepared and subjected to immunoblot analysis. 1, control; 2, ST6; 3, ST6-ΔpRST98; 4, ST6-c-pRST98; 5, control+CQ; 6, ST6+CQ; 7, ST6-ΔpRST98+CQ; 8, ST6-c-pRST98+CQ. B: Relative ratio of LC3Ⅱ/β-actin was quantified at 0 h. C: Relative ratio of LC3Ⅱ/β-actin was quantified at 2 h. D: Relative ratio of p62/β-actin was quantified at 0 h. E: Relative ratio of p62/β-actin was quantified at 2 h. 1, control; 2, ST6; 3, ST6-ΔpRST98; 4, ST6-c-pRST98.*P<0.05,**P<0.01.
图2伤寒沙门菌质粒对THP-1自噬蛋白LC3Ⅱ与p62表达的影响
Fig.2TheinfluenceofS.typhiplasmidontheexpressionsofautophagyproteinsLC3Ⅱandp62
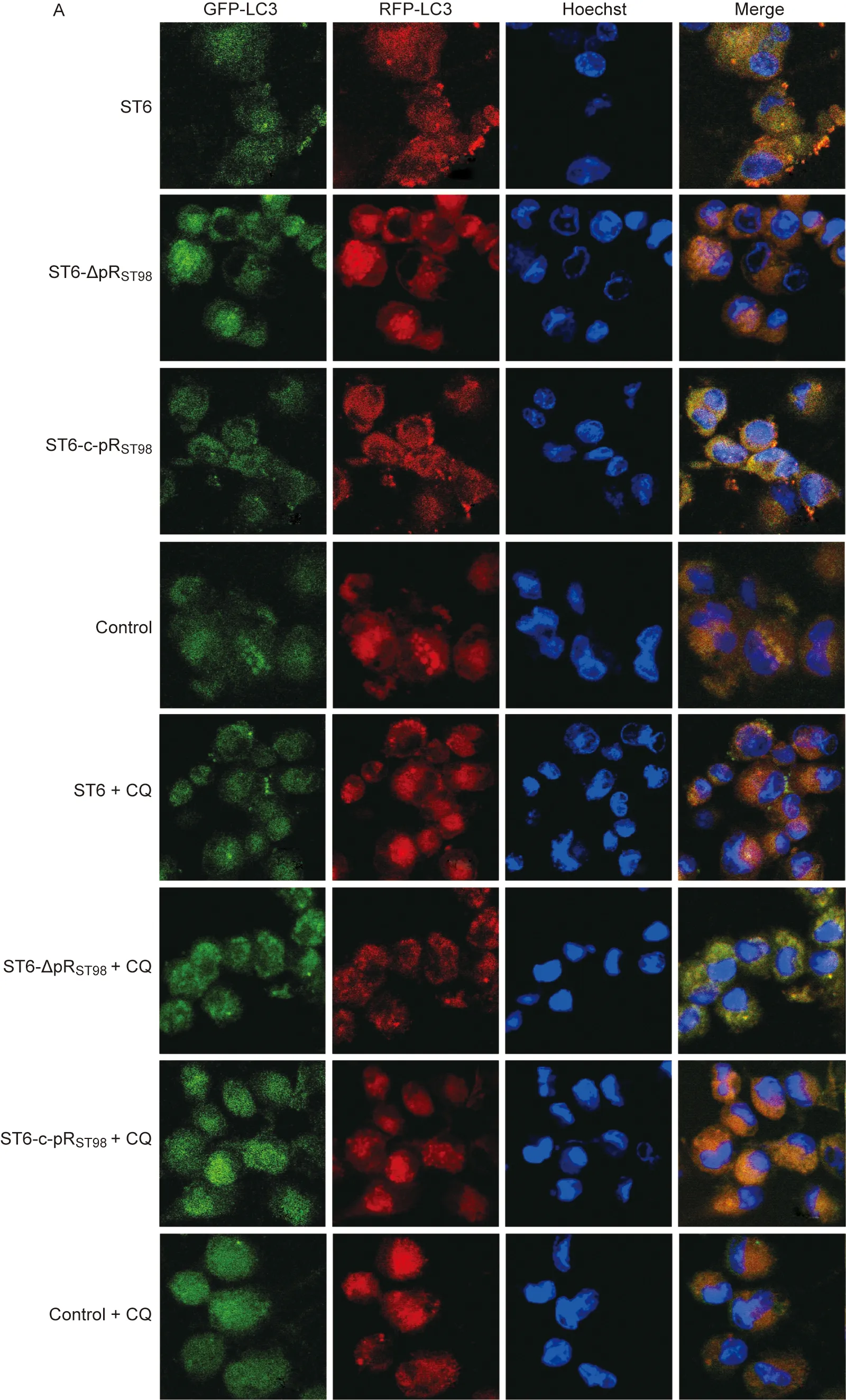
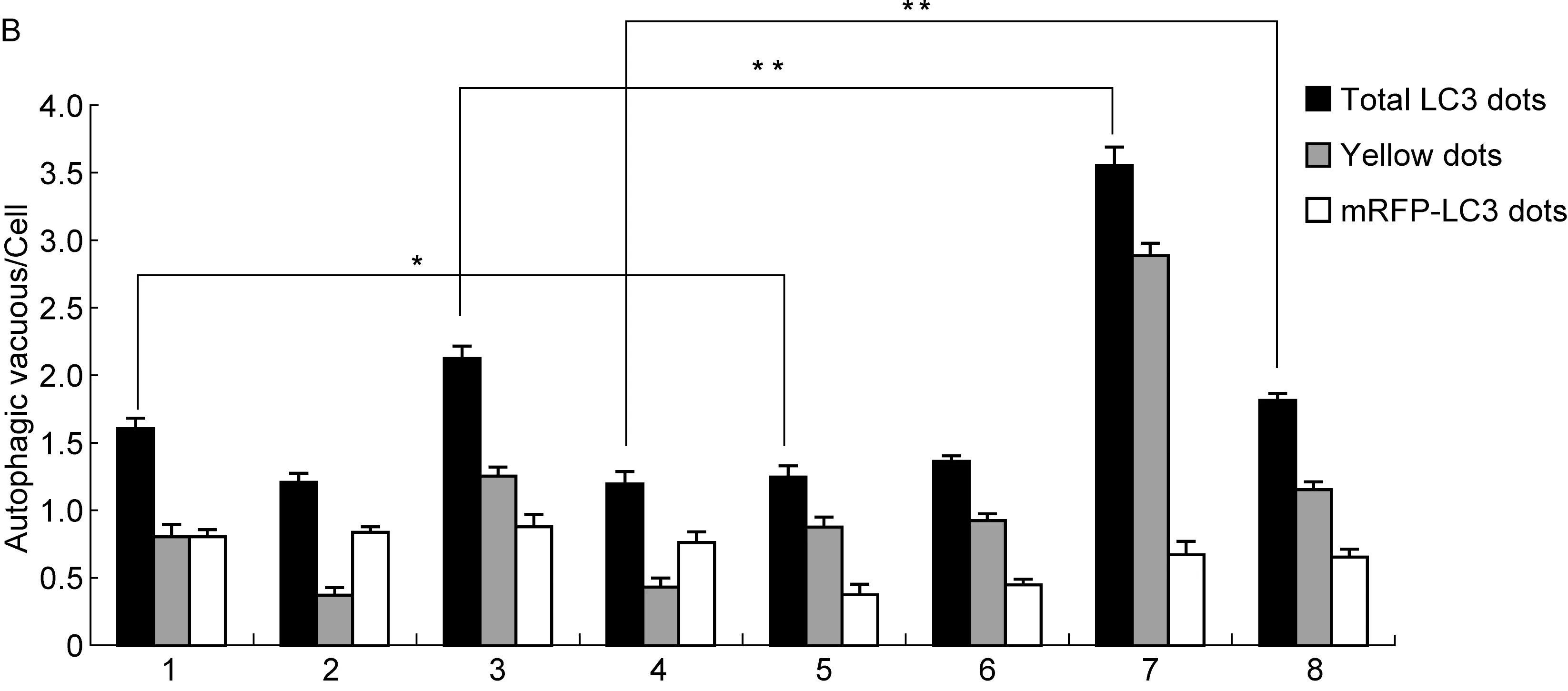
THP-1 cells were treated with 30 μmol/L CQ for 6 h or not. A: Endogenous LC3 Ⅱ was visualized by fluorescence microscopy as punctate structures. B: The number of LC3 dots per cell was quantified. 1, control; 2, ST6; 3, ST6-ΔpRST98; 4, ST6-c-pRST98; 5, control+CQ; 6, ST6+CQ; 7, ST6-ΔpRST98+CQ; 8, ST6-c-pRST98+CQ.*P<0.05,**P<0.01.
图3伤寒沙门菌质粒对LC3标记的自噬体及自噬溶酶体的影响
Fig.3TheinfluenceofS.typhiplasmidonLC3-labelingautophagosomesandautolysosomes
2.3 mRFP-GFP-LC3 质粒转染后荧光显微镜观察自噬体和自噬溶酶体的变化
转染mRFP-GFP-LC3质粒的细胞,自噬体为红绿叠加后形成的黄色点状聚集物,因溶酶体的酸性环境会淬灭绿色荧光而对红色荧光无影响,使自噬溶酶体表现为红色点状聚集物。若自噬活性上升,可观察到黄色自噬体和红色自噬溶酶体的点状聚集物均增多;若自噬体与溶酶体的融合被阻断、自噬溶酶体的生成减少,仅表现为黄色自噬体点状聚集物增多。结果显示,0 h CQ干预组突变株ST6-ΔpRST98感染细胞的点状聚集物数量高于对照组,而野生株ST6和回补株ST6-c-pRST98感染细胞的点状聚集物数量无差异。2 h CQ干预组3株菌感染细胞的点状聚集物数量均高于对照组,其中突变株ST6-ΔpRST98上升量显著高于野生株ST6及回补株ST6-c-pRST98(图3)。
3 讨论
自噬是不同于凋亡的一种细胞死亡方式,自1962年提出后已成为当前研究热点。自噬主要是通过细胞内的双层膜结构包裹需降解的细胞器、蛋白质或外来异物形成自噬体,然后与溶酶体融合形成自噬溶酶体,在自噬体内利用溶酶体水解酶降解其所包裹的内容物,以实现细胞内的稳态和细胞器的更新[8]。在细胞自噬与感染性疾病关系的研究中,自噬被视为机体对抗病原体入侵的一种方式,不仅可通过自噬溶酶体途径清除细菌发挥天然免疫应答效应,还参与病原菌的抗原呈递过程,对细胞的生存起至关重要的保护作用[9,10]。
目前,在酵母和其他真核生物中已发现许多自噬相关基因(autophagy-related gene,ATG),其中微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,MAP1-LC3)是酵母Atg8在哺乳动物细胞中的同源物。在自噬过程中,LC3 Ⅰ经类泛素化酶催化其C端并与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)偶联后转变为LC3 Ⅱ[8]。一旦自噬体与溶酶体融合,自噬体内的LC3 Ⅱ即被溶酶体中的水解酶降解。LC3 Ⅱ是目前发现的唯一定位于自噬体膜上的自噬相关蛋白,其含量多少与自噬泡数量成正比[11]。因此,WB检测细胞内LC3 Ⅱ含量变化或激光共聚焦法检测细胞质内LC3点状结构,即可实现对自噬体形成的检测[12]。p62能结合泛素化的蛋白与LC3偶联,参与自噬体形成[13]。自噬发生时,随着蛋白质不断降解,p62水平逐渐降低;而在自噬缺陷细胞中,可观察到p62累积[14,15]。因此,p62也被作为检测自噬活性的一个标记蛋白,其表达水平与自噬活性呈负相关。CQ作为一种自噬阻断剂,通过提高溶酶体中的pH值,使溶酶体中的酸性水解酶失活,导致自噬溶酶体无法分解底物[16],造成位于自噬体和自噬溶酶体膜上的LC3Ⅱ和p62不能及时降解,致使蛋白累积。
本实验室前期实验证明,伤寒沙门菌质粒pRST98可抑制细胞自噬,表现为自噬标记蛋白LC3Ⅱ、Beclin 1表达量降低,p62表达量上升[5]。而LC3Ⅱ表达量降低可能缘自下列情况:一是pRST98抑制自噬体形成,使LC3 Ⅱ表达量降低;二是pRST98促进自噬体与溶酶体融合,加速LC3 Ⅱ降解。本研究应用自噬阻断剂CQ阻断自噬体与溶酶体融合,切断LC3 Ⅱ及p62的降解途径。WB结果显示,野生株和突变株的LC3Ⅱ表达量较未加入CQ时均增加,但突变株的增加量显著高于野生株。与此同时,突变株感染组细胞p62表达明显累积,较野生株感染组差异更为显著。质粒转染结果与WB结果相符,2 h 时CQ干预组ST6-ΔpRST98点状聚集物上升量显著高于野生株ST6及回补株ST6-c-pRST98。综上所述,本研究初步断定伤寒沙门菌质粒pRST98作用于自噬过程前期,早于溶酶体降解的过程。
本研究确定了CQ对THP-1细胞自噬阻断的最适工作浓度,并结合WB和激光共聚焦法检测自噬水平的变化,初步判定伤寒沙门菌质粒pRST98作用的时相,为伤寒沙门菌质粒致病机制的研究提供了理论和实验依据。
[1] 黄瑞,穆荣普.伤寒沙门菌耐药性及其耐药质粒的监测[J].中华传染病杂志,1994,12(4):204-206.
[2] 黄瑞,吴淑燕,闻玉梅.伤寒杆菌耐药质粒pRST98介导细菌毒力的研究[J].中华微生物学与免疫学杂志,2001,21(3):302-305.
[3] Guiney DG, Fierer J. The role of the spv genes in salmonella pathogenesis [J]. Front Microbiol, 2011, 2: 129. doi: 10.3389/fmicb.2011.00129.
[4] Wu S, Li Y, Xu Y, Li Q, Chu Y, Huang R, Qin Z. A Salmonella enterica serovar Typhi plasmid induces rapid and massive apoptosis in infected macrophages [J]. Cell Mol Immunol, 2010, 7(4): 271-278.
[5] He P, Wu S, Chu Y, Yang Y, Li Y, Huang R. Salmonella enterica serovar Typhi plasmid pRST98enhances intracellular bacterial growth and S. typhi-induced macrophage cell death by suppressing autophagy [J]. Braz J Infect Dis, 2012, 16(3): 262-266.
[6] Ni HM, Bockus A, Wozniak AL, Jones K, Weinman S, Yin XM, Ding WX. Dissecting the dynamic turnover of GFP-LC3 in the autolysosome [J]. Autophagy, 2011, 7(2): 188-204.
[7] 蒋培都,赵瀛兰,杨胜勇,毛咏秋,郑于珠,李争光,魏于全.二磷酸氯喹对K562细胞增殖与凋亡的影响[J].中国实验血液学杂志,2008,16 (4):768-771.
[8] Mizushima N, Yoshimori T, Levine B. Methods in mammalian autophagy research [J]. Cell, 2010, 140(3): 313-326.
[9] 李琼,吴淑燕,黄瑞.自噬在细菌感染与免疫应答中的作用[J].微生物与感染,2009,4(2):108-111.
[10] Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation [J]. Nature, 2011, 469(7330): 323-335.
[11] Tanida I, Minematsu-Ikeguchi N, Ueno T, Kominami E. Lysosomal turnover, but not a cellular level, of endogenous LC3 is a marker for autophagy [J]. Autophagy, 2005, 1(2): 84-91.
[12] 王尧,李丹丹,朱孝峰,张晓实.氯喹联合拓扑替康对结肠癌细胞增殖的抑制作用[J].肿瘤,2010,30(7):555-560.
[13] Ichimura Y, Kominami E, Tanaka K, Komatsu M. Selective turnover of p62/A170/SQSTM1 by autophagy [J]. Autophagy, 2008, 4(8): 1063-1066.
[14] Mizushima N, Yoshimori T. How to interpret LC3 immunoblotting [J]. Autophagy, 2007, 3(6): 542-545.
[15] Klionsky DJ, Abdalla FC, Abeliovich H, Abraham RT, Acevedo-Arozena A, Adeli K, Agholme L, Agnello M, Agostinis P, Aguirre-Ghiso JA, Ahn HJ, Ait-Mohamed O, Ait-Si-Ali S, Akematsu T, Akira S, Al-Younes HM, Al-Zeer MA, Albert ML, Albin RL, Alegre-Abarrategui J, Aleo MF, Alirezaei M, Almasan A, Almonte-Becerril M, Amano A, Amaravadi R, Amarnath S, Amer AO, Andrieu-Abadie N, Anantharam V, Ann DK, Anoopkumar-Dukie S, Aoki H, Apostolova N, Arancia G, Aris JP, Asanuma K, Asare NY, Ashida H, Askanas V, Askew DS, Auberger P, Baba M, Backues SK, Baehrecke EH, Bahr BA, Bai XY, Bailly Y, Baiocchi R, Baldini G, Balduini W, Ballabio A, Bamber BA, Bampton ET, Bánhegyi G, Bartholomew CR, Bassham DC, Bast RC Jr, Batoko H, Bay BH, Beau I, Béchet DM, Begley TJ, Behl C, Behrends C, Bekri S, Bellaire B, Bendall LJ, Benetti L, Berliocchi L, Bernardi H, Bernassola F, Besteiro S, Bhatia-Kissova I, Bi X, Biard-Piechaczyk M, Blum JS, Boise LH, Bonaldo P, Boone DL, Bornhauser BC, Bortoluci KR, Bossis I, Bost F, Bourquin JP, Boya P, Boyer-Guittaut M, Bozhkov PV, Brady NR, Brancolini C, Brech A, Brenman JE, Brennand A, Bresnick EH, Brest P, Bridges D, Bristol ML, Brookes PS, Brown EJ, Brumell JH, Brunetti-Pierri N, Brunk UT, Bulman DE, Bultman SJ, Bultynck G, Burbulla LF, Bursch W, Butchar JP, Buzgariu W, Bydlowski SP, Cadwell K, Cahová M, Cai D, Cai J, Cai Q, Calabretta B, Calvo-Garrido J, Camougrand N, Campanella M, Campos-Salinas J, et al. Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes [J]. Autophagy, 2008, 4 (2): 151-175.
[16] Solomon VR, Lee H. Chloroquine and its analogs: a new promise of an old drug for effective and safe cancer therapies [J]. Eur J Pharmacol, 2009, 625(1-3): 220-233.

