人巨细胞病毒病毒体的组装研究新进展
毛有胜,贾淑芳,计晓,李增,王明丽
1. 安徽医科大学第一临床学院,合肥230032; 2. 安徽医科大学微生物学教研室,合肥230032
人巨细胞病毒(human cytomegalovirus,HCMV)是引起人类广泛感染的重要病原体,具有致死性,且可引起终身感染,包括在潜伏感染的细胞与终身持续间断性感染的细胞间转移的感染。HCMV可感染多种类型细胞,并于多种器官中检测到。其在人群中感染率较高,致病率较低,但对免疫力低下者、新生儿及老年人影响较大[1]。HCMV先天性感染会导致新生儿耳聋和神经系统功能障碍等,同时也是导致艾滋病患者视网膜炎和失明的重要原因。在器官移植患者和使用免疫抑制剂的癌症患者中,HCMV感染有较高的发病率。HCMV感染还导致某些炎性、增生性疾病,心血管疾病,以及特定癌症[2]。HCMV原发感染和再发感染都可引起HCMV病。但目前还没有针对其感染的有效疫苗,仅有的几种具有治疗性的药物有生物利用度低、毒性高及易形成耐药株等问题。因此,弄清HCMV的结构及其组装机制对相应疫苗及抗病毒药物的研制具有重要意义,可为HCMV相关疾病的有效预防和积极治疗带来新的思路。
HCMV为β疱疹病毒亚科成员之一,具有特征性的疱疹病毒结构和基因级联表达。病毒体(图1)由含有235 kb线状双链DNA(为疱疹病毒中最大的)的核衣壳及外层蛋白为主的被膜(tegument)和脂质为主的包膜(envelope)组成[3]。病毒体直径约230 nm,衣壳直径约110 nm,为二十面体立体对称型。病毒DNA含约250个开放读码框架(open reading fragment,ORF),编码大量蛋白质。衣壳包含4种必需蛋白成分:次要衣壳蛋白结合蛋白(minor capsid protein-binding protein, mCBP, pUL46)、装配蛋白前体(assembly protein precursor, pAP,pUL80.5)、次要衣壳蛋白(minor capsid protein, mCP, pUL85)、出口蛋白(portal protein,pUL104)。它们形成162个壳微粒和320个壳微粒间的异源三聚体,其中壳微粒包括150个六聚体和12个五聚体,而出口蛋白占据1个五聚体的位置,形成1个顶点[4]。被膜厚度约为50 nm,由众多被膜蛋白组成,如pp65(pUL83)、pp28(pUL99)、pp150(pUL32)、pp71、pUL47、pUL48和pUL97,大部分蛋白已被磷酸化。被膜蛋白分为2类,内侧被膜蛋白紧密结合在衣壳上,外侧被膜蛋白则相对疏松分布于衣壳与包膜之间。最外层富含脂质的包膜厚度约10 nm,其上嵌有包膜蛋白。病毒体中除自身编码的蛋白外,还含有部分宿主细胞的蛋白质,可检测到细胞RNA[5]。病毒按时间顺序可先后表达3类蛋白:即刻早期蛋白、早期蛋白和晚期蛋白。在病毒潜伏感染期,后两者表达受抑制,基因表达也最小化以逃避免疫监视,不产生子代病毒。潜伏感染的再激活会导致疾病发生及病毒传播。病毒编码的各种蛋白质功能有待进一步研究,同时病毒体中所含有的宿主蛋白及RNA对病毒的影响也引起了人们的重视,可用分子生物学方法检测或电子显微镜观察其对病毒增殖过程的影响。

A series of proteins and DNA transport into nucleus, and form three kinds of related capsids. A-capsids are shells composed of the four integral proteins and have the simplest structure. B-capsids contain all of the A-capsid proteins and several additional internal scaffold proteins (UL80). C-capsids are from the cytoplasmic fraction of infected cells treated with NP-40 and are composed of the DNA genome within an A-capsid shell containing some tightly adherent tegument proteins (e.g., pUL32, pUL47, pUL48).
图1HCMV核衣壳形成的模式图
Fig.1Capsidassemblymodel
被病毒感染的细胞中除存在具有感染性的病毒体外,还有另外2种非感染性病毒颗粒:非感染性包膜颗粒(noninfectious enveloped particle,NIEP)和致密体( dense body,DB)颗粒。NIEP数量极少,与病毒体的区别在于无病毒DNA。DB颗粒由大量被膜蛋白pp65和少量其他蛋白、RNA及外面包绕的包膜构成。
本文仅从核衣壳的形成开始,将近年来HCMV组装的研究新进展作一综述。
1 核衣壳的形成
HCMV核衣壳的形成如图1所示,要经历pAP-蛋白酶前体(protease precusor, pPR)-主要衣壳蛋白(major capsid protein, MCP)复合物形成、壳微粒前体形成、异源三聚体形成、入核、原始衣壳形成和衣壳成熟。
pAP-pPR-MCP复合物的形成:该组装起始于细胞质中。首先由氨基端保守结构域(amino conserved domain,ACD)促进pAP相互结合,这又促进其通过羧基端(C端)保守结构域(carboxyl conserved domain,CCD)与MCP(pUL86)结合。这种结合使缺少核定位序列(nuclear localization signal,NLS)的MCP借助pAP-MCP复合体上pAP的2个NLS转移到细胞核内。ACD的生物学作用是通过研究突变病毒株发现的,突变株病毒复制减缓,组装衣壳的效率下降,比野生型毒株慢约20倍[6]。同样,NLS的生物学作用也是通过突变株发现的,NLS1/NLS2双突变对病毒来说是致命的,失去其中一个即可降低MCP的入核效率,失去NLS2对病毒的影响更大[7]。因为pPR具有与pAP相同的C端,故其能通过ACD与pAP相连,通过CCD与MCP相连,使pPR进入衣壳腔并获得酶的功能,有酶活性的pPR在衣壳形成后期剪切原始衣壳上的蛋白肽链,使它们从原始衣壳上脱落并进一步排出。入核前在胞质中会形成3种最基本、最简单的复合物:pAP-MCP、pAP-pPR-MCP和pPR-MCP。其中pAP-pPR-MCP的结构模式如图2所示。
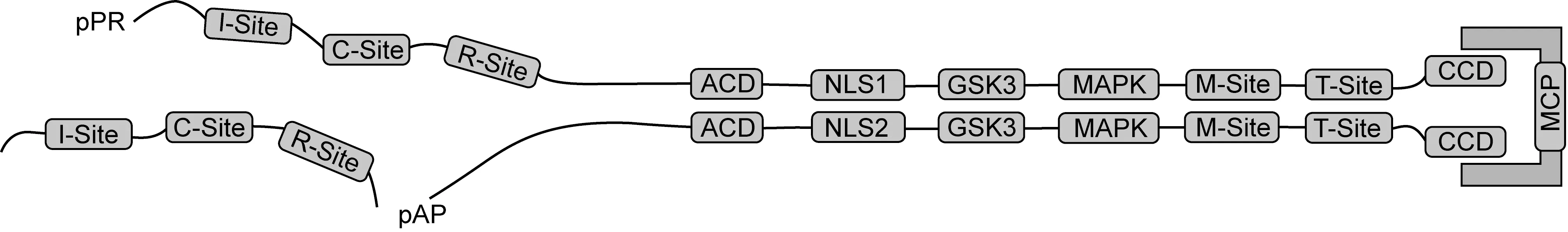
The amino conserved domain (ACD), which promotes self-interaction of pAP and pPR; the carboxyl conserved domain (CCD), which promotes (continued) interaction of pAP and pPR with MCP; nuclear localization signals 1 and 2 (NLS1, NLS2); mitogen-activated protein kinase (MAPK) and glycogen synthase kinase 3 (GSK-3) sites whose phosphorylation antagonizes self-interaction of pAP; and the five pPR self-cleavage sites: M-site,R-site,I-site, C-site, and T-site.
图2pAP-pPR-MCP的结构模式图
Fig.2ThemodelofpAP-pPR-MCP
壳微粒前体形成:以上述3种复合物为基础,继续结合形成更大的复合物,其为一个较大的多聚体,称壳微粒前体。
mCP、mCBP形成三聚体:在细胞质中,mCP虽足够小,能完全通过扩散穿过膜,但不能进入胞核,因其缺少NLS。同样,存在于胞质中具有NLS的蛋白mCBP也不能单独进入细胞核。当它们同时在细胞质中表达集聚时,可形成异源三聚体,以此形式方能共同进入胞核。
入核:壳微粒前体与上述异源三聚体在NLS的帮助下进入核内,出口蛋白也进入核,在自身NLS作用下不需要其他病毒蛋白的协助[4]。
原始衣壳形成: 壳微粒前体结合异源三聚体及出口蛋白形成原始蛋白衣壳。原始衣壳没有棱角,不含病毒DNA,有出口蛋白,需进一步剪切。研究表明,出口蛋白形成出口蛋白复合物不需任何其他病毒蛋白的协助[4]。出口蛋白复合物包括冠部、翼部和柄部[4]。
衣壳成熟:此时的衣壳需进一步成熟,经自身剪切作用将部分蛋白肽链从原始衣壳上剪切下来,剪切位点在pAP及pPR上(图2)。断裂位点及顺序是:在pPR作用下,R、M位点先断裂;在次晶蛋白作用下,I、C位点后断裂[8]。ACD也在此过程中发挥重要作用。此过程中,衣壳形态发生相应变化,产生棱角。
核衣壳形成(剪切脱落物排出与DNA进入):这两个过程几乎同时进行。随着DNA进入衣壳的量增多,衣壳中剪切脱落物所占比例逐渐下降。DNA进入促进剪切产物排出,同时剪切产物磷酸化减弱它们之间的连接,也促使剪切产物排出[9]。DNA进入衣壳需末端酶-出口蛋白复合体的帮助[10],而pUL7则在衣壳内对DNA起稳定作用。
2 被膜与包膜的形成
HCMV被膜与包膜形成是密不可分、同时进行的。研究表明,被膜与包膜形成、病毒出核及出细胞密切相关。在病毒颗粒出核、出细胞过程中,经历包膜形成与去除及包膜二次形成。第2次包膜形成也是最终包膜伴随病毒出细胞膜的过程。图3概括了被膜与包膜的形成过程。这种机制是非选择性的,不仅可形成病毒体,还可能形成无病毒DNA的NIEP,以及包膜包裹大量被膜蛋白pp65、少量其他蛋白和RNA形成的致密体颗粒。当病毒的某些被膜蛋白突变或缺失时,可导致NIEP和DB颗粒形成增加[11]。

Tegument and envelop migrate out of the nucleus. This mechanism is not selective for DNA-containing particles. At least three distinct parallel processes contribute to the final virion membrane.
图3HCMV被膜与包膜形成过程示意图
Fig.3Modeloftegumentationandenvelopment
包膜的初次形成发生在核内膜处,这有助于病毒颗粒穿过核内膜进入核周间隙。现已知疱疹病毒此过程需2组保守蛋白质,在HCMV为pUL50和pUL53,它们之间相互结合可能启动包膜初次形成;HCMV M50/p35与细胞中蛋白激酶C结合,转移到核膜处并发挥作用,使核纤层蛋白磷酸化,磷酸化后核膜与其下方的核纤层蛋白连接减弱,有利于病毒穿过核内膜进入核周间隙。接着可观察到进入核周间隙的病毒颗粒获得包膜,但这只是暂时的。很快其与细胞核外膜融合,病毒颗粒进入细胞质,失去初始包膜。
已有研究发现,被膜蛋白组装可能在细胞核中就已开始,但需在细胞质中完成最后组装。被膜蛋白的组装过程及机制非常复杂,涉及病毒蛋白之间的相互作用和宿主细胞的参与。其中还有很多问题有待进一步研究。
最后,核衣壳以出芽方式进入胞质小泡或小管,获得最终包膜,形成组装小室(组装复合体),并完成被膜蛋白组装及成熟过程。这一过程由pUL71的亮氨酸拉链结构域启动[12],并需pUL99参与,否则会造成具有被膜的核衣壳积聚在细胞质中。在出芽形成包膜的过程中发生了一系列变化,如被膜蛋白凝集紧密、膜增厚等。这些变化发生在膜与衣壳密切接触的地方,表明在包膜形成过程中这里发生了结构和组分变化。
3 影响病毒体组装的4个重要因素
3.1 组装小室与包膜来源
组装小室由修饰后的细胞分泌系统、内体和高尔基复合体外侧网络形成,而不是由内质网、高尔基复合体内侧及中间膜囊形成。这些分泌器官形成的小室组成需进一步改造,以完成病毒体组装成熟。组装小室中包含各种病毒编码的被膜蛋白、包膜蛋白和一些非结构性蛋白。研究发现,最终包膜来自于几种不同的小囊泡,并最终形成一个膜。大囊泡的形成代表病毒体组装的最终位置即组装小室[13]。
已知组装和成熟过程有较明确的3条平行途径。①运输必需内涵体分选复合物(endosomal sorting complex required for transport, ESCRT)系统或转运高尔基复合体形成的转运pUL99的小囊泡。Tandon等关于空泡蛋白分选蛋白4(vacuolar protein sorting 4,Vps4)和带电荷多囊泡体蛋白1 (charged multivesicular body protein 1,CHMP1)的研究证实了这点[14];②内体(endosome)系统形成的转运gB的小囊泡;③ 由网格蛋白(clathrin)介导的非高尔基复合体源性小管转运pUL32。Cepeda等[15]的研究证实了前2条途径。如果阻断组装小室的形成,或许可使病毒不能形成完整病毒体。
3.2 单个病毒体蛋白的影响作用
已有研究显示,多种HCMV被膜蛋白及包膜蛋白如pp150(pUL32)、pp28(pUL99)、gO、gM/gN 等介导病毒在胞质中的组装与第2次包膜形成。pp150(pUL32)可能影响衣壳的稳定性或引导衣壳在胞质内转移;pUL96对pp150连接在核衣壳上起稳定作用[16];pp28(pUL99)可能协助包膜形成,它是被膜的重要组成成分,突变导致无包膜、无感染性的病毒颗粒积聚在胞质中[17]。有研究还发现,pp28在组装小体中形成多聚体对包膜形成至关重要[18]。pUL97影响病毒组装小室的形态,并通过酶活性途径影响组装小室形成,通过非酶途径加快病毒体形成与释放[19]。不同被膜蛋白的重要性也有区别,有的是病毒所必需的,有的则影响病毒的增殖动力学,如pUL25是非必需蛋白,可加速病毒体形成[20];pUL71缺乏会导致包膜形成减缓及组装过程中小囊泡扩大。Jiang等[21]也证明,pUL74能促进最终包膜形成。有研究提示,病毒的某些单个被膜蛋白缺失可导致整个病毒构成发生变化[22]。各病毒体不同蛋白的ORF缺失会导致病毒体不能形成,形成突变病毒体和发生重要的病毒增殖缺陷(分别用“E”、“NE”、“D”表示,详见表1),这反映了各蛋白的不同重要性[23]。
表1部分蛋白ORF缺失及其影响
Tab.1DeletionofORFs

EffectionCapsid proteinTegument proteinEnvelope proteinEUL46, UL48.5, UL80, UL85, UL86UL122, UL32, UL71, UL89.2, UL51,UL94, UL99, UL54, UL48C, UL48N, UL44 UL50, UL77NEUS24, UL45, UL25, US22, UL124, UL43DUL103, UL88, US23, UL26,UL47,UL112.1, UL35, UL72, UL82UL38, UL132
E, essential; NE, non-essential; D, defective growth.
3.3 具有重要意义的蛋白间结合
研究发现,病毒蛋白间常相互连接在一起存在于宿主细胞中,这对病毒的组装可能具有重要意义。目前认为,病毒蛋白间存在4种结合:①衣壳蛋白间结合;②衣壳蛋白与被膜蛋白结合,可促进被膜形成及获得感染性;③被膜蛋白间结合,构成被膜的结构基础,并在被膜修饰与形成中起重要作用;④被膜蛋白与包膜蛋白及包膜蛋白间结合,目前对其了解并不多。Phillips等[24]应用酵母双杂交分析法检测任意2种被膜蛋白间可能存在的连接,同时To等[23]则应用酵母双杂交分析法和免疫共沉淀法检测了更多蛋白(包括衣壳蛋白、被膜蛋白和包膜蛋白)间存在的连接,结果显示这些蛋白间连接广泛而复杂。这些复杂的相互连接网络对病毒组装成熟和出胞感染非常重要,如pUL69和pUL97进入衣壳需pp65(pUL83)的存在[25],pUL25也部分依赖与pp65结合而进入病毒体[26],pUL94与pUL99的结合对蛋白质在组装复合体中的定位具有重要意义[27,28]。弄清这些蛋白间的相互作用可对病毒的生物学组装机制提供新的认识,并为抗病毒药物的设计与开发提供新的思路与指导。
3.4 宿主细胞的参与
在HCMV感染细胞中,免疫球蛋白结合蛋白(immunoglobulin binding protein,BiP)水平异常增高,在病毒组装和成熟过程中起重要作用[29]。宿主细胞BiP缺失引起的表型与pp28突变体相似[30],提示BiP与pp28作用于病毒成熟的同一阶段。有研究显示,HCMV感染提高Rab27a表达水平,大量Rab27a募集在组装小体的膜上;敲除Rab27a时,HCMV生成减少[31]。另外,电子显微镜下观察到细胞膜局部成分对最终包膜形成具有重要意义[32]。这些都反映了宿主细胞参与病毒组装,进一步弄清宿主与病毒间的相互作用对抗病毒药物的研发具有重要意义。
后期的成熟过程尚有病毒相关激酶所致的蛋白磷酸化[33]、糖基化,以及被膜与包膜的改建等,使病毒体出壳并赋予其感染性。在高相对分子质量的被膜蛋白pUL48氨基端发现了含半胱氨酸泛素蛋白酶活性[34],表明其可能参与了后期成熟过程。
4 结语
HCMV的组装可概括为两大阶段:一是入核阶段,主要为核衣壳的组装;二是出核阶段,主要涉及被膜与包膜的组装。还有很多问题有待进一步研究,如原始衣壳内剪切物排出的动力及具体机制、被膜蛋白组装具体机制、宿主细胞参与机制等。搞清楚HCMV的组装过程可为病毒的生物学组装机制提供新的认识,加深对病毒与宿主间关系的理解,为抗病毒药物的设计与开发提供新的思路与指导,具有重要的基础和临床意义。
[1] Grosse SD, Ross DS, Dollard SC. Congenital cytomegalovirus (CMV) infection as a cause of permanent bilateral hearing loss: a quantitative assessment [J]. J Clin Virol, 2008,41(2):57-62.
[2] Söderberg-Nauclér C. Does cytomegalovirus play a causative role in the development of various inflammatory diseases and cancer [J]? J Intern Med, 2006, 259(3):219-246.
[3] Yu X, Shah S, Lee M, Dai W, Lo P, Britt W, Zhu H, Liu F, Zhou ZH. Biochemical and structural characterization of the capsid-bound tegument proteins of human cytomegalovirus [J]. J Struct Biol, 2011, 174(3):451-460.
[4] Holzenburg A, Dittmer A, Bogner E. Assembly of monomeric human cytomegalovirus pUL104 into portal structures [J]. J Gen Virol, 2009, 90(Pt10): 2381-2385.
[5] Terhune SS, Schröer J, Shenk T. RNAs are packaged into human cytomegalovirus virions in proportion to their intracellular concentration [J]. J Virol, 2004, 78(19): 10390-10398.
[6] Loveland AN, Nguyen NL, Brignole EJ, Gibson W. The amino-conserved domain of human cytomegalovirus UL80a proteins is required for key interactions during early stages of capsid formation and virus production [J]. J Virol, 2007, 81(2): 620-628.
[7] Nguyen NL, Loveland AN, Gibson W. Nuclear localization sequences in cytomegalovirus capsid assembly proteins (UL80 proteins) are required for virus production: inactivating NLS1, NLS2, or both affects replication to strikingly different extents [J]. J Virol, 2008, 82(11): 5381-5389.
[8] Loveland AN, Chan CK, Brignole EJ, Gibson W. Cleavage of human cytomegalovirus protease pUL80a at internal and cryptic sites is not essential but enhances infectivity [J]. J Virol, 2005, 79(20): 12961-12968.
[9] Casaday RJ, Bailey JR, Kalb SR, Brignole EJ, Loveland AN, Cotter RJ, Gibson W. Assembly protein precursor (pUL80.5 homolog) of simian cytomegalovirus is phosphorylated at a glycogen synthase kinase 3 site and its downstream “priming” site: phosphorylation affects interactions of protein with itself and with major capsid protein [J]. J Virol, 2004, 78(24): 13501-13511.
[10] Trus BL, Cheng N, Newcomb WW, Homa FL, Brown JC, Steven AC. Structure and polymorphism of the UL6 portal protein of herpes simplex virus type 1 [J]. J Virol, 2004, 78(22):12668-12671.
[11] Das S, Pellett PE. Spatial relationships between markers for secretory and endosomal machinery in human cytomegalovirus-infected cells versus those in uninfected cells [J]. J Virol, 2011, 85(12): 5864-5879.
[12] Meissner CS, Suffner S, Schauflinger M, von Einem J, Bogner E. A leucine zipper motif of a tegument protein triggers final envelopment of human cytomegalovirus [J]. J Virol, 2012, 86(6): 3370-3382.
[13] Moorman NJ, Sharon-Friling R, Shenk T, Cristea IM. A targeted spatial-temporal proteomics approach implicates multiple cellular trafficking pathways in human cytomegalovirus virion maturation [J]. Mol Cell Proteomics, 2010, 9(5):851-860.
[14] Tandon R, AuCoin DP, Mocarski ES. Human cytomegalovirus exploits ESCRT machinery in the process of virion maturation [J]. J Virol, 2009, 83(20): 10797-10807.
[15] Cepeda V, Esteban M, Fraile-Ramos A. Human cytomegalovirus final envelopment on membranes containing both trans-Golgi network and endosomal markers [J]. Cell Microbiol, 2010, 12(3):386-404.
[16] Tandon R, Mocarski ES. Cytomegalovirus pUL96 is critical for the stability of pp150-associated nucleocapsids [J]. J Virol, 2011, 85(14): 7129-7141.
[17] Britt, WJ, Jarvis M, Seo JY, Drummond D, Nelson J. Rapid genetic engineering of human cytomegalovirus by using a lambda phage linear recombination system: demonstration that pp28 (UL99) is essential for production of infectious virus [J]. J Virol, 2004, 78(1):539-543.
[18] Seo JY, Britt WJ. Multimerization of tegument protein pp28 within the assembly compartment is required for cytoplasmic envelopment of human cytomegalovirus [J]. J Virol, 2008, 82(13): 6272-6287.
[19] Goldberg MD, Honigman A, Weinstein J, Chou S, Taraboulos A, Rouvinski A, Shinder V, Wolf DG. Human cytomegalovirus UL97 kinase and nonkinase functions mediate viral cytoplasmic secondary envelopment [J]. J Virol, 2011, 85(7): 3375-3384.
[20] Zini N, Battista MC, Santi S, Riccio M, Bergamini G, Landini MP, Maraldi NM. The novel structural protein of human cytomegalovirus, pUL25, is localized in the viral tegument [J]. J Virol, 1999, 73(7): 6073-6075.
[21] Jiang XJ, Adler B, Sampaio KL, Digel M, Jahn G, Ettischer N, Stierhof YD, Scrivano L, Koszinowski U, Mach M, Sinzger C. UL74 of human cytomegalovirus contributes to virus release by promoting secondary envelopment of virions [J]. J Virol, 2008, 82(6): 2802-2812.
[22] Michael K, Böttcher S, Klupp BG, Karger A, Mettenleiter TC. Pseudorabies virus particles lacking tegument proteins pUL11 or pUL16 incorporate less full-length pUL36 than wild-type virus, but specifically accumulate a pUL36 N-terminal fragment [J]. J Gen Virol, 2006, 87(Pt 12): 3503-3507.
[23] To A, Bai Y, Shen A, Gong H, Umamoto S, Lu S, Liu F. Yeast two hybrid analyses reveal novel binary interactions between human cytomegalovirus-encoded virion proteins [J]. PLoS One, 2011, 6(4): e17796.
[24] Phillips SL, Bresnahan WA. Identification of binary interactions between human cytomegalovirus virion proteins [J]. J Virol, 2011, 85(1):440-447.
[25] Chevillotte M, Landwehr S, Linta L, Frascaroli G, Lüske A, Buser C, Mertens T, Einem J. Major tegument protein pp65 of human cytomegalovirus is required for the incorporation of pUL69 and pUL97 into the virus particle and for viral growth in macrophages [J]. J Virol, 2009, 83(6): 2480-2490.
[26] Becke S, Fabre-Mersseman V, Aue S, Auerochs S, Sedmak T, Wolfrum U, Strand D, Marschall M, Plachter B, Reyda S. Modification of the major tegument protein pp65 of human cytomegalovirus inhibits virus growth and leads to the enhancement of a protein complex with pUL69 and pUL97 in infected cells [J]. J Gen Virol, 2010, 91(Pt 10):2531-2541.
[27] Phillips SL, Cygnar D, Thomas A, Bresnahan WA. Interaction between the human cytomegalovirus tegument proteins UL94 and UL99 is essential for virus replication [J]. J Virol, 2012, 86(18): 9995-10005.
[28] Phillips SL, Bresnahan WA.The human cytomegalovirus (HCMV) tegument protein UL94 is essential for secondary envelopment of HCMV virions [J]. J Virol, 2012, 86(5): 2523-2532.
[29] Buchkovich NJ, Yu YJ, Pierciey FJ Jr, Alwine JC. Human cytomegalovirus induces the endoplasmic reticulum chaperone BiP through increased transcription and activation of translation by using the BiP internal ribosome entry site [J]. J Virol, 2010, 84(21): 11479-11486.
[30] Buchkovich NJ, Maguire TG, Paton AW, Paton JC, Alwine JC. Human cytomegalovirus specifically controls the levels of the endoplasmic reticulum chaperone BiP/GRP78, which is required for virion assembly [J]. J Virol, 2008, 82(1):31-39.
[31] Fraile-Ramos A, Cepeda V, Elstak E, van der Sluijs P. Rab27a is required for human cytomegalovirus assembly [J]. PLoS One,2010, 5(12): e15318.
[32] Schauflinger M, Villinger C, Mertens T, Walther P, von Einem J. Analysis of human cytomegalovirus secondary envelopment by advanced electron microscopy [J]. Cell Microbiol, 2013, 15(2): 305-314.
[33] Nogalski MT, Podduturi JP, Demeritt IB, Milford LE, Yurochko AD. The human cytomegalovirus virion possesses an activated casein kinase Ⅱ that allows for the rapid phosphorylation of the inhibitor of NF-kappaB, IkappaBalpha [J]. J Virol, 2007, 81(10):5305-5314.
[34] Wang J, Loveland AN, Kattenhorn LM, Ploegh HL, Gibson W. High-molecular-weight protein (pUL48) of human cytomegalovirus is a competent deubiquitinating protease: mutant viruses altered in its active-site cysteine or histidine are viable [J]. J Virol, 2006, 80(12):6003-6012.

